В настоящее время ВПЧ и ассоциированные с ним заболевания занимают лидирующие позиции в структуре гинекологической заболеваемости. Ежегодно ВПЧ инфицируются более 14 миллионов человек повсеместно, при этом около 80% приходится на сексуально активное население планеты [1]. Вирус обладает тропностью к эпителиоцитам человека вне зависимости от их локализации, проникает в ткань через микроскопические трещины и достигает базального слоя эпителия кожи и слизистых оболочек, внедряясь в высоко пролиферирующие стволовые клетки [29].
Одним из наиболее частых проявлений папилломавирусной инфекции (ПВИ) являются аногенитальные бородавки (АБ). АБ — это заболевание, обусловленное ВПЧ, передаваемое преимущественно половым путем, характеризующееся появлением экзофитных и эндофитных разрастаний на коже и слизистых оболочках наружных половых органов, уретры, влагалища, шейки матки и перианальной области [4].
По данным Европейских рекомендаций по лечению АБ, ежегодно регистрируется 0,13–0,16% новых случаев заболевания [5]. Результаты масштабного систематического обзора C.C. Lopaschuk и соавт. 2013 года продемонстрировали, что АБ встречаются по крайней мере у 1% населения планеты в возрасте от 15 до 49 лет [3, 30]. Наиболее часто АБ регистрируются у женщин 20–40 лет, при этом клинические проявления ПВИ наблюдаются у 14,6–64,2% инфицированных женщин1 [4, 5].
По данным Российских клинических рекомендаций, заболеваемость АБ среди людей в возрасте 15–17 лет составляет 21,1 случая на 100 тысяч человек и 22,8 случая среди людей старше 18 лет2. Вместе с тем данные международных и российских эпидемиологических исследований не отражают истинного уровня распространенности АБ ввиду недостаточной диагностики и регистрации новых случаев заболевания.
На сегодняшний день полностью секвенированы и описаны более 220 типов ВПЧ, которые поражают разные локусы эпителиальных клеток3. Известно, что в соответствии с потенциалом к канцерогенезу ВПЧ подразделяют на высоко- и низкоонкогенные типы, при этом в 90% случаев АБ ассоциированы с ВПЧ низкого онкогенного риска, в частности с 6 или 11 типами (табл.) [6]. Следует отметить, что в 10% случаев АБ могут быть ассоциированы с ВПЧ высокого онкогенного риска4 [3, 7]. Важно отметить, что ВПЧ может поражать не только урогенитальный тракт, но и быть причиной развития заболеваний гортани, ротовой полости, конъюнктивы и других органов и систем организма (см. табл.).
Таблица
Клинические проявления заболеваний, ассоциированных с вирусом папилломы человека
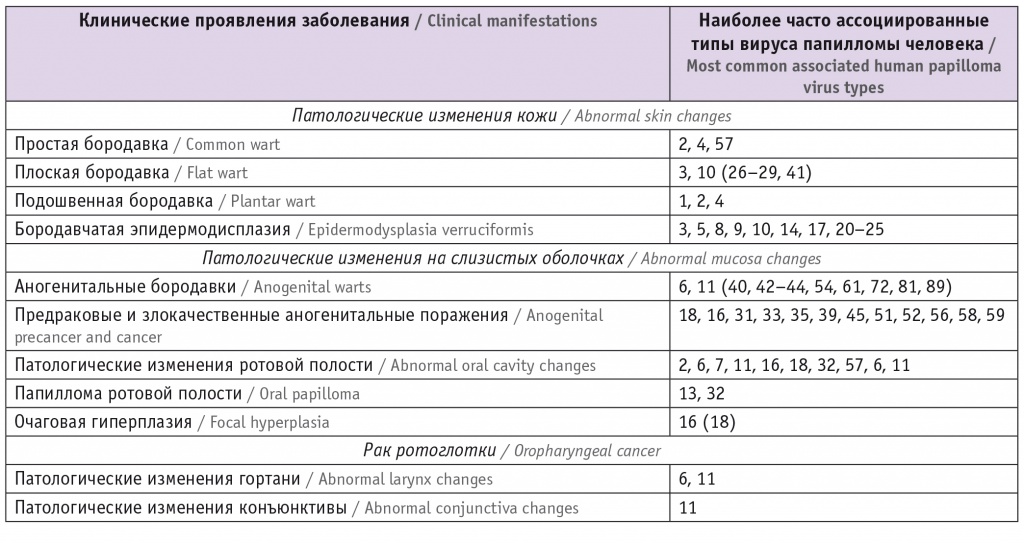
В настоящее время среди исследователей сложилось единое мнение, что высокоонкогенным типам ВПЧ присущи свойства, которые не встречаются у ВПЧ низкого канцерогенного риска. Главным отличительным признаком в механизме развития канцерогенного потенциала разных типов ВПЧ считаются функциональные возможности онкобелков ВПЧ: Е5, Е6 и Е7. Известно, что высокоонкогенные типы ВПЧ экспрессируют поздние белки Е6 и Е7 с одного промоторного участка; низкоонкогенные типы ВПЧ экспрессируют эти же белки, но с разных участков промотора [2]. Поэтому определение роли вирусных белков в жизненном цикле ВПЧ представляет огромный научный интерес, который влияет на подходы к диагностике и лечению ВПЧ-ассоциированных заболеваний.
Многие зарубежные исследователи сходятся во мнении, что период между инфицированием ВПЧ и развитием клинических проявлений ПВИ варьирует: в среднем 2,9 месяца у женщин и 11,0 месяцев у мужчин [5]. Среднее время между инфицированием ВПЧ и развитием АБ составляет 11–12 и 5–6 месяцев у мужчин и женщин соответственно5. Вместе с тем, по данным ряда авторов, инкубационный период АБ для обоих полов составляет около 6–10 месяцев (максимально — до 18 месяцев) [1, 8].
Пациенты предъявляют жалобы на наличие образований в области наружных половых органов и расценивают их как косметическую проблему, снижающую качество их жизни6 [9]. Наиболее частыми проявлениями АБ являются боль, зуд, неприятные ощущения в области вульвы и влагалища, снижение либидо, а также тревога и депрессия, психоэмоциональные переживания, боязнь инфицировать полового партнера. В ряде случаев пациентки не предъявляют жалоб, и выявление АБ представляется возможным при тщательном клиническом осмотре и кольпо-, вагино- и вульвоскопии.
На сегодняшний день отсутствует общепринятая унифицированная классификация АБ. Выделяют различные клинические формы заболеваний, ассоциированных с ПВИ, которые проявляются на коже и слизистых оболочках: остроконечные кондиломы, бородавки в виде папул, поражения в виде пятен, бовеноидный папулез и болезнь Боуэна, гигантская кондилома Бушке-Левенштейна [4]. По данным ряда авторов, наиболее распространенными считаются поверхностные папулезные очаговые поражения, которые могут быть плоскими или на широком основании («на ножке»), одиночными или множественными. Следует отметить, что нередко множественные АБ сливаются и образуют крупные бляшки, диагностируемые чаще при иммунодефицитных состояниях или при отсутствии правильного лечения. Гигантские кондиломы чаще характеризуются доброкачественным характером течения. Вместе с тем клиницист должен обладать онкологической настороженностью ввиду потенциально возможной злокачественной трансформации.
Как правило, клинический диагноз АБ не вызывает сомнений и не требует гистологического подтверждения [10]. Если поставить диагноз на основании визуального осмотра затруднительно, то при наличии пигментированных образований, некротических изменений в области вульвы, рецидивирующего течения АБ и отсутствия эффекта терапии целесообразно провести прицельную биопсию измененного участка с дальнейшим гистологическим исследованием полученного материала7 [5]. При обнаружении гигантских кондилом Бушке-Левенштейна биопсия является обязательной для исключения инвазивного процесса [11, 12]. Так, исследование P. Kumar и соавт. 2017 года продемонстрировало, что клиническая картина АБ в ряде случаев симулирует злокачественный процесс по внешним признакам [13]. Вместе с тем результаты данного исследования не показали статистически значимых различий между частотой возникновения диспластических изменений вульвы и повышением уровня экспрессии маркера клеточной пролиферации p53 у пациентов с АБ [13].
В Российской Федерации диагностика АБ основывается на двух методах: визуальной оценке аногенитальной области при расширенной вульво-, вагино-, аноскопии и ВПЧ-тестировании методом ПЦР8. Данный молекулярно-генетический способ верификации ВПЧ является наиболее чувствительным и специфичным, что позволяет определить не только тип вируса, но и степень вирусной нагрузки, а также диагностировать и прогнозировать течение заболевания. В клинической практике широко используется ВПЧ-тестирование — Квант-21. Данная тест-система оценивает количество ДНК-копий ВПЧ на 105 эпителиоцитов и является маркером персистирующей ВПЧ-инфекции при уровне ДНК-копий вируса от 103 до 105. Следует отметить, что 105 ДНК-копий вируса и более может трактоваться как высокий риск прогрессии заболевания [14, 44].
Нередко АБ сочетаются с другими инфекционными заболеваниями урогенитального тракта. В этих ситуациях целесообразно применять дополнительные методы обследования с включением:
• микробиологического исследования содержимого влагалища и цервикального канала;
• бактериологического исследования микрофлоры влагалища;
• обследования на инфекции, передающиеся половым путем [15].
Следует отметить, что в ряде случаев целесообразна аноскопия при локализации АБ в области ануса [5].
Исследования ряда авторов показали, что у каждой третьей пациентки АБ сочетаются с цервикальной интраэпителиальной неоплазией (CIN) [3, 16]. Так, в исследовании M. Blomberg и соавт. 2019 года показано, что у женщин с АБ риск развития CIN2+ статистически значимо выше, чем у женщин без АБ (Отношение рисков: 2,43; 95%-ный ДИ: 2,30–2,56). Из 918609 женщин, включенных в исследование, у 32218 (3,5%) были диагностированы АБ. Анализ полученных результатов свидетельствует, что CIN2+ обнаруживался в 3 раза чаще у пациенток с АБ, чем у женщин без них, что составило 926 и 358 случаев на 100 тысяч человек соответственно. В исследовании также было показано, что более высокий риск развития CIN наблюдался у пациенток с резистентностью к лечению АБ (Отношение рисков: 1,20; 95%-ный ДИ: 1,01–1,43). При этом среди пациенток с АБ в 20% случаев диагноз CIN2+ был поставлен в течение первого года наблюдения, в 14% — через 1–2 года, в 13% — через 2–3 года, в 12% — через 3–4 года и в 40% случаев — более чем через 4 года после постановки диагноза АБ [18]. Авторы приходят к выводу, что необходимо тщательно наблюдать группу пациентов с выявленными АБ не менее 4 лет.
Результаты вышеупомянутого датского исследования основываются на более ранних работах, D.L.M. Monteiro и соавт. 2013 года и L. Tao и соавт. 2014 года, которые продемонстрировали, что у женщин с АБ в 4 раза выше риск развития СIN в течение первых 2 лет после постановки диагноза АБ [18, 19]. Крупномасштабное клиническое исследование, проведенное на базе Пекинского университета, также подтвердило, что АБ являются серьезным фактором риска развития плоскоклеточных интраэпителиальных поражений тяжелой степени (СIN2+) [19, 20]. Особую трудность представляет ведение пациенток с плоскоклеточными интраэпителиальными поражениями шейки матки низкой степени (low-grade squamous intraepithelial lesions, LSIL), которые включают в себя сочетанные субклинические формы ПВИ, АБ и CIN I. Необходимость их деструктивного лечения дисскутабельна, так как без полного гистологического исследования всего аномального эпителия невозможно исключить поражение более тяжелой степени [21]. Исходя из всего вышеизложенного, тщательный динамический контроль состояния шейки матки, включая жидкостную цитологию, ВПЧ-тестирование и расширенную кольпоскопию, необходимо проводить всем пациенткам с АБ9.
За последние несколько лет парадигма лечения АБ претерпела ряд изменений. Главной целью современного подхода к терапии АБ является не только устранение клинических проявлений заболевания, но и профилактика рецидивов АБ. Оптимального лечения АБ до сих пор не существует. Выбор терапии АБ должен базироваться на данных доказательной медицины. Эффективное лечение зависит от понимания основного процесса заболевания и возможных вариантов терапии в каждом конкретном случае [22, 23]. По данным Американских рекомендаций 2019 года, выбор оптимального лечения зависит от локализации, размеров и данных морфологического исследования АБ10. В клинической практике наиболее широко применяют физические методы деструкции АБ, к которым относятся электрокоагуляция, криодеструкция, лазерное и радиохирургическое лечение. Хирургический метод терапии АБ является наиболее эффективным, однако частота рецидивов после хирургического лечения составляет около 20–30% [5, 10, 24]. Кроме того, деструктивные методы лечения АБ воздействуют только на участок эпителия, где есть клиническая манифестация ПВИ, а окружающие этот участок ткани продолжают оставаться резервуаром ВПЧ в латентном или субклиническом состоянии, что, в свою очередь, приводит к развитию рецидива АБ [25].
Методы диагностики и лечения АБ были унифицированы в международных клинических рекомендациях 2019 года, разработанных группой экспертов [10]. Консервативные методы как один из возможных вариантов терапии АБ включают цитотоксические (5-фторурацил или подофиллин) и иммуномодулирующие препараты, а также концентрированные соли и кислоты (уксусную и азотную). Эти препараты применяют длительно и многократно, что вызывает местные воспалительные реакции: эритему, эрозии и даже язвенные дефекты слизистой вульвы и перианальной области. Эти побочные реакции могут стать серьезным основанием для того, чтобы ограничить использование некоторых терапевтических средств. Американское общество косметологов и дерматовенерологов рекомендует оценивать эффективность лечения АБ по основным критериям: регресс и частота рецидивов АБ11. В этой связи выбор метода терапии должен основываться на данных анамнеза, клинической картины заболевания и данных лабораторных методов обследования. Необходима дальнейшая оценка методов лечения, учитывая ограниченную эффективность большинства методов и частоту возникновения рецидивов АБ. Ни один из известных методов лечения АБ не обеспечивает предсказуемое, полноценное удаление АБ с низким процентом рецидивов [26].
Известно, что оптимальным методом лечения АБ является комбинированная терапия, основанная на сочетании деструкции видимых поражений и активаторов противовирусного иммунитета (интерферонов, ИФН), поскольку они обладают высокой эффективностью и снижают частоту возникновения рецидивов [27]. Так, по данным М.А. Гомберга и соавт. 2008 года, иммуномодулирующие препараты могут быть рекомендованы при рецидивирующем течении АБ, в случаях локализации процесса, вызванного ВПЧ как высокого, так и низкоонкогенного риска [27].
Сочетанное использование деструктивных методов лечения АБ и препаратов с иммуномодулирующим действием позволяет повысить эффективность лечения и снизить частоту рецидивов заболевания. Так, по данным Европейских клинических рекомендаций и систематических обзоров, использование ИФН в сочетании с хирургическими методами лечения АБ приводит к снижению рецидивов заболевания [28]. В систематическом обзоре M.E. Muse и соавт. 2020 года сравнительный анализ эффективности и безопасности лечения АБ показал, что цитотоксические и иммуномодулирующие местные препараты имели равную или более высокую эффективность (66–94%) по сравнению с хирургическими методами лечения и концентрированными солями и кислотами [29].
Иммунный статус пациента имеет решающее значение при развитии АБ. Следует отметить, что, по данным литературы, самоизлечение при АБ наблюдается в 40–60% случаев в течение 9–12 месяцев благодаря механизмам врожденного иммунного ответа [30]. В крупномасштабном систематическом обзоре M. Costa-Silva и соавт. 2017 года показано, что целесообразно проводить терапию АБ в течение первых 2-х лет при отсутствии регресса заболевания [6]. Однако данные выводы не распространяются на группы пациентов с ослабленным иммунитетом и иммунодефицитными состояниями [31].
Взаимодействие врожденного и приобретенного иммунитетов является важным фактором иммунной защиты. В свою очередь, врожденный иммунитет не имеет специфической памяти, но активирует необходимый иммунный ответ со стороны цитотоксических клеток [32]. Таким образом, при повреждении клетки вирусом включается механизм врожденного иммунного ответа и активируются сенсорные механизмы (Toll-подобные рецепторы и цитозольные рецепторы), вызывающие воспалительный ответ [33]. ВПЧ влияет на межклеточное взаимодействие и, как следствие, приводит к изменению синтеза регуляторных белков иммунной системы — цитокинов [32]. В свою очередь, вышеописанное изменение нарушает врожденную иммунную защиту и дезактивирует клетки местной паренхимы и фагоцитов, которые синтезируют цитокины и другие протективные элементы, привлекающие еще больше клеток-эффекторов к месту воспаления. В этой связи формируется порочный круг нарушения регуляторных механизмов, что приводит к дезадаптации иммунного ответа [34].
В настоящее время проведены многочисленные исследования с целью изучения местных и системных ИФН для лечения АБ [35-37]. По данным Европейских клинических рекомендаций, системный ИФН не продемонстрировал значительного клинического эффекта по сравнению с его локальным использованием в лечении АБ [5]. Проведенный метаанализ эффективности локального ИФН показал более высокий процент достижения клинического эффекта по сравнению с группой плацебо. В систематическом обзоре J. Yang и соавт. 2018 года было выдвинуто предположение, что иммуномодулирующую терапию препаратами ИФН следует рассматривать в качестве основного метода комплексной терапии в случае неэффективности других методов лечения [31]. По данным мировой и отечественной литературы, иммуномодулирующая терапия является эффективным методом лечения и может применяться в качестве моно- и комбинированной терапии АБ [38]. Следует дифференцированно подходить к тактике ведения пациентов с АБ в зависимости от количества выявленных АБ: пациенткам с 1–5 бородавками рекомендовано первоначальное применение хирургических методов с последующей иммунотерапией. Вместе с тем пациенткам с 5 и более АБ рекомендована иммунотерапия в течение первых двух месяцев с последующим хирургическим воздействием и повторным двухмесячным курсом иммуномодуляторов [10].
В последние годы в России появилось целое поколение иммуномодуляторов, способных оказывать воздействие на иммунную систему12. Известно, что широко используемые для лечения различных гинекологических заболеваний три типа человеческого ИФН обладают иммуностимулирующими, противовирусными и антипролиферативными свойствами13 [17, 23, 39].
В организме человека ИФН — это эндогенные цитокины, продуцируемые Т-клетками, фибробластами и другими клетками в ответ на вирусную инфекцию и прочие биологические агенты. В многочисленных публикациях описано, что ИФН связывается со специфическими рецепторами на клеточных мембранах и индуцирует активацию ферментов, подавление пролиферации клеток, ингибирование вирусной репликации, усиление фагоцитарной активности макрофагов и цитотоксической активности Т-лимфоцитов. Таким образом, активированные CD8+ Т-лимфоциты и NK-клетки усиливают дифференцировку В-лимфоцитов и продукцию ими антител, активируя моноцитарно-макрофагальную систему и фагоцитоз, что увеличивает вероятность распознавания вирусных частиц клетками иммунной системы [40].
Одним из отечественных препаратов, зарегистрированных и широко используемых в клинической практике для лечения АБ, является препарат ВИФЕРОН®, содержащий рекомбинантный ИФН альфа-2b и активные компоненты — витамины С и Е. Входящие в состав препарата высокоактивные антиоксиданты — аскорбиновая кислота и альфа токоферола ацетат — обладают мембраностабилизирующим эффектом и оказывают потенцирующее действие на выработку собственного ИФН и таким образом усиливают выработку ИФН в 10–14 раз, что приводит к более выраженному клиническому эффекту и предотвращает развитие рецидивов заболевания. Препарат подавляет репликацию ДНК- и РНК-содержащих вирусов, усиливает иммуностимулирующий эффект на клеточное и гуморальное звено иммунитета, что крайне важно в регуляции воспаления в очаге поражения. Согласно официальной инструкции, препарат имеет широкий спектр показаний к применению и может быть использован для лечения ВПЧ-ассоциированных заболеваний [41].
В качестве комплексной терапии при лечении АБ этот препарат используют в виде ректальных суппозиториев в дозе 500000 МЕ 2 раза в сутки в течение 10 дней, соблюдая интервал в 12 часов, а также в виде геля, который наносят на локальные участки кожи и слизистые оболочки наружных половых органов 2 раза в сутки в течение 30 дней. Ректальное введение рекомбинантного ИФН альфа-2b обеспечивает наибольшую концентрацию и увеличивает время нахождения ИФН альфа-2b в крови по сравнению с парентеральным введением. В то же время препарат ВИФЕРОН® в форме геля формирует защитную пленку на поверхности пораженных участков и минимизирует рецидивы инфицирования базального слоя эпидермиса, блокирует повторную сборку вируса в поверхностных слоях кожи, а также стимулирует местный иммунитет [41].
Авторы статьи имеют собственный опыт применения препарата ВИФЕРОН® в лечении АБ. В исследование были включены 30 пациенток с выявленными АБ в возрасте 18–45 лет (средний возраст женщин составил 28,8 ± 5,8 года), обратившихся на консультативный прием в научно-поликлиническое отделение ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Всем пациенткам провели комплексное клинико-лабораторное обследование: визуальный осмотр, ВПЧ-тестирование (ПЦР тест Квант-21), микроскопическое исследование отделяемого из влагалища, расширенную кольпо-, вульвоскопию, жидкостную цитологию, гистологическое исследование и выскабливание цервикального канала (по показаниям).
По результатам визуального осмотра и кольпо- и вульвоскопического исследований, наиболее частой клинической формой АБ были единичные и множественные остроконечные кондиломы в области вульвы и преддверия влагалища,
и в 3 случаях АБ были распространены в перианальной области. У одной пациентки была выявлена гигантская кондилома Бушке-Левенштейна в области вульвы и наружных половых органов. Признаки цервицита и вульвовагинита выявлены у 12 (40%) пациенток, что подтверждалось данными микроскопического исследования: у 5 (16,6%) пациенток — вульвовагинальный кандидоз, у 4 (13,3%) пациенток — бактериальный вагиноз, у 3 (10%) пациенток — сочетание обоих заболеваний.
ВПЧ-тестирование выявило низкоонкогенные типы ВПЧ в большинстве наблюдений: 6 тип встречался у 19 (63,3%) женщин, 11 тип — у 4 (13,3%), 16 тип — у 3 (10%), 51 и 33 типы — у 2 (6,6%), 15, 58 и 31 типы — у 2 (6,6%) пациенток. АБ сочетались с CIN шейки матки в 7 (23,3%) случаях: у 4 (57,1%) пациенток цитологическое заключение соответствовало СIN 1; у 2 (28,6%) — CIN 2 и у 1 (14,3%) — CIN 3. С учетом результатов исследований всем пациенткам была рекомендована комплексная терапия АБ:
ВИФЕРОН®, суппозитории ректальные, 3000000 МЕ, 1 раз в сутки в течение 30 дней (курсовая доза — 90000000 МЕ) в сочетании с гелем Виферон® 36 000 МЕ/г для наружного и местного применения на область вульвы и перианальную область на очаги поражения по 2 грамма 2 раза в сутки в течение 30 дней.
На фоне лечения при контрольном осмотре через месяц у 63,3% пациенток наблюдался полный клинический эффект (отсутствие остроконечных кондилом), в 36,6% случаев —частичный клинический эффект (остроконечные кондиломы уменьшились в размерах). У пациентки с гигантской кондиломой Бушке-Левенштейна на фоне лечения препаратом ВИФЕРОН® отмечалось уменьшение образования, что позволило уменьшить объем хирургического вмешательства.
На втором этапе пациенткам, у которых наблюдался частичный клинический эффект на фоне лечения препаратом ВИФЕРОН®, было проведено деструктивное лечение с применением СО-2 лазера, с последующим применением препарата ВИФЕРОН® в форме ректальных суппозиториев в дозе 1000000 МЕ 1 раз в сутки в течение 30 дней (курсовая доза — 30000000 МЕ) в сочетании с гелем Виферон® 36 000 МЕ/г для наружного и местного применения 2 раза в сутки.
Пациенткам с CIN 2 и CIN 3 было проведено хирургическое лечение патологии шейки матки согласно алгоритму ведения действующих клинических рекомендаций РФ, затем был назначен ВИФЕРОН®, который пациентки применяли в течение 30 дней. Последовавший динамический контроль через 6 месяцев не выявил рецидивов АБ ни в одном случае. Таким образом, полученные результаты свидетельствуют о высокой клинической эффективности препарата ВИФЕРОН® в виде ректальных суппозиториев и геля для наружного и местного применения в лечении АБ различных клинических форм.
Следует отметить, что применение многих иммуномодулирующих препаратов и деструктивных методов лечения АБ во время беременности крайне ограничено. Доказано, что беременность является фактором риска развития ПВИ и способствует репликации и персистенции ВПЧ [42]. Основная задача терапии во время беременности — подавить распространение и прогрессирование ВПЧ-ассоциированных заболеваний шейки матки, вульвы и влагалища [6]. Рекомбинантный ИФН альфа-2b входит в список жизненно важных лекарственных средств, разрешен к применению детям с первых дней жизни и беременным с 14 недели гестации [6].
Так, в исследовании Н.В. Зароченцевой и соавт. 2017 года наблюдали 65 девочек и девушек в возрасте от 4 до 17 лет с АБ наружных половых органов и влагалища. В исследовании применяли ВИФЕРОН® в сочетании с радиоволновой хирургией и химической деструкцией раствором «Солковагин».
Препарат ВИФЕРОН® назначали в форме ректальных суппозиториев по 500000 МЕ два раза в сутки в течение 10 дней в сочетании с гелем ВИФЕРОН® для пораженных участков наружных половых органов два раза в сутки в течение минимум 30 дней. На фоне лечения полное исчезновение клинических проявлений АБ наблюдалось у 44,6% пациенток, при этом рецидивов АБ выявлено не было. Таким образом, сочетание данных подходов к терапии АБ продемонстрировало положительный клинический результат и отсутствие рецидивов заболевания [7].
В ряде исследований показан благоприятный исход беременности, родов и раннего неонатального периода у беременных с АБ. Им назначали комбинированную терапию, в составе которой был ИФН альфа-2b (ВИФЕРОН®) в виде геля и суппозиториев, начиная с 14 недели беременности, с повторными курсами на 22–24 и 32–34 неделях. Исследователи отмечали статистически значимое улучшение состояния местного иммунитета у беременных с АБ, ассоциированными с ВПЧ высокоонкогенного риска, у которых содержание sIgA повышалось в 4 раза, а уровень ФНО-α снижался в 3 раза [12].
Таким образом, на фоне терапии ИФН альфа-2b уменьшилось количество гестационных осложнений с 32% до 15% (внутриутробное инфицирование, фетоплацентарная недостаточность, гнойно-септические осложнения). Полученные данные свидетельствуют о высоком терапевтическом и иммуномодулирующем эффектах препарата ВИФЕРОН® у беременных с ПВИ, особенно при использовании комбинированной схемы. У пациенток статистически значимо улучшался локальный иммунитет, что способствовало снижению выраженности клинических проявлений ПВИ [42].
ЗАКЛЮЧЕНИЕ
АБ продолжают занимать лидирующую позицию среди ВПЧ-ассоциированных заболеваний. Несмотря на доброкачественное течение, данная патология требует комплексного персонифицированного подхода и онконастороженности со стороны клинициста, особенно при длительно протекающем и рецидивирующем процессах. Среди основных методов лечения АБ иммуномодулирующая терапия занимает лидирующую позицию, статистически значимо снижая персистенцию и риски развития рецидивов заболевания.
Многочисленные исследования доказали высокую клиническую эффективность и безопасность отечественного препарата ВИФЕРОН® в форме ректальных суппозиториев и геля для наружного и местного применения, который активно используют в различных областях медицины, в том числе в акушерстве и гинекологии. В настоящее время консервативная тактика в сочетании с другими хирургическими и нехирургическими методами является основополагающей для лечения пациентов с АБ.
Поступила: 05.08.2021
Принята к публикации: 20.08.2021
________
1 Клинические рекомендации «Аногенитальные (венерические) бородавки». 2020. Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов. Российская ассоциация колопроктологов.URL: https://cr.minzdrav.gov.ru/schema/204_1
2 Там же.
3 Там же.
4 Там же.
5 Там же.
6 Там же.
7 Sexually Transmitted Disease Treatment Guidelines. Division of STD Prevention, National Center for HIV/AIDS, Viral Hepatitis, STD, and TB Prevention, Centers for Disease Control and Prevention. 2019. URL: https://www.cdc.gov/nchhstp/default.htm
8 Клинические рекомендации «Аногенитальные (венерические) бородавки». 2020.URL: https://cr.minzdrav.gov.ru/schema/204_1
9 Там же
10 Sexually Transmitted Disease Treatment Guidelines. 2019. URL: https://www.cdc.gov/nchhstp/default.htm
11 Там же.
12 Клинические рекомендации «Аногенитальные (венерические) бородавки». 2020.URL: https://cr.minzdrav.gov.ru/schema/204_1
13 Там же.







