ВВЕДЕНИЕ
Миома матки является наиболее часто встречающимся доброкачественным новообразованием женской репродуктивной системы. Примерно 50% женщин репродуктивного возраста сталкиваются с данным заболеванием, а в перименопаузальный период этот показатель увеличивается до 70–80%. Кроме того, в последнее время случаи диагностики миомы матки у молодых пациенток до 30 лет значительно участились. Данное заболевание может серьезно осложнить наступление и течение беременности, поэтому ранняя диагностика и лечение миомы матки является крайне актуальной проблемой, особенно для пациенток репродуктивного возраста1 [1].
Молекулярные механизмы, запускающие рост и развитие лейомиом, в последние годы изучают крайне интенсивно [2-4]. Уже определен ряд ключевых генов, мутации в которых отвечают за превращение клеток миоцитов (или их предшественников) в бесконтрольно делящиеся клетки, формирующие миоматозный узел. Известно, что каждый такой узел имеет моноклональное происхождение, а на скорость его роста влияют соматические мутации, произошедшие в клетке-прародительнице опухоли [5]. Поиск генетических маркеров, связанных с наследственными факторами развития миомы матки для преклинической диагностики и прогнозирования рисков развития и рецидивирования данного заболевания, является одной из самых актуальных задач как в научном, так и в прикладном аспекте, и находится на стыке гинекологии и молекулярной генетики.
В настоящее время опубликовано довольно много работ, посвященных выявлению наследственных факторов, участвующих в патогенезе миомы матки. Большая часть работ проведена методом GWAS (genome-wide association studies — поиск ассоциаций путем полногеномного секвенирования), и полученные результаты позволили выявить целый ряд локусов, определенные генотипы которых коррелируют с наличием миомы матки у женщин [6, 7]. Основной проблемой таких исследований является тот факт, что при формировании новой выборки и при проверке ранее полученной корреляции конкретного генотипа с наличием заболевания результаты очень часто не подтверждаются, или статистическая значимость полученных корреляций сильно падает.
Целью нашего исследования было создание и тестирование методики генотипирования на основе ПЦР в реальном времени (real-time PCR). Данный метод может позволить быстро и недорого анализировать большие выборки образцов и проверять корреляцию между вариантами однонуклеотидных полиморфизмов и миомой матки у пациенток. В дальнейшем планируется создание панели генетических маркеров с высокой корреляцией для раннего тестирования и оценки вероятности развития заболевания еще до появления миом в репродуктивном возрасте.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Пациенток набирали в гинекологическом отделении ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Молекулярно-генетические исследования выполняли в лаборатории молекулярно-генетических методов Института репродуктивной генетики ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Все пациентки, включенные в исследование, подписали информированное согласие в 2-х экземплярах. Исследование одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Участниц распределяли в подгруппы, данные по которым собирали отдельно, с учетом семейного анамнеза по миоме матки. Кроме того, в каждой подгруппе были выделены подгруппы пациенток с рецидивом миомы матки. В контрольную группу вошли пациентки ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в постменопаузальном возрасте, чей анамнез не включал миому матки в настоящем или прошлом, и, согласно специально составленному опроснику, у близких родственниц также никогда не диагностировалась миома.
В качестве материала для исследований использовали венозную кровь, собранную по стандартной методике в вакутейнеры. ДНК из крови пациенток выделяли с помощью набора ExtractDNA Blood (Евроген, Россия). Все образцы были амплифицированы со специфичными для rs3020434, rs11742635, и rs12637801 парами праймеров (стандартный протокол ПЦР). Нуклеотидную последовательность ампликонов определяли с помощью секвенирования по методу Сэнгера на приборе ABI PRISM 3130 Genetic Analyzer (Applied Biosystems, США). Последовательности ампликонов сопоставляли с соответствующими референсными последовательностями по каждому rs.
ПЦР в реальном времени проводили двумя методами:
1. ПЦР-типирование полиморфизмов с применением олигонуклеотидных зондов.
2. анализ кривых плавления с высоким разрешением (HRM-анализ, High Resolution Melting curve analysis).
Первая технология ПЦР-типирования полиморфизмов с применением олигонуклеотидных зондов предполагает наличие в смеси для амплификации зондов, строго соответствующих последовательности аллельных вариантов гена и меченных разными флуорофорами, а также зонда с гасителем флуоресценции. После амплификации целевого фрагмента гена температура реакционной смеси понижается, зонды с источником и гасителем флуоресценции гибридизуются в непосредственной близости на ДНК-матрице. Генотипирование осуществляется при температурной денатурации дуплексов зондов и фрагментов ДНК путем измерения флуоресценции в режиме «реального времени» [7]. С помощью программного обеспечения (ПО) эти данные преобразуются в график формата dF/dT (дифференциальная оценка скорости изменения флуоресценции), известный как кривая плавления.
Второй метод, HRM, основан на использовании интеркалирующих флюоресцентных красителей ДНК и анализе данных плавления с применением специальных алгоритмов. Как в предыдущем методе, генотипирование осуществляется по профилю кривой плавления, регистрируемой путем измерения флуоресценции ДНК-интеркалятора в ходе температурной денатурации двуцепочечных ПЦР-продуктов [8]. В отличие от ПЦР с олигонуклеотидными зондами метод позволяет регистрировать накопление продуктов амплификации (важно при учете влияния качества анализируемого препарата ДНК на результат генотипирования), предполагает сравнительно простой дизайн олигонуклеотидов (для ПЦР требуется только пара специфичных праймеров), характеризуется более высокой чувствительностью.
Учет и анализ результатов ПЦР проводили с помощью ПО RealTime PCR для детектирующих амплификаторов серии ДТ (ООО «НПО ДНК-Технология», Россия, Протвино). Анализ кривых плавления с высоким разрешением выполнен с помощью специального модуля HRM-анализа, интегрированного в RealTime PCR. В качестве флуоресцентного интеркалирующего красителя использовали EvaGreen (Biotium). Праймеры, фланкирующие rs3020434, для проведения HRM-анализа были подобраны с учетом отсутствия в их составе вторичных структур и повторов.
РЕЗУЛЬТАТЫ
Всего по трем полиморфизмам, rs3020434, rs11742635 и rs12637801 (локализованным в генах ESR1, FBN2 и KCNMB2 соответственно), было проанализировано 344 образца:
• исследуемая группа — 294 пациентки с миомой матки, из них 98 женщин были с отягощенным анамнезом по миоме матки (лейомиома у родственниц первой линии родства);
• группа контроля — 50 пациенток в менопаузе без миомы матки и без данной патологии в семейном анамнезе.
Для каждого полиморфизма прямым секвенированием с двух праймеров были определены аллели, присутствовавшие в каждом образце ДНК, а также был проведен анализ частот генотипов среди общей выборки женщин (общая популяция), в группе контроля, в группе пациенток с миомой матки и отдельно в подгруппе пациенток с отягощенным анамнезом (табл.).
Таблица
Частоты генотипов в исследованных группах и статистическая значимость различий между ними
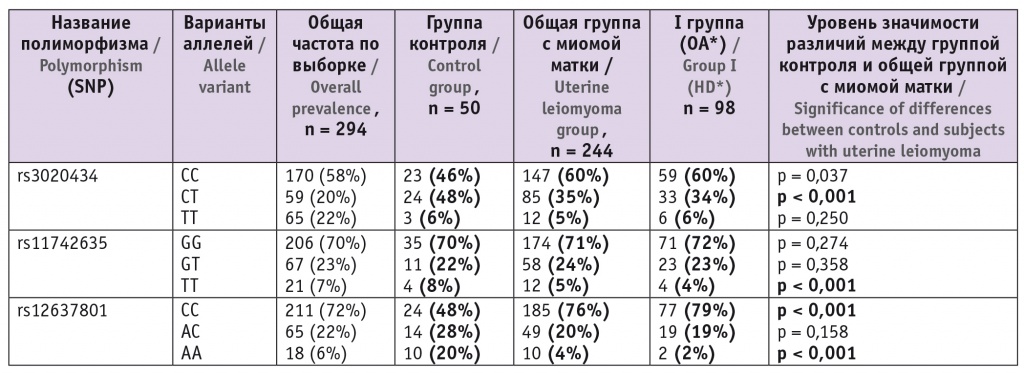
* ― Пациентки с отягощенным анамнезом (группа ОА).
Как видно из таблицы, в группе контроля мы обнаружили значимые отличия в частотах генотипов по всем трем исследованным полиморфизмам. Генотипы, содержащие минорные аллели, у женщин без миомы матки (то есть в группе контроля) встречаются чаще — как в виде гомозигот, так и в составе гетерозигот.
Выявленные соотношения генотипов можно рассматривать как вероятное следствие «протективности» этих вариантов в отношении миомы матки. То есть наличие такого минорного аллеля у женщин без миомы матки (и без случаев миомы матки в семье) позволяет нам высказать гипотезу, что этот генотип коррелирует с более низкой вероятностью развития данного заболевания.
Для проверки данной гипотезы требуется анализ более обширных выборок, однако секвенирование по Сэнгеру является довольно дорогим и трудозатратным методом. Чтобы найти альтернативный метод генотипирования образцов по полиморфизмам rs3020434, rs11742635, rs12637801, было решено использовать метод ПЦР в режиме реального времени.
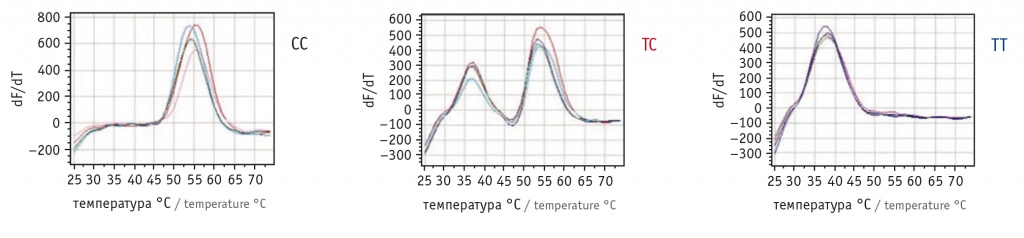
Для первого этапа были синтезированы зонды для ПЦР в реальном времени, специфичные для аллелей «С» и «Т» rs3020434, при этом один зонд был помечен флуорофором FAM, а другой — флуорофором HEX. При ПЦР в реальном времени со стандартными праймерами и с добавлением зондов генотип «ТТ» давал более низкий пик плавления, генотип «СС» — более высокий пик плавления, а гетерозиготный генотип «СТ» — два пика, соответствовавших каждому аллелю (рис. 1).
Рис. 1. Результаты генотипирования образцов по rs3020434. Гомозиготные генотипы имеют один пик плавления, гетерозиготные ― два
На втором этапе был отработан метод генотипирования по трем полиморфизмам на основе анализа кривых плавления с высоким разрешением (HRM). Генотипирование осуществлялось по профилю кривой плавления за счет измерения интенсивности флуоресценции ДНК-интеркалятора в ходе температурной денатурации двуцепочечных ПЦР-продуктов, полученных с уникальных пар праймеров, специфичных для каждого полиморфизма.
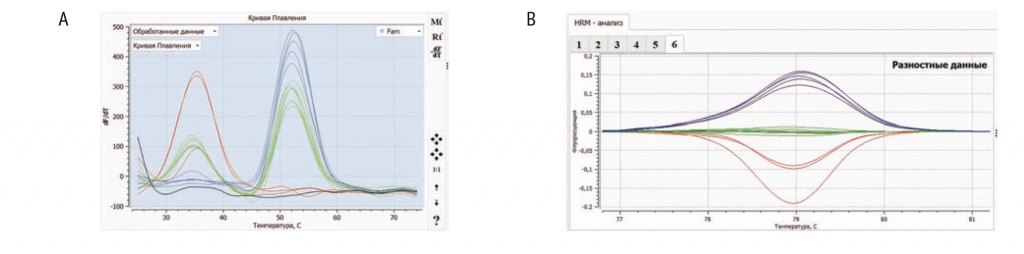
На рисунке 2 представлен анализ одной и той же выборки образцов обоими методами. Практически по всем исследованным образцам были получены идентичные результаты генотипирования, соответствовавшие генотипам, ранее определенным с помощью прямого секвенирования по Сэнгеру. В единичных случаях образцы были отбракованы алгоритмом вследствие недостаточного уровня амплификации ДНК. Оба метода продемонстрировали высокую специфичность в определении принадлежности образцов к одному из трех возможных генотипов (на рисунке 2 они выделены разными цветами).
Рис. 2. Сопоставление методов ПЦР-типирования полиморфизмов с применением олигонуклеотидных зондов (A) и высокоразрешающего плавления (HRM) (B).
A. Кривые плавления. Гомозиготные генотипы «ТТ» обозначены красным цветом, гетерозиготные «СТ» ― зеленым, гомозиготные «СС» ― синим.
B. Кривые плавления HRM. Гомозиготные генотипы «ТТ» обозначены красным цветом, гетерозиготные «СТ» ― зеленым, гомозиготные «СС» ― синим
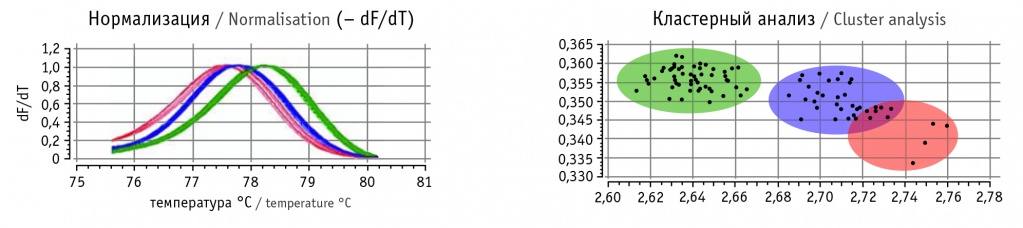
На рисунке 3 показан результат постановки 96 образцов за один прогон прибора, как это реализовано в программном обеспечении: каждый генотип обозначен своим цветом как в таблице с образцами, так и на графике плавления. Таким образом, на выходе за одну постановку мы можем получить результаты по 96 генотипированным образцам за 3 часа рабочего времени, включающего в себя этап поставки реакции ПЦР и работы прибора, тогда как секвенирование по Сэнгеру состоит из нескольких этапов (постановки сиквенс-ПЦР, очистки полученных ампликонов, внесения образцов в плашку для сиквенсного анализа, работы секвенатора и последующего анализа полученных нуклеотидных последовательностей отдельно по каждому образцу).
Рис. 3. Генотипирование 96 образцов. Гомозигота редкого аллеля обозначена красным цветом, гетерозигота ― синим, гомозигота частого аллеля ― зеленым
ЗАКЛЮЧЕНИЕ
Метод ПЦР в реальном времени может быть использован для быстрого и эффективного анализа однонуклеотидных полиморфизмов, связанных с развитием миомы матки. При этом оба метода (ПЦР-типирование с применением олигонуклеотидных зондов и анализ кривых плавления с высоким разрешением), протестированные в данной работе, позволяют получать однозначные результаты для 97–99% образцов.
Полученные данные о частотах генотипов однонуклеотидных полиморфизмов позволяют оценить риск развития и рецидивирования миомы матки у женщин репродуктивного возраста. При анализе достаточно больших выборок возможно определить ряд «маркерных полиморфизмов» для данного заболевания и создать панель таких генетических признаков, что в будущем позволит оценивать вероятность предрасположенности к миоме матки у женщин до появления заболевания.
Благодарность: авторы выражают огромную благодарность всем сотрудникам гинекологического отделения ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России за помощь в сборе материала, а также сотрудникам Биобанка этого учреждения за создание коллекции образцов тканей.
Поступил: 17.08.2021
Принята к публикаци: 30.08.2021
________
1 Адамян Л.В, Андреева Е.Н., Артымук Н.В. и др.; Адамян Л., ред. Миома матки: диагностика, лечение, реабилитация. Клинические рекомендации по ведению больных. М.; 2015. URL: https://docs.cntd.ru/document/456019539







