Чаще всего (75–80%) прерывание беременности происходит в I триместре. В основе невынашивания беременности в этих случаях могут лежать как генетические отклонения в эмбрионе, так и многоплодие, хронические инфекции, анатомические особенности матки, гормональные нарушения и т. д.
По данным литературы, в популяции до 50–60% ранних выкидышей связаны с хромосомными аномалиями. Многие авторы утверждают, что спонтанные аборты до 12 недель беременности являются хорошим индикатором генетических нарушений в эмбрионе [4–8]. Несмотря на то что к настоящему времени проведена серия масштабных цитогенетических исследований клеток спонтанных абортусов, существует ряд данных, противоречащих друг другу, касающихся частоты и спектра хромосомных нарушений у эмбрионов при неразвивающейся беременности.
Молекулярные методы исследования хромосомной патологии в различных тканях находят все более широкое применение в диагностике [5]. Это связано с тем, что при их использовании нет необходимости культивировать клетки. Классическим цитогенетическим методом не всегда удается получить результат. Зачастую это связано с низкой пролиферацией или ее отсутствием в исследуемых клетках.
Цель исследования: определить частоту и структуру хромосомных нарушений методом высококопроизводительного секвенирования (nextgeneration sequencing — NGS) в клетках хориона при неразвивающейся беременности.
Материалы и методы
Контрольным материалом служили клетки хориона с известной патологией (была проведена предварительная пренатальная диагностика), полученные хирургическим путем в ходе прерывания беременности по желанию пациентки. Во всех случаях результаты цитогенетического исследования совпали с результатами секвенирования. Образцы, полученные от женщин с неразвивающейся беременностью, доставляли в лабораторию в изотоническом физиологическом растворе при температуре +4 °С.
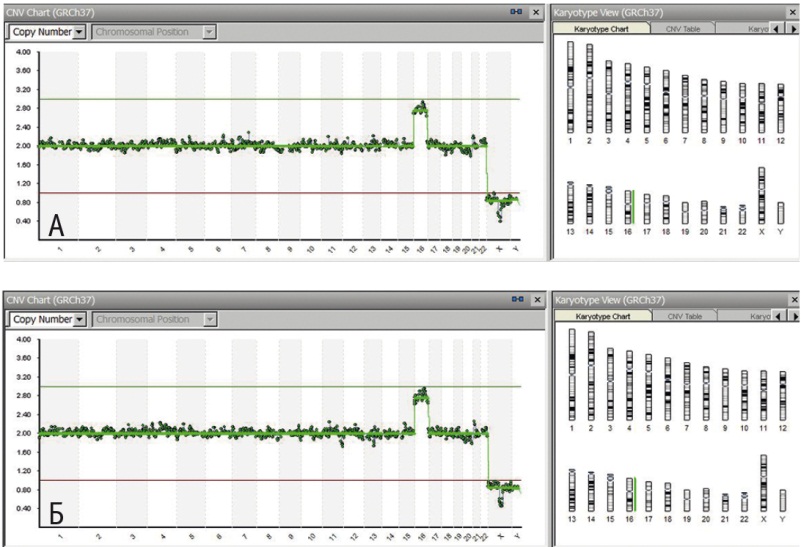
Материалом для исследования служила ДНК, выделенная из клеток хориона или мышцы плода. Всего были исследованы 197 образцов хориона и 2 образца ткани мышцы плода, полученные от женщин в возрасте от 18 до 45 лет (средний возраст — 34,3 года). Пять образцов проанализировали дополнительно из высушенного хориона на специализированных картах для сбора биологических образцов производства компании «АлкорБио», г. СанктПетербург (карта представлена на рисунке 1, результаты — на рисунке 2). Средний срок прерывания беременности составил 8,5 ± 2,1 недели (от 5 до 16 недель).
Рис. 1. Расположение хориона на специализированной карте для хранения биологического материала. Здесь и далее в статье фото авторов

Рис. 2. Результат исследования клеток неразвивающегося хориона, взятого из физического раствора (А) и высушенного на специализированной карте (Б). Выявлена трисомия 16 хромосомы
ДНК из клеток получали стандартным методом выделения ДНК наборами компании Promega (США). Секвенирование проводили согласно технологии Illumina на приборе Miseq. Полученные данные обрабатывали с помощью программного обеспечения BlueFluse Multi.
Результаты
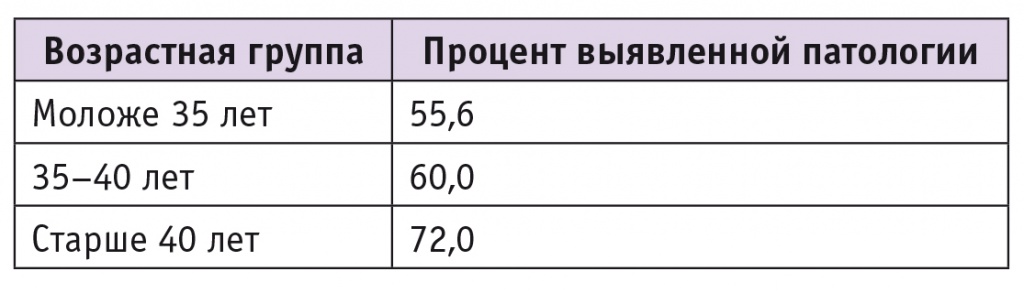
Хромосомная патология была обнаружена в 122 (61,3%) образцах из 199. Частота встречаемости патологии у женщин разного возраста приведена в таблице.
Таблица
Частота хромосомной патологии в клетках хориона и мышцы плода у женщин различных возрастных групп
Анеуплоидия по одной хромосоме была обнаружена в 100 (82,0%) наблюдениях, патология с вовлечением двух хромосом — в 7 (5,7%), триплоидный набор — в 9 (7,4%), сочетание анеуплоидии с мозаицизмом — в 6 (4,9%).
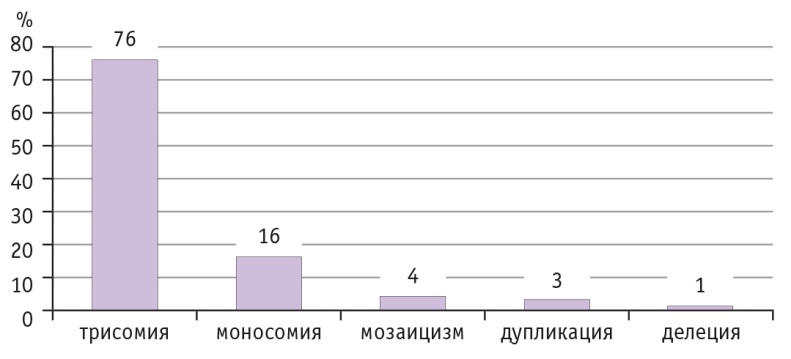
По частоте встречаемости трисомия хромосом заняла лидирующее место — 76%. Моносомии в основном были представлены отсутствием одной из половых хромосом (15 наблюдений). Только в одном наблюдении моносомия была представлена 21 хромосомой (рис. 3).
Рис. 3. Структура хромосомной патологии, выявленной методом высокопроизводительного секвенирования
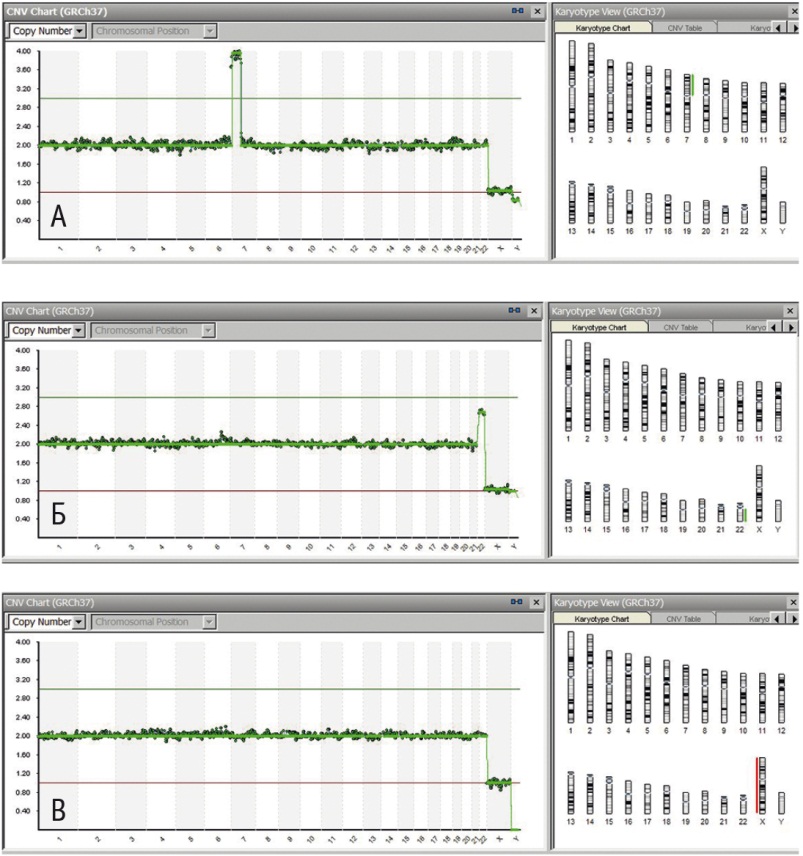
Дупликации/делеции (рис. 4) и мозаицизм были выявлены в одинаковом количестве — 4%. Наиболее часто патологические изменения наблюдались по 16, 22 хромосомам и одной из половых хромосом (20%, 12,9% и 17,1%, соответственно).
Рис. 4. Результаты исследования клеток неразвивающегося хориона. Выявлены четыре копии короткого плеча 4 хромосомы (А), трисомия 22 хромосомы (Б), отсутствие генетического материала, соответствующего одной из половых хромосом (В)
Обсуждение
Результаты проведенного исследования показали, что хромосомные нарушения плода обнаружены у 72,0% женщин старше 40 лет. Высокий процент генетической патологии у этой категории пациенток отмечен и другими авторами [4, 5]. Сравнение кариотипа у абортусов женщин различных возрастных групп показало увеличение частоты хромосомной патологии в зависимости от возраста женщин. Т. В. Золотухина и соавт. (2003) также отметили данную зависимость [9].
Согласно результатам анализа, у пациенток 20–30 лет преобладали абортусы с нормальным кариотипом, 31–40 лет — плоды с хромосомными аберрациями, у женщин старше 40 лет все плоды имели аномальный кариотип.
В другом исследовании сделано заключение, что у 82% пациенток старше 40 лет потеря беременности может быть связана с изменениями в кариотипе эмбриона [3].
Небольшое количество выявленных моносомий указывает на то, что эмбрионы с такой патологией имеют низкий потенциал развития. В структуре моносомий отсутствие одной из половых хромосом занимает почти 100%.
Анеуплоидии в клетках хориона одновременно по двум хромосомам, делеции/дупликации встречались достаточно редко, это тоже свидетельствует, что данная патология может оказывать негативное влияние на потенциал развития эмбриона.
Полученные данные показывают, что необходимо обращать внимание на возраст пациенток при планировании беременности, как при естественном зачатии, так и при проведении программы ВРТ. Женщинам с бесплодием старше 35 лет следует предлагать проведение программы ЭКО с предимплантационным скринингом эмбрионов на анеуплоидии. Перенос одного здорового эмбриона не только позволит родить ребенка без патологии, но и предупредить прерывание беременности больным плодом, которое может негативно сказаться на физическом и психическом здоровье женщины.
Идентичные профили при исследовании свежего и высушенного на карте материала, полученные нами однозначные данные говорят о том, что клетки высушенного хориона на карте для хранения биологического материала не влияют на результат анализа и карты возможно использовать для хранения материала в тех случаях, когда невозможна его транспортировка в ближайшее время.
Заключение
Исследование клеток неразвивающегося хориона вносит большой вклад в понимание процесса мейоза и, что немаловажно, может способствовать разработке профилактических мероприятий по предотвращению невынашивания беременности как при естественном зачатии, так и в рамках программы ВРТ.
На основании полученных результатов можно сделать заключение, что высокопроизводительное секвенирование (nextgeneration sequencing) является высокоэффективным современным методом диагностики анеуплоидий и может быть предложено не только для исследования клеток неразвивающегося хориона, но и в качестве профилактического метода при проведении пренатальной диагностики.








