ВВЕДЕНИЕ
В последние годы ряд профессиональных сообществ (American College of Medical Genetics (ACMG), American College of Obstetricians and Gynecologists (ACOG) и др.) опубликовали свои рекомендации по использованию неинвазивного пренатального скрининга (НИПС) с целью детекции основных хромосомных анеуплоидий (ХА) у плода. Подобные рекомендации в 2016 году были разработаны и в России под руководством Сухих Г.Т., Трофимова Д.Ю., Баркова И.Ю. и соавт., они одобрены Российским обществом акушеров-гинекологов [1]. Ряд исследований демонстрирует высокую чувствительность и специфичность НИПС в отношении основных трисомий у плода (трисомии 13, 18 и 21 хромосом) и его бо́льшую эффективность по сравнению со стандартным комбинированным скринингом I триместра [1-4].
Свободная, или внеклеточная, эмбриональная ДНК (сэ-ДНК), на выделении которой основана методика НИПС, появляется в крови матери уже с 4 недель беременности, надежно определяется с 7–8 недель, а в 9–10 недель ее уровень достаточен для точной детекции ХА у плода. При этом, согласно литературным данным, в 3–6% случаев не удается получить результат при первичном исследовании, так как уровень фетальной фракции сэ-ДНК, определяемой при помощи НИПС, оказывается слишком низким (ниже 4–5%) либо выделенная сэ-ДНК не соответствует критериям качества [5].
Международные эксперты не пришли к единому мнению, какой тактики следует придерживаться и какие рекомендации следует давать пациенткам при низкой фетальной фракции. В рекомендациях ACOG сказано, что в этом случае возможно рекомендовать повторное исследование, однако при повторном анализе удается получить результат лишь в 50–60% случаев, а низкая доля плодовой ДНК может свидетельствовать о наличии анеуплоидий [5]. Но нужно учитывать, что при повторном заборе материала увеличивается время до получения результата, а это может быть принципиально важным, особенно во II триместре беременности при решении вопроса о целесообразности ее вынашивания [1].
ACMG советует при определении низкой фетальной фракции рекомендовать экспертное УЗИ и решать вопрос о направлении пациентки на диагностическое тестирование (инвазивную диагностику) [6-8].
Отечественные рекомендации не дают однозначного ответа на вопрос, стоит ли предлагать пациентке в этом случае провести НИПС повторно. В них указывается: «…практика показывает, что повторный забор крови на более поздних сроках позволяет получить результат только в 50–60% случаев». Причем приводится ссылка на иностранные источники — данные о количестве повторных результативных исследований именно в российской популяции не представлены. Далее подчеркивается, что «…тактика дальнейшего обследования пациентки в этом случае должна быть согласована с врачом-генетиком и врачом акушером-гинекологом для принятия решения о проведении инвазивной пренатальной диагностики, так как низкая доля внеклеточной плодовой ДНК может быть связана с повышенным риском анеуплоидий» [1].
Здесь стоит отметить, что многие женщины решают пройти НИПС именно из-за нежелания подвергаться инвазивной диагностике. Не имея четкой уверенности в том, что риск ХА у плода достаточно высок или по крайней мере выше, чем риск осложнений самой процедуры инвазивной диагностики, эти пациентки с высокой долей вероятности вообще откажутся от дальнейшего исследования [9].
Кроме того, данные о частоте ХА у плода при выявлении низкой фетальной фракции противоречивы. В одних статьях утверждается, что при синдроме Дауна у плода уровень фетальной фракции такой же, как при эуплоидном хромосомном наборе [10-12]. В других исследованиях, напротив, продемонстрировано, что в значительной части случаев низкий уровень фетальной ДНК ассоциирован с ХА у плода [6, 13, 14].
Известно, что низкое содержание сэ-ДНК чаще наблюдается у женщин с избыточной массой тела и ожирением [9, 10, 15]. По данным ACOG, если масса тела пациентки выше 250 фунтов (113 кг), то в 10% случаев тест будет нерезультативным по причине низкой фетальной фракции. По рекомендациям ACMG, пациенткам с ожирением вместо НИПС следует предлагать другие варианты пренатальной диагностики [9]. Согласно российским рекомендациям, применение НИПС ограничено у женщин с ИМТ более 30 кг/м2 [1].
На уровень фетальной фракции, помимо массы тела беременной женщины, могут влиять и другие факторы. Например, есть исследования, в которых установлено, что уровень фетальной фракции ниже при применении низкомолекулярных гепаринов (хотя можно предположить, что низкий уровень фетальной фракции связан не с самими низкомолекулярными гепаринами, а с теми показаниями, в связи с которыми они были назначены) [16-18]. Ряд исследователей отметили, что более низкое содержание фетальной фракции имеет место у женщин монголоидной расы [19].
Кроме того, уровень фетальной фракции ниже, если беременность наступила в результате ЭКО. Предполагается, что какой-то неопределенный элемент данного процесса влияет на показатель фетальной ДНК. Эту особенность необходимо учитывать при интерпретации результата исследования, так как более низкое содержание фетальной фракции ассоциировано с уменьшением положительной и отрицательной предсказательной ценности метода [19].
Изучалась также ассоциация уровня фетальной ДНК с возрастом матери и толщиной воротникового пространства, однако связь с этими показателями не установлена [20].
Цель исследования: провести сравнение частоты выявления ХА у плодов при первичном и повторном выполнении НИПС в связи с низким уровнем фетальной фракции или низким качеством сэ-ДНК.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено ретроспективное когортное исследование. Работа выполнялась на базе медицинского центра «Геномед» и кафедры акушерства и гинекологии факультета повышения квалификации и профессиональной переподготовки специалистов Уральского государственного медицинского университета. В исследование включены 21 042 женщины, прошедшие НИПС в России в 2013–2018 гг., из них отобраны пациентки, у которых результат теста не был получен с первого раза из-за низкой фетальной фракции или низкого качества сэ-ДНК. НИПС оказался нерезультативным у 1044 (5%) женщин, на повторную сдачу анализа согласились 1025 пациенток — они составили основную группу (группа 1). В зависимости от того, удалось ли получить результат при повторном исследовании или с третьего раза, из основной группы были выделены подгруппы 1а и 1б.
В контрольную группу (группа 2) вошли 19 998 пациенток с результативным НИПС при первичном исследовании. Женщины с низким уровнем фетальной фракции, отказавшиеся от повторных анализов, были исключены из исследования.
Положительные результаты НИПС во всех случаях подтверждены с помощью кариотипирования биологического материала, полученного в результате инвазивных процедур или клинически и цитогенетически после рождения ребенка.
Все участницы нашего исследования проживали на территории России.
Мы использовали таргетный НИПС. Проводился забор крови из вены, далее — центрифугирование крови для получения плазмы. Внеклеточная фетальная ДНК выделялась с помощью метода секвенирования однонуклеотидных полиморфизмов (SNP) и запатентованного алгоритма компании Natera (США). Уровень сэ-ДНК измерялся в процентах от уровня общей внеклеточной ДНК.
Статистическая обработка полученных результатов проводилась на персональном компьютере с использованием пакета электронных таблиц Microsoft Exсel 7.0 и программы Jamovi. Соответствие распределения совокупности количественных признаков закону нормального распределения проверяли с использованием критерия Шапиро — Уилкса. Для оценки уровня фетальной фракции были рассчитаны медиана (Ме) и интерквартильный размах (Q1; Q3). Степень значимости выявленных различий оценивалась в соответствии с непараметрическим критерием Краскела — Уоллиса и критерием χ2. Статистически значимыми различия между исследуемыми группами считали при р < 0,05.
РЕЗУЛЬТАТЫ
Из 1025 пациенток основной группы у 821 (80,1%) удалось со второго раза получить результат (они составили подгруппу 1а), и у 794 (96,7%) из них был определен низкий риск ХА у плода. У 204 (19,9%) из 1025 участниц НИПС вновь оказался нерезультативным. На повторное выполнение анализа согласились 109 пациенток из этой группы: при повторном исследовании результат получен у 75 из них (68,8%) — они составили подгруппу 1б; у 34 (31,2%) результат вновь не был получен.
Среди участниц, получивших результат при первичном исследовании, распространенность ХА плода составила 2,4% (489 случая из 19 998). В основной группе итоговая частота ХА — 3,3% (34 пациентки из 1025) (χ2 = 3,08, р = 0,081). Различия между группами статистически незначимы, но ряд пациенток из группы 1 отказался от дальнейшего исследования, и мы не знаем их результаты — вероятно, среди них также были те, кто имел ХА у плода.
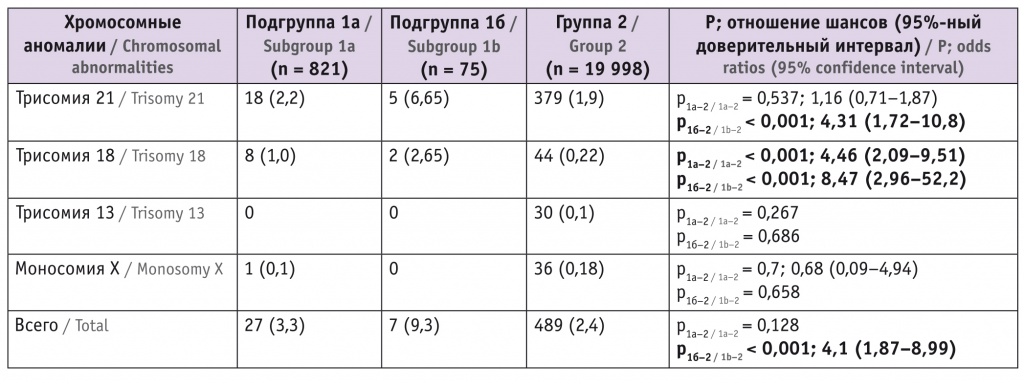
Различия по частоте встречаемости ХА между контрольной группой и подгруппой 1а, где ХА выявлены у 3,3% (27 из 821) пациенток среди тех, кто согласился на повторное исследование, также несущественны (χ2 = 2,32, р = 0,128).
В подгруппе 1б ХА определили у 7 (9,3%), отличие от группы 2 статистически значимо (χ2 = 7,13, р = 0,008).
Структура выявленных ХА представлена в таблице 1.
Таблица 1
Частота встречаемости различных хромосомных аномалий в исследуемых группах, n (%)
Далее мы сравнили средний уровень фетальной фракции в разные сроки беременности в норме и при наличии ХА у плода. Результаты представлены на рисунке и в таблице 2.
Рис. Средний уровень фетальной фракции: А — в I триместре, Б — во II триместре беременности
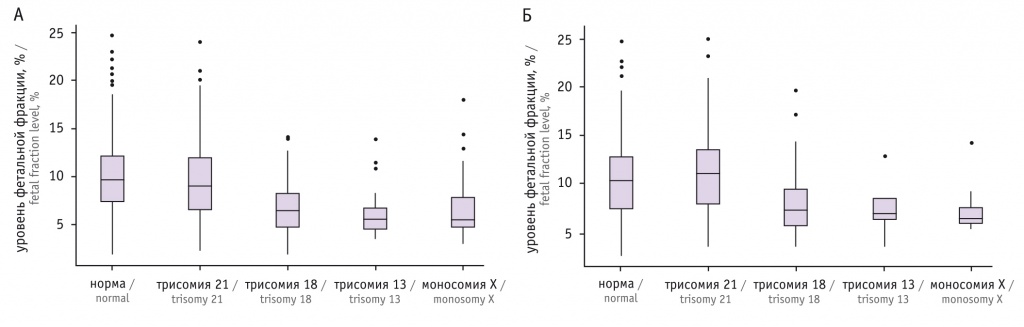
Таблица 2
Средний уровень фетальной фракции в разные сроки беременности, %, Ме (Q1; Q3)
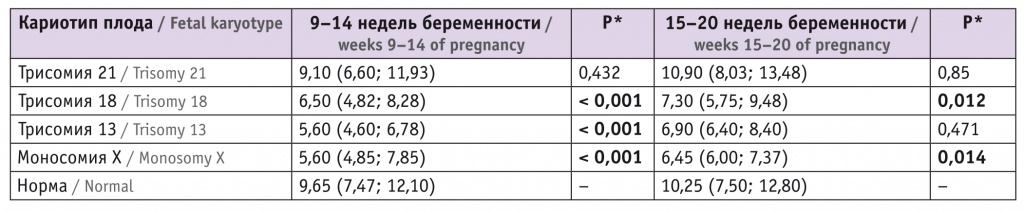
* Для отличия от случаев нормального кариотипа у плода.
В I триместре беременности средний уровень фетальной фракции при нормальном хромосомном наборе у плода статистически значимо выше, чем при наличии трисомии 18, 13 или моносомии Х. Однако между нормой и наличием трисомии 21 различия несущественны.
Во II триместре значимо более низкий уровень фетальной фракции по сравнению с нормой определялся при наличии трисомии 18 или моносомии Х. При трисомии 13 различия по доле фетальной фракции статистически незначимы (возможно, из-за небольшого размера выборки — пациенток, у которых выявлен высокий риск трисомии 13 у плода, в нашем исследовании было меньше всего).
Поскольку в научной литературе в качестве возможной причины низкого содержания фетальной фракции указывается избыточная масса тела пациентки, мы решили сравнить этот показатель у женщин с различной массой тела. Результаты представлены в таблице 3. Получены статистически значимые различия между уровнем фетальной фракции у пациенток с массой тела < 50 кг, 80–89 кг и более (р < 0,05).
Таблица 3
Средний уровень фетальной фракции у женщин с различной массой тела
![]()
* Отличия от показателя у женщин с массой тела < 50 кг статистически значимы (р < 0,05).
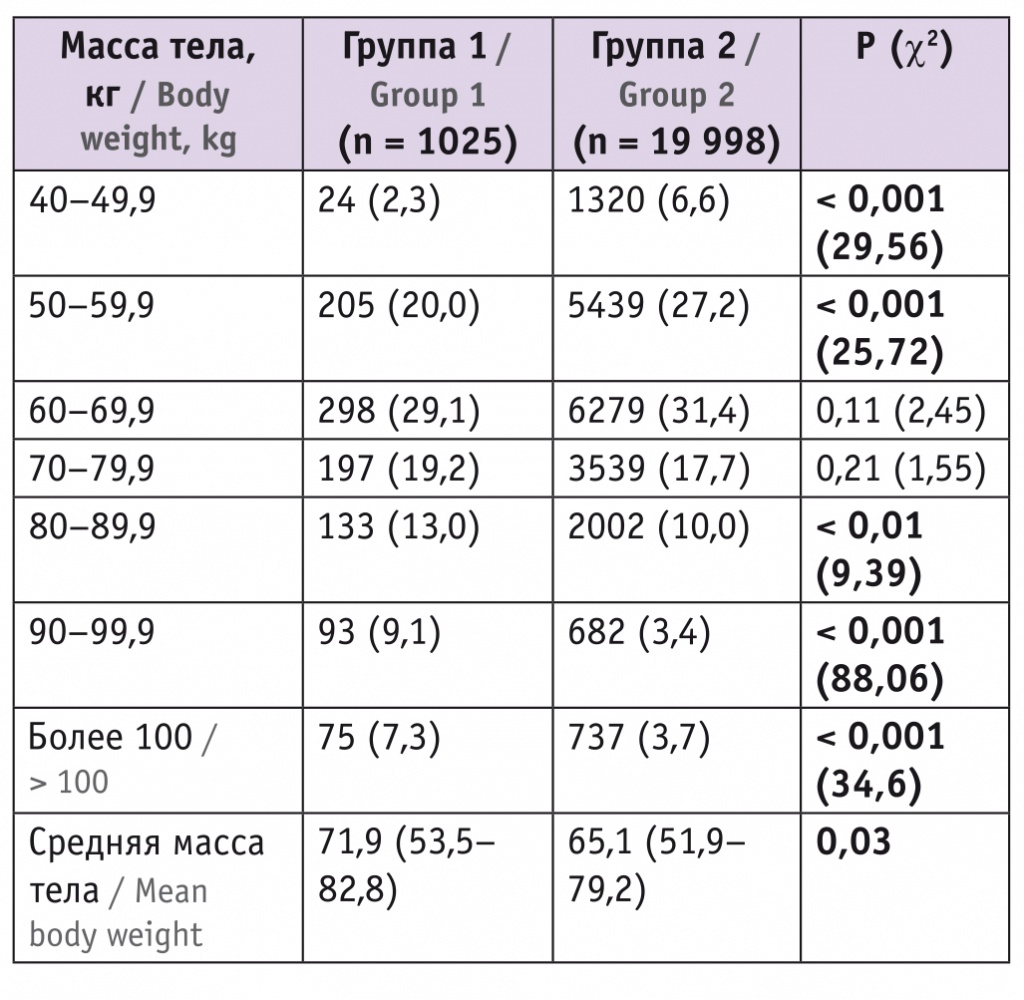
Очевидно, что с повышением массы тела пациентки снижается уровень фетальной фракции и, следовательно, возрастает вероятность нерезультативного теста при первичном исследовании (табл. 4). Средняя масса тела у женщин группы 1 была значимо выше (р = 0,03), при этом в группе 1 отмечалась бо́льшая доля пациенток с массой тела 80 кг и более, а в группе 2 — с массой тела до 60 кг, Количество участниц с массой 60–79,9 кг было примерно одинаково в обеих группах.
Таблица 4
Масса тела у пациенток исследуемых групп, n (%)
ОБСУЖДЕНИЕ
При проведении НИПС у некоторых пациенток (в нашем исследовании у 5%) не удается получить результат. Из наших результатов следует, что, если при первичном исследовании НИПС нерезультативен, общий риск ХА у плода повышается незначительно. Но если анализировать риск различных ХА по отдельности, уже при первом нерезультативном НИПС повышается риск синдрома Эдвардса (трисомии 18) у плода. Если же при повторном исследовании результат не получен, существенно увеличивается риск общий риск ХА и в особенности риск синдрома Дауна и синдрома Эдвардса.
Мы считаем, что, если при первом проведении НИПС у пациентки тест нерезультативен, ей следует предложить пройти НИПС повторно, так как относительный риск ХА у нее повышен незначительно. Вероятность того, что при повторном исследовании удастся получить искомый результат достаточно высока — 80,1%. Если же исследование снова является нерезультативным, нужно рекомендовать проведение инвазивной пренатальной диагностики.
В случае если после двух нерезультативных анализов пациентка настаивает на повторном проведении НИПС, она должна быть предупреждена о высокой вероятности того, что результат вновь не будет получен (31,2%) либо будет выявлен высокий риск ХА. Определение высокого риска ХА по результатам НИПС требует инвазивной пренатальной диагностики, а подтверждение аномального кариотипа у плода является медицинским показанием для прерывания беременности, поэтому при направлении пациентки на повторные неинвазивные исследования нужно обращать внимание на срок беременности.
Особенно важно это учитывать во II триместре, поскольку вопрос о наличии медицинских показаний со стороны плода для прерывания беременности необходимо решить до наступления срока жизнеспособности плода, то есть до 22 недель беременности (согласно Приказу Минздрава России № 736 от 3 декабря 2007 г. с изменениями, внесенными Приказом Минздравсоцразвития России от 27 декабря 2011 г. № 1661н, «Об утверждении перечня медицинских показаний для искусственного прерывания беременности»).
Средний уровень фетальной фракции в I триместре существенно ниже в случае наличия у плода трисомии 13 или 18 хромосомы, а также моносомии Х. Во II триместре статистически значимые различия по содержанию фетальной фракции отмечены только для трисомии 18 и моносомии Х. При этом в случае наличия у плода трисомии 21 уровень фетальной фракции не имеет существенных различий по сравнению с нормой.
Несмотря на нормальный уровень фетальной фракции, количество нерезультативных тестов при трисомии 21 несколько больше, чем при нормальном кариотипе у плода, так как в этом случае сэ-ДНК чаще не соответствует критериям качества, и лаборатория не выдает результат.
Пациентки, у которых масса тела больше 80 кг, имеют наиболее высокий риск отсутствия результата при проведении НИПС, даже при эуплоидном хромосомном наборе у плода, поскольку содержание фетальной фракции у них ниже. Однако мы не считаем, что пациенткам с избыточной массой тела не следует выполнять НИПС, так как вероятность получить искомый результат все же намного больше, чем не получить его. Но такие пациентки обязательно при дотестовом консультировании должны быть информированы о возможной необходимости проведения повторного исследования.
Мы полагаем, что этим женщинам следует использовать НИПС в качестве теста второй линии в сроке беременности 15–20 недель, когда уровень фетальной фракции несколько выше, чем в I триместре.
ЗАКЛЮЧЕНИЕ
При определении в ходе неинвазивного пренатального скрининга (НИПС) низкого уровня фетальной фракции или низкого качества внеклеточной эмбриональной ДНК в 80,1% случаев удается получить результат при повторном выполнении анализа. Если же и при повторном исследовании анализ вновь нерезультативен, вероятность успеха при последующем исследовании биоматериала составляет лишь 68,8%.
Отсутствие результата при проведении НИПС по причине низкого содержания фетальной фракции ассоциировано с повышенным риском хромосомных анеуплоидий, в особенности синдрома Эдвардса, у плода.
В случае неинформативного НИПС допустимо однократно предложить пациентке повторно выполнить анализ, если же и при повторном анализе уровень фетальной фракции низкий, необходимо решать вопрос о проведении инвазивной пренатальной диагностики.
Вероятность нерезультативного НИПС находится в прямой зависимости от массы тела женщины, она существенно повышается при массе тела больше 80 кг. Пациенткам с избыточной массой тела и ожирением следует рекомендовать другие методы пренатальной диагностики.
Поступила: 19.06.2020
Принята к публикации: 16.08.2020







