В последнее десятилетие отмечается рост распространенности обструктивных заболеваний почек, этиопатогенез которых непосредственно связан с патологией антенатального развития[1]. Качество диагностики врожденных уропатий постоянно повышается, и ежегодно такие патологии обнаруживают все чаще. Регистрируемая частота составляет приблизительно 1 : 250–1 : 1000 беременностей. При этом среди всех аномалий мочевыделительной системы доля различных вариантов обструктивных уропатий — от 40 до 87%[2].
По данным отечественных авторов, распространенность врожденных пороков развития мочевыделительной системы, в том числе проявляющихся обструкцией мочевыводящих путей, в структуре причин хронической почечной недостаточности у детей достигает 65%, т. е. они занимают лидирующую позицию среди пренатально диагностируемых патологий[3]. Около 1% новорожденных имеют пренатально диагностированный гидронефроз или значительную дилатацию почечных лоханок[4].
Рутинное использование пренатального ультразвукового исследования позволяет относительно рано и своевременно выявлять врожденные пороки антенатального развития.
Обструкция может возникать на любом участке на протяжении всего развития мочевыводящих путей, проявляться на ранних или поздних сроках беременности и быть частичной или полной. К тому же обструктивный процесс может быть как односторонним, так и двусторонним. В зависимости от уровня поражения выделяют обструкцию нижнего отдела мочевыделительной системы, которая включает атрезию уретры или клапан задней уретры, и верхнего отдела[5].
Не следует забывать, что, как и любой порок развития, патология мочевой системы у плода может сочетаться с хромосомными аномалиями. Поэтому важно проводить генетическое исследование для исключения как часто встречающихся в популяции анеуплоидий, так и синдромов Меккеля — Грубера, Жубера, короткого ребра, синдрома Барде — Бидля, асплении или полисплении и VACTER-L, которые способны повлиять на дальнейшую постнатальную выживаемость[6].
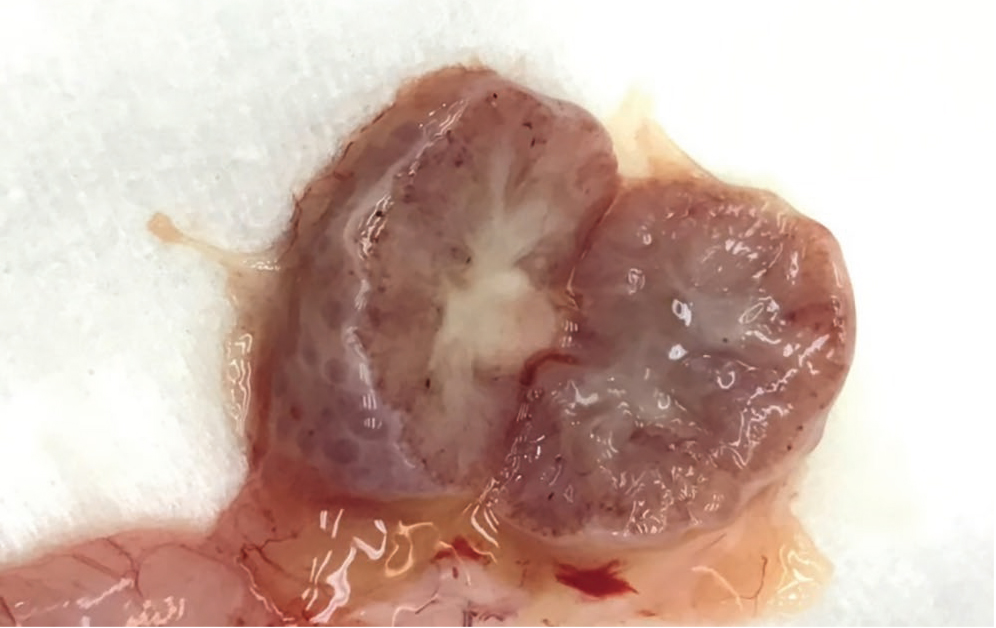
Длительная обструкция мочевыделительной системы приводит к кистозной дисплазии и нарушению клубочковой и канальцевой функций почек (рис. 1).
Рис. 1. Кистозная дисплазия почек. Здесь и далее в статье фото авторов
При двустороннем поражении почек у плода и отсутствии внутриутробной коррекции смертность составляет около 45%, главным образом из-за тяжелого маловодия и возникновения легочной гипоплазии. В 50% случаев развивается терминальная стадия почечной недостаточности, и дети нуждаются в проведении диализа вскоре после рождения и пересадки почки в возрасте до 5 лет[7]. В структуре причин трансплантаций почек у детей доля врожденных обструктивных уропатий составляет 60%[8].
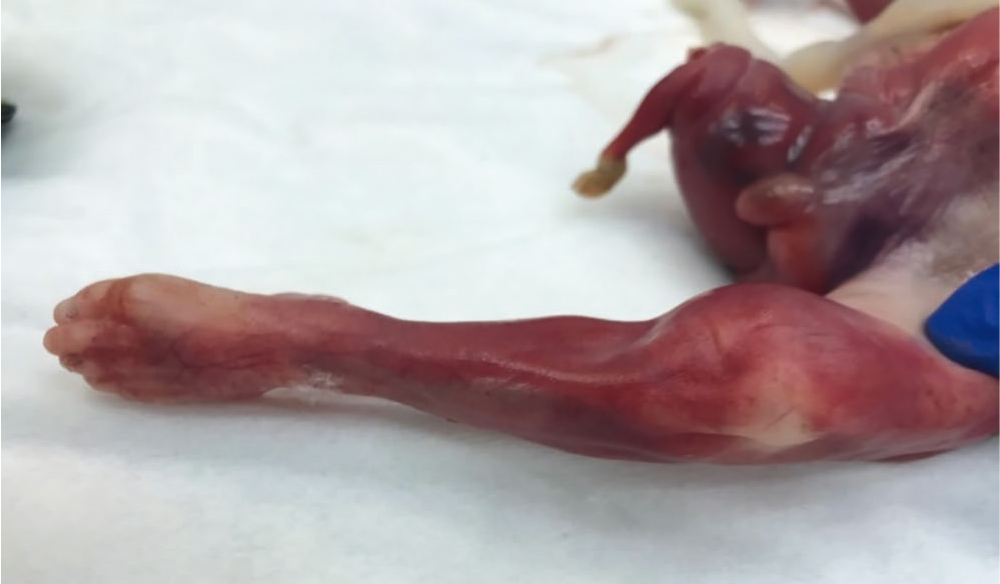
Длительная двусторонняя обструкция мочевыделительной системы плода приводит к маловодию или полному отсутствию вод. На фоне маловодия внутриутробно формируются осложнения других органов и систем. Уменьшенное количество околоплодных вод снижает и двигательную активность плода. Это влияет на развитие опорно-двигательного аппарата. Длительная компрессия суставно-мышечной системы приводит к позиционным аномалиям конечностей — микромелии и фиксированному положению конечностей, возникает атрофия мышц (рис. 2)[9].
Рис. 2. Позиционная аномалия правой нижней конечности — микромелия
Со стороны сердечно-сосудистой системы развиваются следующие осложнения: гипертрофия правого желудочка (64%), гипертрофия левого желудочка (48%), гидроперикард (44%) и кардиомегалия (40%)[10]. Почти у четверти плодов отмечена систолическая дисфункция правого желудочка, в 8% случаев — водянка плода, сопровождающаяся митральной и трикуспидальной регургитацией.
Это связано с увеличением постнагрузки, вызванным сдавлением подвздошных артерий и растянутым мочевым пузырем. Нарушение функции почек, ассоциированное с инфравезикальной обструкцией, способно привести к высвобождению вазоактивных медиаторов, таких как ренин и альдостерон, которые могут повлиять на сердечное ремоделирование и диастолическую функцию. Кроме того, развитие легочной гипоплазии может изменить гемодинамику плода из-за снижения легочного кровотока с более низким венозным оттоком в легкие и меньшим наполнением левых отделов сердца[11, 12].
В настоящее время имеются немногочисленные исследования влияния обструктивных уропатий на развитие нервной системы плода. В 2020 году S. Monteiro и соавт. доказали, что повышенная частота задержки физического и адаптивного развития наблюдается у детей с пренатально диагностированной тяжелой степенью обструкции мочевыделительной системы. Высказано предположение, что в связи с развившимися у плодов уремией и анемией, связанными с пренатальной почечной недостаточностью вследствие обструкции, изменяется метаболизм в центральной и периферической нервной системе, нарушаются миелинизация нейронов и синаптогенез.
На основе результатов исследований новорожденных с хронической почечной недостаточностью, проходивших диализ, установлен высокий риск задержки психомоторного развития. Авторы подтвердили необходимость постоянного и длительного наблюдения за психомоторным развитием у всех пациентов с обструктивными уропатиями, независимо от тяжести поражения мочевыделительной системы и проводимого внутриутробного лечения[13].
Диагностика причин и тяжести обструкции мочевыводящего тракта плода позволяет прогнозировать постнатальный исход, тем самым определить тактику ведения беременности, в том числе своевременно решить вопрос о возможном ее прерывании. Однако в некоторых случаях послеродовой исход трудно предсказуем, поскольку обструктивная уропатия влияет на многие органы и системы плода.
Вопрос о пролонгировании беременности решают будущие родители после информирования их на пренатальном консилиуме о возможных осложнениях у плода/новорожденного и методах внутриутробного и послеродового лечения.
При обструктивных уропатиях, при выраженных двусторонних поражениях почек ввиду тяжести патологии, согласно Приказу Министерства здравоохранения РФ от 20 октября 2020 года N 1130н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология”», показано прерывание беременности. Поэтому при выявлении фатальных пороков мочевыделительной системы в процессе пренатальной верификации врачами принимается решение в пользу прерывания беременности по медицинским показаниям.
Понятие фатальности порока предполагает несовместимые с жизнью состояния, наступающие либо во время беременности (антенатальная гибель плода), либо после рождения ребенка (ранняя неонатальная смерть). Фатальные уропатии в большинстве наблюдений сочетаются с синдромом мегацистис. Они сопровождаются патологическим мочеиспусканием плода (снижением диуреза, отсутствием продукции мочи, маловодием) и имеют все ультразвуковые маркеры тяжелых пороков развития мочевыделительной системы (синдром мегацистис-мегауретер-микроколон, синдром «сливового живота», синдром клапана задней уретры в сочетании с двусторонним обструктивным или рефлюксирующим уретерогидронефрозом). Некоторые авторы ультразвуковыми маркерами тяжелых пороков с летальным исходом считают патологию обеих почек, выраженное маловодие, отсутствие визуализации мочевого пузыря[14].
Большинство исследователей рекомендуют прерывание беременности при детском типе поликистоза, агенезии почек, двусторонних почечных аномалиях обструктивного типа, инфравезикальной обструкции. В мировой практике есть полярные точки зрения относительно ведения беременности при данной патологии: от эвтаназии новорожденных, проводимой в соответствии с Гронингенским протоколом (Нидерланды), до категорического отрицания любого прерывания беременности, принятого в восточных странах[15].
При отказе пациентки от прерывания беременности по религиозным или этическим причинам необходимо в кратчайшие сроки решить вопрос о внутриутробной коррекции порока плода, чтобы минимизировать риск перинатальных осложнений.
Результаты исследований показывают, что именно в перинатальном периоде формируются предпосылки для развития хронических заболеваний почек и дистальных отделов мочевыводящей системы у детей раннего и старшего возраста[4].
Пренатальная диагностика обструктивных уропатий (ультразвуковое исследование, магнитно-резонансная томография) позволяет уточнить диагноз, осуществлять динамическое наблюдение за состоянием мочевыделительной системы плода и навигацию при внутриутробном хирургическом лечении, которое может предотвратить прогрессирование почечной недостаточности.
Наиболее информативным методом диагностики врожденных патологий мочевыделительной системы плода является ультразвуковое исследование, которое в отношении заболеваний мочевыводящей системы имеет чувствительность 78–91%[16]. Однако стоит отметить, что частота ложноположительной диагностики обструкции мочевых путей по результатам ультразвукового исследования может достигать 22%[17].
Оценка урогенитальной системы плода в первом триместре осуществляется путем идентификации мочевого пузыря и, по возможности, почек с помощью трансвагинального ультразвукового исследования с использованием датчиков высокого разрешения. Мочевой пузырь определяется с 11 недель беременности в виде анэхогенной структуры внутри малого таза плода, а почки плода визуализируются с 12–14 недель[18].
Увеличение мочевого пузыря, неспособность опорожняться в течение 30–45 минут ультразвукового исследования, утолщение его стенки свидетельствуют о затруднении оттока мочи. Уже в первом триместре гестации можно выявить ультразвуковые признаки обструктивного поражения мочевыделительной системы плода, поэтому при дальнейшем ведении беременности необходимо тщательное динамическое наблюдение за состоянием его почек[19].
Моча плода — это основной источник околоплодных вод после 14–16 недель беременности. Пренатальная оценка мочевыделительной системы должна включать определение количества околоплодных вод.
Объем амниотической жидкости отражает диурез плода. Ангидрамнион считается признаком нарушения функции почек, а нормальное количество вод при обструктивной уропатии плода не всегда является предиктором положительного исхода. Североамериканская ассоциация терапии плода (North American Fetal Therapy Network) провела ретроспективный обзор данных о 32 беременных с обструкцией мочевыделительной системы плода при нормальном объеме околоплодных вод в середине гестации. Перинатальная выживаемость составила 97%. Последующее наблюдение было доступно у 25 (78%) детей, в трети случаев для коррекции постнатальных осложнений применялся перитонеальный диализ[20].
А.А. Nassr и соавт. проанализировали исходы у плодов с обструкцией мочевыделительной системы при нормальном количестве околоплодных вод во втором триместре беременности. В 61,1% случаев в третьем триместре развилось маловодие. В возрасте двух лет только у 14,3% детей регистрировалась нормальная функция почек. У 57,1% детей выявлено хроническое заболевание почек, а у 28,6% наблюдалась терминальная почечная недостаточность. Авторы сделали вывод, что нормальное количество околоплодных вод в середине беременности не позволяет прогнозировать нормальную функцию почек в постнатальном периоде[21].
Тем не менее патологически малое количество околоплодных вод, изменения состояния паренхимы почек в постнатальном периоде гораздо чаще определяют почечную недостаточность.
В 2019 году F. Fontanella и соавт. на основе результатов национальных ретроспективных исследований, проведенных в восьми академических больницах третьего уровня Нидерландов, предложили систему стадирования. Она базируется на таких критериях, как объем мочевого пузыря, количество околоплодных вод и срок гестации[22].
Эта система способна надежно прогнозировать при первом ультразвуковом сканировании тяжесть обструктивных уропатий, а также в дальнейшем проводить надлежащее консультирование родителей и определенную «сортировку» случаев с целью отбора плодов с относительно благоприятным постнатальным прогнозом на оперативное внутриутробное лечение.
Во всех выявленных случаях обструктивной уропатии у плода проводилось консервативное лечение, и в первый год измерялась скорость клубочковой фильтрации для прогнозирования постнатальной выживаемости и оценки функции почек.
Случаи инфравезикальной обструкции с объемом мочевого пузыря ≥ 5,4 см3 или аномальным количеством околоплодных вод до 20 недель беременности были определены как тяжелые с неблагоприятным перинатальным исходом, а случаи с объемом мочевого пузыря < 5,4 см3 и нормальным количеством околоплодных вод при сканировании в 20 недель гестации — как умеренные. Клиническая оценка включала определение пола плода (мужской), степени растяжения мочевого пузыря, размера мочеточников, наличия олигоамниона или ангидрамниона и гестационного возраста на момент исследования. Комбинация этих пяти переменных продемонстрировала высокую точность (риск развития обструкции 96% с чувствительностью 78%)[22].
С 20 недели беременности возможно четко различить корковый и мозговой слои почек, оценивается их эхоструктура, врачи обращают внимание на степень расширения чашечно-лоханочной системы почек. В качестве диагностического критерия используют численные значения переднезаднего размера почечных лоханок. При поперечном сканировании во втором триместре беременности переднезадний размер больше 7 мм соответствует пиелоэктазии, при его возрастании до 10 мм устанавливается диагноз гидронефроза[23]. Для определения степени гидронефроза применяют классификацию A. Grignon и градуированную системную классификацию Общества фетальных урологов.
Класс 0: нет расширения, стенки чашечек сомкнуты.
Класс 1 (легкий):
-
дилатация почечной лоханки без дилатации чашечек (может также происходить во внепочечной лоханке);
-
отсутствие паренхиматозной атрофии.
Класс 2 (легкий):
-
умеренная дилатация почечной лоханки;
-
визуализация расширенных центральных чашечек;
-
отсутствие паренхиматозной атрофии.
Класс 3 (умеренный):
-
умеренное расширение почечной лоханки;
-
визуализация расширенных периферических чашечек;
-
может наблюдаться легкое истончение коркового вещества почек.
Класс 4 (тяжелый):
-
грубое расширение почечной лоханки и чашечек;
-
отсутствие границы между почечной лоханкой и чашечками;
-
атрофия паренхимы почек рассматривается как истончение коркового вещества почек[24].
Чтобы охарактеризовать кровоснабжение паренхимы почек плода используют режим направленного энергетического доплеровского сканирования. При обструкции мочевыводящих путей возникает атрофия паренхимы почек. Паренхима имеет обедненный кровоток, слабый сосудистый рисунок, не прослеживающийся до капсулы почки. Визуализируются только расширенные элементы собирательной системы, которые «раздвигают» сегментарные и междолевые ветви кровеносных сосудов почки.
Систематический обзор R.K. Morris и M.D. Kilby подтвердил прогностическую ценность повышенной эхогенности и кистозных изменений почечной паренхимы. Олигогидрамнион на момент постановки диагноза обструктивной уропатии стал предиктором снижения функции почек у новорожденных. В исследовании 101 плода с обструктивной уропатией 40 (39,6%) живорожденных детей имели скорость клубочковой фильтрации менее 60 мл/мин[25]. L.K. Duin и соавт. также показали, что эхогенность коркового слоя почки и уменьшенное количество околоплодных вод были лучшими предикторами развития постнатальной почечной недостаточности[26].
К сожалению, традиционные маркеры и показатели функциональной оценки почек у плода, включая ультразвуковые измерения структуры почек, количество околоплодных вод, объем продукции мочи плода и электролиты мочи, не обладают достаточными чувствительностью и специфичностью для прогнозирования почечных исходов у плодов с обструкцией мочевыводящих путей. К тому же, по данным многоцентрового исследования типа «случай — контроль», опубликованным в 2015 году, даже при строгих ультразвуковых критериях обструктивной уропатии (мегацистисе плода, увеличении толщины стенки мочевого пузыря, признаках двустороннего гидронефроза и олигогидрамнионе) оценка состояния младенцев после родов выявила 23% ложноположительных диагнозов[27].
Даже при сохраненном кровотоке в паренхиме почек у плодов не всегда удается оценить функцию самого органа, а биохимический анализ мочи плода тоже является неоднозначным и спорным критерием состоятельности и функциональной активности почечной паренхимы (оценка содержания ионов натрия, хлора, осмолярность мочи).
Поэтому в настоящее время стоит первоочередная задача изучения кровотока в основных артериях почек для определения их функционального состояния. В 2015 году в Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии им. академика В. И. Кулакова Минздрава Росси было проведено исследование, цель которого — оценить компенсаторные изменения в здоровой почке при односторонней обструктивной уропатии у плода. В исследовании типа «случай — контроль» проспективно проанализированы линейный и объемный размер почек и параметры кровотока в почечной артерии и паренхиме у 29 плодов с односторонними обструктивными пороками мочевыделительной системы и у 45 плодов без этих аномалий в сроке от 20 до 40 недель беременности. Доказано, что при односторонней обструктивной уропатии в здоровой почке происходят антенатальные компенсаторные изменения, характеризующиеся увеличением как ее линейных размеров и объема, так и степени васкуляризации. Эти признаки проявляются в конце второго триместра и напрямую связаны со степенью коллатерального поражения почек[28].
В последнее время новые исследования функции почек у плода направлены на идентификацию новых биомаркеров — определение небольших белков, которые метаболизируются в проксимальном отделе канальцев почек. Предложено несколько биохимических маркеров для оценки функции почек плода, например β2-микроглобулин, α1-микроглобулин и глобулин-связывающий белок. Новой областью, вызывающей большой интерес, является выявление в околоплодной жидкости ростовых факторов, таких как трансформирующий фактор роста β и эпидермальный фактор роста.
Среди представленных биомаркеров все больший интерес вызывает β2-микроглобулин, который позволяет более точно оценить почечную функцию у плодов. Установлено, что данный биомаркер дает возможность прогнозировать постнатальную функцию почек при уропатиях и нефропатиях. Его уровень может коррелировать со степенью нарастания дисфункции почек. По результатам немногочисленных исследований доказано, что пороговое значение этого биомаркера, взятого из пуповинной крови плода, — 10 мг/л[29].
Исследование 2018 года, проведенное S. Dreux и соавт., продемонстрировало связь между концентрациями натрия, кальция и β2-микроглобулина в моче плодов с обструктивными уропатиями и функцией почек в постнатальном периоде (10–30 лет). Наличие β2-микроглобулина в моче плода предсказывало снижение количества клубочков, в то время как β2-микроглобулин сыворотки плода был связан с дисплазией почек, а также клинически коррелировал с постнатальным уровнем креатинина сыворотки крови[30].
Однако в исследовании А.А. Nassr и соавт. не удалось показать связь между ультразвуковыми параметрами почек и биохимией мочи. Не выявлены корреляции между повышенной эхогенностью паренхимы почек, кортикальными кистами, тяжелым олигогидрамнионом и концентрациями натрия, хлора, кальция в моче плода, осмоляльностью и β2-микроглобулином[31].
Но подобных исследований мало, и не существует определенных нормативных показателей, представляющих зависимость почечной недостаточности от степени нарастания содержания данного глобулина.
Таким образом, прогнозирование функции почек в настоящее время в основном базируется на ультразвуковых исследованиях паренхимы почек и определении количества околоплодных вод.
В современных условиях, владея методами пренатальной коррекции обструктивных поражений мочевыделительной системы, можно добиться улучшения перинатальных исходов при тяжелых двусторонних и односторонних поражениях мочевыделительной системы.
В связи с тем, что инфравезикальная обструкция связана с увеличением перинатальной и младенческой смертности и заболеваемости, были предложены дородовые мероприятия для предотвращения осложнений со стороны мочевыделительной системы у новорожденных[4].
После постановки диагноза при помощи лучевых методов исследования и на основе данных о функции почек необходимо решить вопрос о внутриутробной коррекции порока.
Фетальная хирургия — это инновационное и перспективное направление современной медицины, благодаря которому плод стали рассматривать как пациента и производить диагностику и лечение различных его патологических состояний с помощью инвазивных методик.
Существует несколько методов фетальной коррекции обструктивного поражения различных отделов мочевыделительной системы, способных обеспечить нормализацию оттока мочи в амниотическую полость.
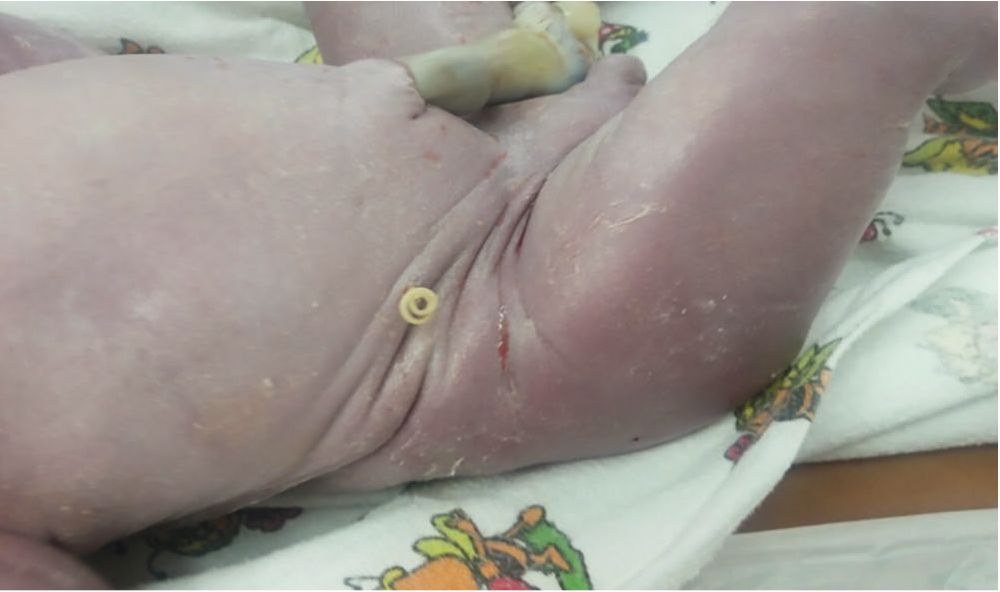
Везико-амниальное шунтирование (ВАШ) (рис. 3) — наиболее часто применяемый метод при клапане задней уретры. Впервые об этом виде хирургического лечения сообщили M.S. Golbus и соавт. в 1982 году, которые установили шунт в мочевой пузырь плода мужского пола[32]. Однако внутриутробная операция по поводу обструкции выходного отверстия мочевого пузыря у плодов мужского пола улучшает немедленную постнатальную выживаемость, но не долгосрочную функцию почек и не предотвращает развитие терминальной почечной недостаточности[33].
Рис. 3. Везико-амниальное шунтирование в ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России
Шунтирование мочевого пузыря плода при обструкции нижних отделов мочевыделительного тракта позволяет предотвратить дальнейшее поражение ткани почек и необратимое нарушение их функции, а также способствует нормализации количества околоплодных вод и, соответственно, предупреждает развитие гипоплазии легких. Шунтирование мочевого пузыря плода может выполняться как под контролем ультразвукового исследования, так и при помощи фетоскопии. Наиболее распространенным методом шунтирования мочевого пузыря является установка стента в виде double pigtail[34].
Данные исследований подтверждают лучшую перинатальную выживаемость плодов после процедуры ВАШ, чем при консервативном ведении. А.А. Nassr и соавт. в 2017 году представили обновленный систематический обзор и метаанализ эффекта ВАШ. Основными оцениваемыми параметрами были перинатальная и послеродовая выживаемость, вторичным результатом — влияние ВАШ на постнатальную функцию почек и его сравнение с таковым выжидательной тактики.
Авторы проанализировали когортные исследования и клинические испытания. Полученные результаты 9 исследований объединены в группу метаанализа[35]. Выжили 64 (57,1%) из 112 плодов в группе ВАШ против 52 (38,8%) из 134 плодов группы консервативной выжидательной тактики. Объединенная оценка выживаемости была разной в двух группах и свидетельствовала в пользу ВАШ.
Исследователи пришли к выводу, что проведение фетальной коррекции в объеме ВАШ имеет преимущество перед динамическим наблюдением для увеличения перинатальной выживаемости, но однолетняя и двухлетняя выживаемость и оценка функции почек в долгосрочной перспективе после процедуры ВАШ остаются неопределенными. Необходимы исследования, оценивающие эффективность ВАШ при различной степени тяжести обструкции нижних отделов мочевыводящих путей[36].
Благодаря улучшенной антенатальной диагностике на основе ультразвукового исследования, ВАШ возможно производить, начиная с 12–13-й недели гестации. ВАШ является альтенативным методом дренажа и пассажа мочи у плода, восстанавливает объем околоплодных вод. В результате улучшаются функции легких и почек ребенка в постнатальном периоде.
Почки плода начинают вырабатывать мочу на 10-й неделе беременности, и раннее ВАШ (до 14-й недели гестации) значительно улучшает нефрогенез и сохраняет дальнейшую функциональную активность почки[37]. Однако выявить пороки развития на этой ранней стадии беременности чрезвычайно сложно.
В 2020 году проведено ретроспективное когортное исследование, целью которого стала оценка целесообразности применения шунтирования мочевого пузыря в первом триместре беременности и осложнений и исходов у новорожденных[38]. В исследование включены пациентки, у которых, по данным ультразвукового исследования, поставлен диагноз мегацистис плода с продольным диаметром мочевого пузыря не менее 15 мм на ранних сроках беременности. В ходе исследования у 10 плодов мужского пола произведено ВАШ, средний гестационный возраст составил 13,3 (12,6–13,9) недели. После внутриутробной коррекции зарегистрированы 4 экспульсии стента. Семь детей родились в 31,0–38,9 недели беременности (средний гестационный возраст — 35,1 недели), 3 новорожденных погибли от сформировавшейся гипоплазии легких. У 6 младенцев, выживших в неонатальном периоде, была нормальная функция почек. Перинатальная выживаемость составила 75 и 85,7% среди живорожденных детей.
Доказано, что проведение шунтирования на мочевом пузыре у плода на ранних сроках беременности снижает частоту осложнений как у плода, так и у матери. ВАШ уменьшает риск олигогидрамниона и гипоплазии легких у новорожденных, поэтому авторы определили более высокую выживаемость у таких детей. Частота почечной недостаточности при рождении оказалась низкой[38].
Внутриутробная цистоскопия у плода — альтернативное лечение инфравезикальной обструкции. Она может стать как диагностическим, так и терапевтическим методом при обструктивных уропатиях. Данный вид лечения имеет теоретические преимущества перед ВАШ. При стентировании мочевого пузыря возможно возникновение множества осложнений, включая закупорку самого стента либо его смещение или экспульсию. Цистоскопия позволяет уточнить и поставить правильный пренатальный диагноз, визуализировать уретру плода и провести специфическое лечение — разрушение клапана задней уретры. Предполагается, что данный тип вмешательства способствует нормальному развитию мочевого пузыря, так как сохраняется физиологический процесс наполнения и опорожнения.
Однако для оценки эффективности такого типа вмешательства требуется проведение дальнейших исследований, так как оно сопряжено с высокой частотой осложнений. Фетальная цистоскопия может иметь высокую чувствительность (100%) и специфичность (85,7%) для подтверждения причины обструктивной уропатии у плода, наиболее часто встречающегося диагноза клапана задней уретры. Перинатальные смертность и заболеваемость при использовании цистоскопии как метода пренатальной терапии обструкции нижних мочевыводящих путей плода не ниже, чем при ВАШ[39].
С 2017 года группа авторов под руководством R. Ruano проводит пилотное исследование безопасности, осуществимости и эффективности чрескожной цистоскопии плода под контролем ультразвукового исследования — фетоскопии — как экспериментальной процедуры предотвращения перинатальной смерти и почечной недостаточности в ходе пренатальной диагностики и терапии плода с обструкцией выходного отверстия мочевого пузыря. Первоначальные клинические испытания дали благоприятные результаты[40].
Малоинвазивное нефроамниальное шунтирование — перспективный метод внутриутробной коррекции врожденной патологии, который не только купирует проявления инфравезикальной обструкции, но и применяется при гидронефрозах III–IV степени у подов, что профилактирует развитие вторично сморщенных почек, в том числе и при односторонних процессах. Применение данного вида фетальной терапии у беременных с обструктивными поражениями мочевыделительной системы плода в мире практически не практикуется.
Однако с 2015 года в клиническую практику ФГБУ «Уральский НИИ ОММ» внедрено нефроамниальное шунтирование стентом с оригинальной формой пигтейлов с целью опорожнения полостной системы почек альтернативным способом и декомпрессии мочевыводящих путей (патент на полезную модель № 152166, 2015 год) (рис. 4).
Рис. 4. Нефроамниальное шунтирование стентом с оригинальной формой пигтейлов
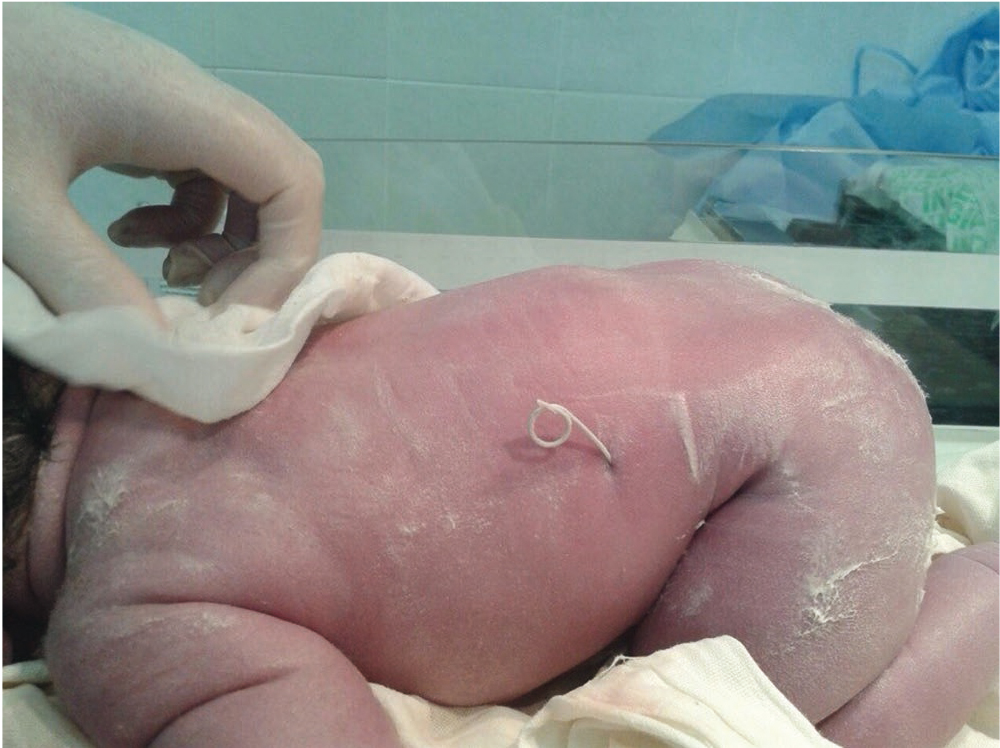
В качестве проводника используется игла G16. Нефроамниальное шунтирование почек снижает риск часто встречающихся осложнений со стороны плода, таких как окклюзия, экспульсия или миграция стента, что позволяет сохранить дальнейший нефрогенез и функцию почек и тем самым увеличить выживаемость. Предложенный вид внутриутробной хирургической коррекции полостной системы почек при врожденной обструкции мочевыделительной системы плода является патогенетически обоснованным методом лечения и применим при всех типах обструкций.
Данная методика утверждена на заседании этического комитета 9 июня 2015 года. Наша практика показывает, что этот малоинвазивный метод шунтирования почек плода дает возможность использовать более короткий стент с оригинальной формой пигтейлов, обеспечивающий более надежную фиксацию в полостной системе почек плода. Обеспечивается адекватная уродинамика обеих почек плода, сохраняется нормальная функция пораженных органов, предотвращается формирование кистозной дисплазии паренхимы и вторично сморщенных почек, тем самым профилактируется неблагоприятный исход заболевания органов мочевой системы у новорожденных детей. Однако это требует дальнейшего изучения и оценки отдаленных результатов[41].
Выбор оптимального метода лечения врожденной обструктивной уропатии плода продолжает быть одним из самых сложных в фетальной терапии.
Ранняя пренатальная диагностика и своевременно начатое внутриутробное и постнатальное хирургическое лечение позволяют в большинстве случаев предотвратить развитие осложнений и неблагоприятного исхода заболеваний органов мочевой системы у новорожденных[42].
ЗАКЛЮЧЕНИЕ
В структуре причин хронической почечной недостаточности у детей обструктивные уропатии занимают лидирующую позицию. Своевременная и качественная пренатальная диагностика обструктивных патологий мочевыделительной системы плода позволяет вовремя их выявить и прогнозировать перинатальные исходы.
Проведение внутриутробных шунтирующих операций при обструктивной уропатологии плода может в большей степени способствовать снижению риска неблагоприятных перинатальных исходов, профилактике развития осложнений со стороны других органов и систем и предотвращению инвалидизации детей в постнатальном периоде, чем консервативное наблюдение, однако необходимы дальнейшие исследования и оценка отдаленных результатов.
Изучение и внедрение в практику новых диагностических критериев оценки кровоснабжения в паренхиме почек, поиск новых биохимических маркеров для определения тяжести обструктивных уропатий позволят выбрать не только оптимальный метод ведения пациентов с данной патологией, но и, при необходимости, провести своевременную внутриутробную коррекцию с целью возможной профилактики тяжелых форм почечной недостаточности.
Поступила: 12.05.2023
Принята к публикации: 12.07.2023








