Гипертензивные расстройства (хроническая (ХАГ), гестационная (ГАГ) АГ), частота которых варьирует от 2% до 30%, влияют на течение беременности неравным образом. Наиболее грозным осложнением, сопровождающимся не только гипертензией, но и полиорганной недостаточностью, является преэклампсия (ПЭ), которая нередко бывает не самостоятельным осложнением беременности, но развивается на фоне предшествующего гипертензивного состояния (ПЭ на фоне ХАГ). В 25% случаев беременность у женщин с ГАГ и ХАГ может осложняться ПЭ[1].
ПЭ наблюдается у 2–5% беременных и продолжает оставаться предметом активного научного поиска вследствие весомого вклада в драматические осложнения во время беременности, а также краткосрочные и отдаленные отрицательные последствия для жизни женщины и ее ребенка. Так, ПЭ по сей день остается одной из основных причин материнской, перинатальной и младенческой смертности и заболеваемости во всем мире[2, 3].
Выделение двух фенотипических вариантов ПЭ (ранней и поздней) способствовало лучшему пониманию патофизиологии течения и исходов беременности для матери и плода[4–7]. Разделительным сроком между ранней и поздней ПЭ принято считать 34 недели беременности, поскольку именно с этого срока значительно снижается неонатальная заболеваемость[8–11]. Ранняя ПЭ, как правило, характеризуется более тяжелым течением, развитием HELLP-синдрома, эклампсии, значимо чаще ассоциируется с задержкой роста плода и индуцированными преждевременными родами в сравнении с поздней ПЭ[5–7, 9]. При этом ранняя ПЭ осложняет малый процент беременностей, поскольку в большинстве наблюдений ПЭ развивается после 34 недель, и частота поздней ПЭ достигает 85%[12].
В настоящее время отсутствуют исследования, сравнивающие течение беременности у пациенток с различными гипертензивными расстройствами. В связи с этим изучение особенностей течения беременности, ее исходов для матери и новорожденного при различных гипертензивных нарушениях представляет большой практический интерес, поскольку способствует выработке оптимальной врачебной тактики, направленной на улучшение акушерских и перинатальных исходов.
Цель данного исследования — сравнительный анализ течения и исходов беременности у пациенток с различными гипертензивными расстройствами.
МАТЕРИАЛЫ И МЕТОДЫ
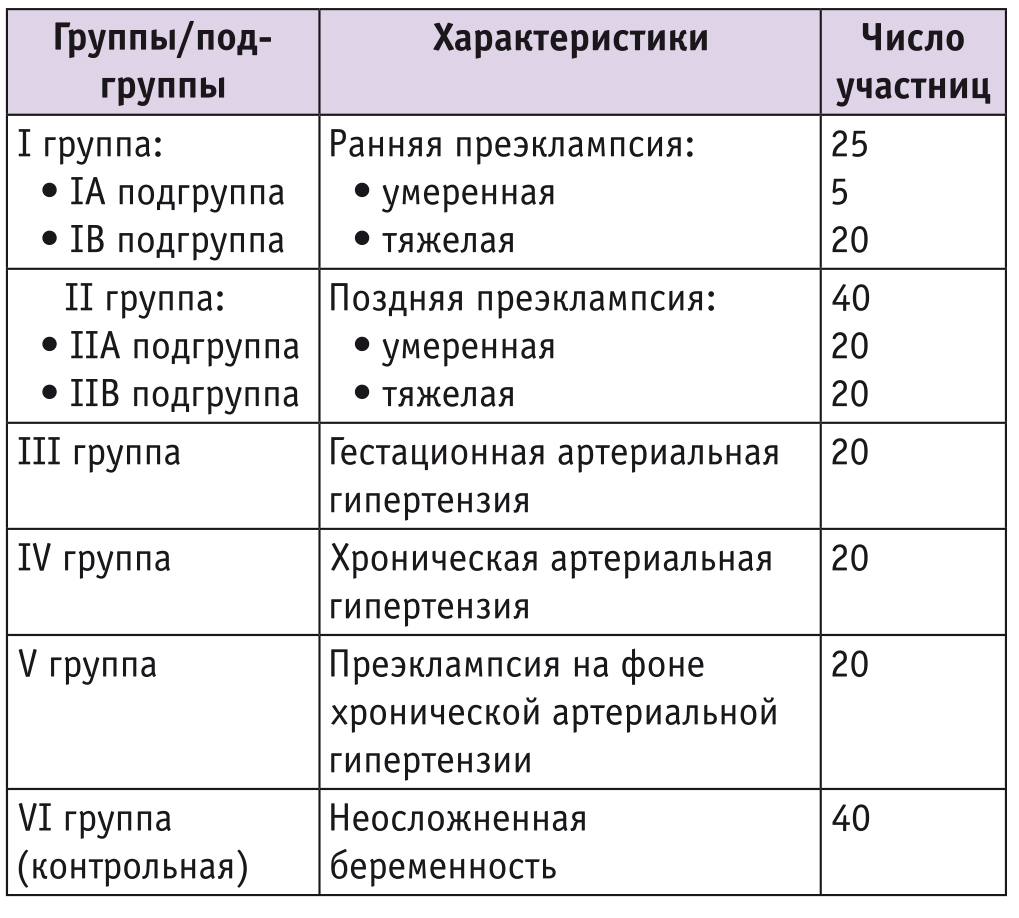
В открытое проспективное исследование включены 165 беременных, которые были разделены на 6 групп (табл. 1).
Таблица 1
Распределение беременных по группам (n = 165)
Все пациентки подписали добровольное информированное согласие на участие в исследовании. Было получено разрешение локального комитета ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» на проведение данного исследования. Использовали нижеследующие критерии отбора пациенток.
Критерии включения:
- информированное согласие на участие в исследовании;
- возраст пациенток 18–40 лет;
- одноплодная спонтанная беременность.
Критерии невключения:
- многоплодная беременность;
- беременность, наступившая после применения ВРТ;
- СД;
- трансплантированные органы;
- аутоиммунные заболевания;
- онкологические заболевания;
- заболевания почек в стадии декомпенсации.
Критерии исключения:
- хромосомные аномалии у плода;
- врожденные пороки развития плода;
- антенатальная гибель плода.
Диагноз ПЭ устанавливали на основании критериев, регламентированных отечественными клиническими рекомендациями (Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия)[13]. Применялись следующие методы обследования: клинические (подробный сбор анамнеза, общий и акушерско-гинекологический осмотр), клинико-лабораторные (опре- деление группы крови и резус-фактора, анализ крови на антитела к сифилису, ВИЧ, гепатиту В и С, клинический анализ крови, биохимический анализ крови с оценкой уровней АЛТ, АСТ, лактатдегидрогеназы и щелочной фосфатазы, гемостазиограммы, маркеров ПЭ — PLGF, sFlt-1, sFlt-1/PLGF), общий анализ мочи, суточная протеинурия, проба Реберга, мазок на микрофлору из влагалища, бактериологическое исследование посева из заднего свода влагалища), инструментальные (УЗИ, УЗ-доплерометрия, антенатальная кардиотокография). Результаты обследования вносились в специально разработанную тематическую карту и в электронные таблицы MS Excel. Статистическая обработка данных выполнялась на индивидуальном компьютере с помощью электронных таблиц Microsoft Excel и пaкета статистической программы IBM SPSS Statistics v22 (США). Для качественных показателей определяли доли и риски (процентное соотношение, %). Для анализа качественных данных применяли тест χ2 с расчетом поправки на непрерывность для таблиц 2 × 2. Для количественных показателей определяли среднее значение и стандартное отклонение. Для анализа количественных данных для оценки межгрупповых различий применяли методы параметрической статистики (t-критерий Стьюдента) при нормальном распределении данных. При отсутствии нормального распределения использовали методы непараметрической статистики — U-критерий Манна — Уитни для двух групп. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Средний возраст обследованных составил 31,72 ± 3,47 года. Пациентки с ранней тяжелой ПЭ (РтПЭ) были статистически значимо старше участниц с поздней умеренной ПЭ (ПуПЭ) и женщин контрольной группы (р = 0,046 и р = 0,049 соответственно). ИМТ пациенток с ГАГ, ХАГ и ПЭ на фоне ХАГ был выше такового в контрольной группе (р = 0,021; р = 0,042 и р = 0,004 соответственно).
У родственников пациенток с РтПЭ, с ХАГ и ПЭ на фоне ХАГ АГ встречалась значимо чаще (р = 0,007), чем у родственников участниц контрольной группы. Кроме того, в семьях пациенток с ПЭ на фоне ХАГ статистически значимо чаще, чем в семьях контрольной группы, отмечался инфаркт миокарда (р = 0,034).
При изучении паритета пациенток наибольшая частота первобеременных женщин наблюдалась в подгруппе с ПтПЭ (65%), в то время как в остальных группах этот показатель колебался в пределах 30–45%.
Антенатальная гибель плода встречалась в анамнезе лишь у женщин с РтПЭ (подгруппа IB), и ее частота достигала 20%. Стоит отметить, что у пациенток с ХАГ (группа IV) привычный выкидыш в анамнезе был чаще, чем в остальных группах (20% против 0–15%), в этой же группе ятрогенные преждевременные роды, связанные с развитием тяжелой ПЭ, требующей досрочного родоразрешения, и рождение ребенка с синдромом задержки развития плода (СЗРП) имели место у 15% и 10% женщин соответственно, в то время как в остальных группах их частота не превышала 5%.
Сравнительный анализ перенесенных гестационных осложнений продемонстрировал статистически значимые различия между группами в частоте ПЭ в анамнезе. Данное осложнение при предыдущих беременностях было нехарактерно для подгрупп IA и IIA и контрольной группы. Таким образом, частота ПЭ в анамнезе в подгруппе РтПЭ (40%) и группах ХАГ и ПЭ на фоне ХАГ (по 35%) значимо отличалась от показателей подгруппы ПуПЭ (р = 0,006; р = 0,013) и контрольной группы (р < 0,0001; р = 0,001). Группа ГАГ по этому параметру (20%) также статистически значимо отличалась от контрольной (р = 0,027). Более того, частота ПЭ в анамнезе в группе ГАГ (20%) была статистически значимо выше в сравнении с таковой в контрольной группе (р = 0,027).
В целом пациентки с гипертензивными нарушениями во время беременности статистически значимо чаще имели отягощенный семейный и акушерский анамнез.
Сравнительный анализ течения беременности не выявил значимых различий между группами в частоте угрожающего выкидыша или угрожающих преждевременных родов, истмико-цервикальной недостаточности, гестационного СД (ГСД), анемии или дисбиоза влагалища.
Примечательно, что манифестация симптомов ПЭ (повышение АД и протеинурия) во II триместре статистически значимо чаще происходила у пациенток с ранней ПЭ, но при тяжелой форме заболевания: n = 13 (65%) (р < 0,0001 для отличия от подгрупп IA и IIB и р = 0,016 для отличия от группы ХАГ). Та же тенденция наблюдалась и в отношении протеинурии: она была существенно чаще зафиксирована в подгруппе PтПЭ в сравнении с подгруппами IIA (р = 0,005) и IIB (р = 0,007).
Отеки также наиболее часто имели место при раннем дебюте ПЭ: у 40% женщин с ранней умеренной ПЭ (РуПЭ) и у 35% с РтПЭ против отсутствия таковых у беременных с ПуПЭ (р = 0,033 и р = 0,005 соответственно), с ХАГ (р = 0,037 и р = 0,006 соответственно) и контрольной группы (р = 0,005 и р < 0,0001 соответственно). Кроме того, отеки статистически значимо чаще отмечались при РтПЭ, чем при поздней тяжелой ПЭ (ПтПЭ) (5%)и ГАГ (5%) (в обоих случаях р = 0,029). В группе ПЭ на фоне ХАГ отеки зафиксированы у 10% участниц.
Осложнения ПЭ во II триместре более часто возникали в группе ранней ПЭ, в основном при тяжелом ее течении. Тромбоцитопения выявлена у 5% беременных с РтПЭ, повышение активности АЛТ и АСТ — у 20% с РуПЭ и 10% с РтПЭ. Нарушения фето-плацентарного (ФПК) и маточно-плацентарного кровотоков (МПК), по данным УЗ-доплерометрии, диагностированы у 40% женщин с РуПЭ, 25% с РтПЭ, 10% с ГАГ, 10% с ХАГ и 15% с ПЭ на фоне ХАГ. В группе поздней ПЭ и контрольной группе нарушения не выявлены. Однако различия между группами не были статистически значимыми.
В то же время СЗРП диагностирован только в подгруппах РтПЭ (30%), ПтПЭ (10%) и группе ПЭ на фоне ХАГ (15%); его частота среди пациенток с РтПЭ была статистически значимо выше, чем при ПтПЭ (р = 0,032).
Досрочное родоразрешение к концу II триместра потребовалось 6 (30%) женщинам с РтПЭ и 3 (15%) с ПЭ на фоне ХАГ. По этому показателю подгруппа IA значимо отличалась от подгрупп IIА (р = 0,024) и IIB (р = 0,032), а также от групп III (р = 0,032), IV (р = 0,027) и VI (р < 0,0001).
Таким образом, при РтПЭ дебют заболевания (с появлением гипертензии и протеинурии) происходит статистически значимо раньше, чем при РуПЭ и поздней ПЭ. При этом уже с самого начала течение РтПЭ осложняется нарушением ФПК и МПК, тромбоцитопенией, повышением активности печеночных трансаминаз и развитием СЗРП. Стоит добавить, что течение ПЭ на фоне ХАГ также характеризуется ухудшением показателей УЗ-доплерометрии, развитием СЗРП и тромбоцитопенией, что требует досрочного родоразрешения.
В III триместре беременности частота ГСД, угрожающих преждевременных родов, анемии, дисбиоза влагалища в группах статистически значимо не различалась (табл. 2). Распространенность протеинурии варьировала в пределах 92–100% в группах с ПЭ.
Таблица 2
Течение беременности у обследованных женщин в III триместре
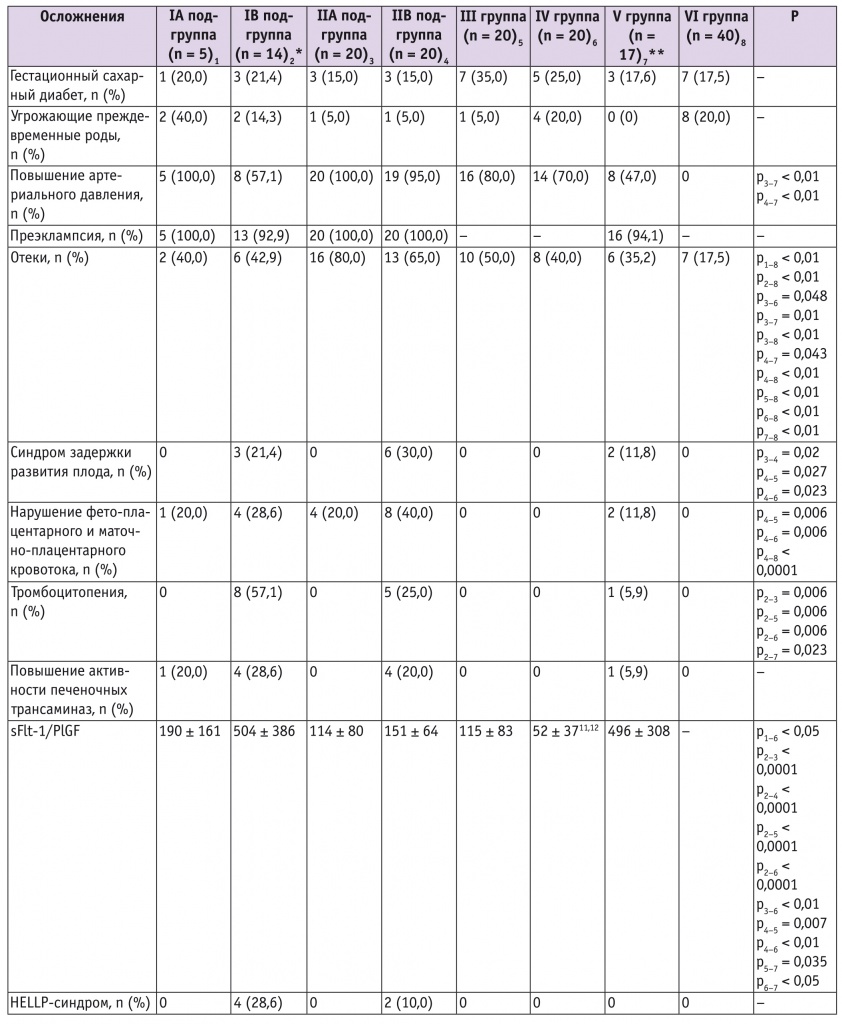
* 6 женщин были родоразрешены во II триместре.
** 3 женщины были родоразрешены во II триместре
Важно отметить, что HELLP-синдром был диагностирован только у пациенток с тяжелой ПЭ: у 4 (28,6%) с РтПЭ и у 2 (10%) с ПтПЭ. Наличие СЗРП и HELLP-синдрома при тяжелой ПЭ свидетельствует о полиорганных нарушениях в этих группах женщин.
Дебют гипертензии и протеинурии подгруппе РуПЭ произошел в 27,4 ± 3,2 и 31,6 ± 2,3 нед соответственно, в подгруппе РтПЭ — в 25,9 ± 3,86 и 28,25 ± 3,77 нед, ПуПЭ — в 36,3 ± 2,36 и 35 ± 2,47 нед, ПтПЭ — в 35,7 ± 1,95 и 36,3 ± 1,95 нед, в группе ПЭ на фоне ХАГ — в 23,1 ± 10,9 и 32,85 ± 5,77 нед.
В группах ГАГ и ХАГ гипертензия дебютировала в 31,95 ± 4,75 и 25,2 ± 10,43 нед соответственно.
Показатели протеинурии в подгруппе ПтПЭ были существенно выше таковых в подгруппе ПуПЭ (р = 0,006). То же касалось и значений суточной протеинурии (р = 0,006 при сравнении с подгруппой ПуПЭ и р = 0,036 при сравнении с группой ПЭ на фоне ХАГ).
Соотношение sFlt-1/PlGF было самым высоким в подгруппе РтПЭ и самым низким в группе ХАГ (см. табл. 2).
Сравнительный анализ антигипертензивной и нейропротективной терапии среди пациенток с повышенным АД показал значимые различия между группами (табл. 3). Так, однокомпонентную гипотензивную терапию значительно чаще получали пациентки с ГАГ и ПуПЭ в сравнении с больными РтПЭ (р = 0,005) и ПЭ на фоне ХАГ (р = 0,002). Пациентки с ХАГ статистически значимо чаще обходились однокомпонентной терапией в сравнении с женщинами с РтПЭ (р = 0,044). Участницы групп ПтПЭ и ХАГ также получали однокомпонентную терапию статистически значимо чаще в сравнении с пациентками с ПЭ на фоне ХАГ (р = 0,022).
Таблица 3
Антигипертензивная и противосудорожная терапия у беременных с гипертензивными нарушениями, n (%)
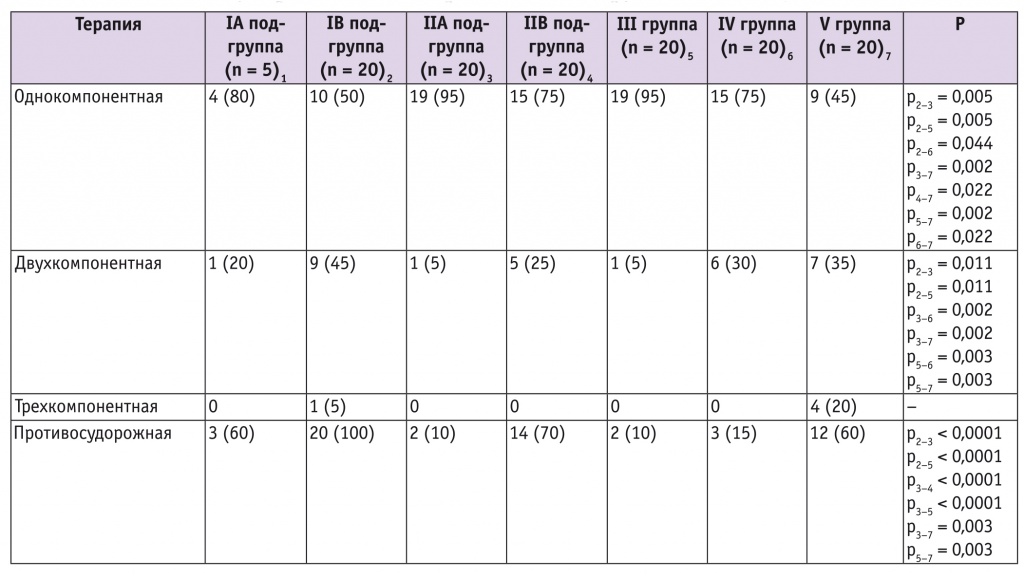
Двухкомпонентная терапия статистически значимо чаще назначалась женщинам с РтПЭ, ХАГ и ПЭ на фоне ХАГ, чем беременным с ПуПЭ и ГАГ.
Статистически значимых различий в частоте назначения трехкомпонентной терапии не было.
Противосудорожную терапию получали все беременные с тяжелыми формами ПЭ. Таким образом, частота введения магния сульфата была статистически значимо выше в подгруппах РтПЭ и ПтПЭ в сравнении с таковой у пациенток с ПуПЭ и ГАГ (р < 0,0001). Нейропротективная (противосудорожная) терапия чаще назначалась пациенткам с ПЭ на фоне ХАГ в сравнении с женщинами с ПуПЭ и ГАГ (р = 0,003).
Характер суточного ритма, по данным суточного мониторирования АД, представлен в таблице 4. Согласно результатам сравнительного анализа, частота нормального снижения ночного АД (диппер) была статистически значимо выше в группе ГАГ в сравнении с таковой в подгруппах РтПЭ (р = 0,003), ПтПЭ и при ПЭ на фоне ХАГ (р = 0,024).
Таблица 4
Степень снижения ночного артериального давления (АД), по данным суточного мониторирования, у беременных с гипертензивными нарушениями, n (%)
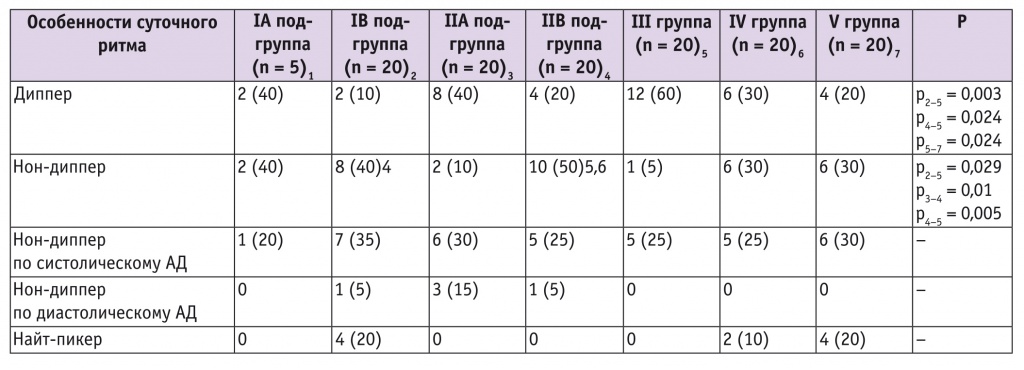
Частота недостаточного снижения АД в ночные часы (нон-диппер) была самой высокой в подгруппах с тяжелой ПЭ, причем в подгруппе РтПЭ этот показатель был значимо выше такового у пациенток с ГАГ (р = 0,029), а в подгруппе с ПтПЭ — пациенток с ПуПЭ (р = 0,01) и ГАГ (р = 0,005).
Частота нон-дипперов отдельно по систолическому и диастолическому АД, а также найт-пикеров со стабильно повышенным АД в ночные часы статистически значимо не различалась между группами. Однако найт-пикеры были только у пациенток подгруппы РтПЭ (20%), групп ХАГ (10%) и ПЭ на фоне ХАГ (20%).
Наименьшим срок родоразрешения был в подгруппе РтПЭ — 29,83 ± 3,58 нед: р = 0,041 при сравнении с подгруппой РуПЭ (33,98 ± 3,34 нед) и р < 0,0001 при сравнении с остальными группами: ПуПЭ — 38,06 ± 1,72 нед, ПтПЭ — 37,51 ± 1,44 нед, ГАГ — 37,78 ± 1,11 нед; ХАГ — 37,59 ± 2,35 нед;
ПЭ на фоне ХАГ — 34,18 ± 4,14 нед, контрольная группа — 39,38 ± 1,04 нед.
Плановое родоразрешение чаще имело место в группах ПуПЭ (р = 0,011), ГАГ (р = 0,004) и ХАГ (p < 0,0001), чем в подгруппе ПтПЭ. Большинство женщин из группы ХАГ были родоразрешены планово в отличие от пациенток группы ПЭ на фоне ХАГ (р = 0,002). Ни одна из женщин из группы ранней ПЭ не была родоразрешена в плановом порядке, и различия были статистически значимыми при сравнении со всеми исследуемыми группами (p < 0,0001 — р = 0,043).
Очень ранние преждевременные роды в сроке 22–27,6 нед произошли только у 5 (25%) женщин с РтПЭ и у 3 (15%) с ПЭ на фоне ХАГ. Ранние преждевременные роды в сроке 28–33,6 нед встречались только у женщин с ПЭ: с РуПЭ — у 2 (40%), с РтПЭ — у 9 (45%), с ПЭ на фоне ХАГ — у 6 (30%), что было статистически значимо чаще, чем в подгруппах ПуПЭ, ПтПЭ и группах ГАГ и ХАГ (для всех трех сравнений р = 0,043; р = 0,002 и р = 0,027 соответственно) и контрольной (р = 0,005; р < 0,0001 и р = 0,002 соответственно).
Частота преждевременных родов в сроке 34–36,6 нед была выше в подгруппах РуПЭ, РтПЭ и ПтПЭ в сравнении с таковой в группах ГАГ, ХАГ, ПЭ на фоне ХАГ (р = 0,003, р = 0,027 и р = 0,013 соответственно) и контрольной (р = 0,0001, р = 0,002 и р = 0,001 соответственно).
Таким образом, ни одна из женщин из группы ранней ПЭ не была родоразрешена в доношенном сроке в отличие от женщин с ГАГ, ХАГ и контрольной группы. Более того, этот показатель в подгруппе РтПЭ был даже ниже, чем в группе ПЭ на фоне ХАГ (р < 0,0001). В подгруппе ПтПЭ своевременно родоразрешены 13 (65%) женщин, что статистически значимо реже, чем в группах ГАГ (р = 0,013), ХАГ (р = 0,013) и контрольной (р < 0,0001). В группе ПЭ на фоне ХАГ в доношенном сроке родоразрешили 11 (55%) женщин, что также статистически значимо реже, чем в группах ГАГ (р = 0,002), ХАГ (р = 0,002) и контрольной (р < 0,0001).
Масса тела новорожденного была самой низкой в группах ранней ПЭ. В подгруппе ПтПЭ и группе ПЭ на фоне ХАГ масса новорожденного была статистически значимо ниже в сравнении с таковой в группах ПуПЭ (р = 0,002 и р = 0,001 соответственно), ГАГ (р = 0,004) и ХАГ (р = 0,023 и р = 0,009 соответственно).
Дети с СЗРП наиболее часто рождались в подгруппе РтПЭ (60%), по этому параметру указанная подгруппа отличалась от все остальных, кроме подгруппы РуПЭ (р < 0,0001 — р = 0,036). В подгруппе с ПтПЭ частота СЗРП равнялась 40%, что было значительно выше таковой в группе ХАГ (р = 0,034).
Обращает на себя внимание высокая частота осложнений раннего неонатального периода в группах с ранней ПЭ и ПЭ на фоне ХАГ (респираторного дистресс-синдрома, врожденной пневмонии, внутрижелудочкового кровоизлияния).
Ранняя неонатальная смерть зарегистрирована в двух группах при экстремально раннем родоразрешении: РтПЭ и ПЭ на фоне ХАГ — по два случая в каждой. Все остальные дети после периода выхаживания на 1-м и 2-м этапах неонатологических отделений выписаны домой.
У всех пациенток с ГАГ АД нормализовалось в течение первой недели после родов, что статистически значимо чаще, чем у других родильниц (p < 0,0001 — р = 0,043). У половины женщин с ПуПЭ также произошла нормализация АД, т.е. существенно чаще, чем в группе пациенток с ПЭ на фоне ХАГ (р = 0,043). Отсутствие нормализации АД спустя 6 нед после родоразрешения наблюдалось в подгруппах РтПЭ, ПтПЭ и группе ХАГ (10–25%).
ОБСУЖДЕНИЕ
Представленные данные продемонстрировали различия в семейном и акушерском анамнезе беременных с различными гипертензивными расстройствами, которые создают неблагоприятный фон для течения беременности. Сравнительный клинико-анамнестический анализ выявил наибольшие различия между группами в отношении частоты ПЭ в анамнезе. Полученные результаты согласуются с литературными данными о прогностической значимости перенесенной ПЭ[14]. В подгруппе с ПтПЭ отмечалась высокая частота СЗРП. Вероятно, следствием указанного факта стало более частое нарушение ФПК и МПК, по данным УЗ-доплерометрии, в подгруппе ПтПЭ, чем в группах ГАГ, ХАГ (р = 0,006) и контрольной (р < 0,0001), где ФПК и МПК были в норме, что согласуется с данными литературы[15, 16].
Несмотря на сопоставимые значения протеинурии в группах с ПЭ, все же она была статистически значимо выше в подгруппе ПтПЭ, чем ПуПЭ (р = 0,006). Показатели суточной протеинурии также были значимо выше у пациенток с ПтПЭ в сравнении с таковыми при ПуПЭ (р = 0,006) и ПЭ на фоне ХАГ (р = 0,036). Некоторые профессиональные сообщества[1, 17] рекомендуют исключить протеинурию из критериев
диагностики ПЭ. Мы считаем, что это не столько диагностический маркер, сколько важный инструмент мониторинга тяжести состояния беременной в случаях тяжелой ПЭ, что соответствует литературным данным[12].
Вполне ожидаемо, что соотношение sFlt-1/PlGF было самым высоким в подгруппе РтПЭ, что отражает выраженность плацентарных нарушений и, как следствие, более тяжелое течение заболевания у этих пациенток. В то же время в группе ХАГ соотношение маркеров было самым низким, что, вероятно, связано с развитием компенсаторных механизмов у этих пациенток, тем более что к моменту наступления беременности у всех отмечались нормальные значения АД без медикаментозной поддержки. Полученные результаты в отношении высоких значений соотношения sFlt-/PlGF при ПЭ согласуются с литературными данными[12, 13]. Однако сведения о соотношении sFlt-1/PlGF при других гипертензивных расстройствах во время беременности нами не найдены.
Также важно отметить, что доля пациенток-дипперов статистически значимо выше в группе ГАГ, чем в РтПЭ (р = 0,003), ПтПЭ и ПЭ на фоне ХАГ (р = 0,024), в то время как доля женщин-нон-дипперов была самой высокой в группах с тяжелой ПЭ.
Возможно, указанные различия обусловили более высокую частоту назначения однокомпонентной гипотензивной терапии пациенткам с ПуПЭ, ГАГ и ХАГ, чем женщинам с РтПЭ и ПЭ на фоне ХАГ. Пациентки из подгруппы ПтПЭ также получали однокомпонентную терапию существенно чаще, чем участницы с ПЭ на фоне ХАГ.
Полученные нами данные подтверждают неоспоримый факт наиболее тяжелого течения ПЭ при ее ранней манифестации. При этом РтПЭ характеризуется более частым развитием HELLP-синдрома и СЗРП. Наибольшее значение sFlt/PlGF именно в этой группе, по-видимому, отражает выраженные нарушения плацентации, которые, согласно общепринятой теории патогенеза ПЭ, лежат в основе данной патологии. В связи с необходимостью досрочного родоразрешения наименее благоприятные неонатальные исходы наблюдались в группе ранней ПЭ, причем в подгруппе РтПЭ частота неонатальных осложнений была статистически значимо выше в сравнении с остальными группами. В то же время у пациенток из подгруппы ПтПЭ в нашем исследовании также фиксировались такие осложнения ПЭ, как HELLP-синдром и СЗРП, а значения протеинурии даже были несколько выше, чем в других группах с ПЭ. Однако, вероятно, в связи с более поздними сроками развития заболевания неонатальные исходы в данной группе были относительно благоприятными. Необходимо отметить, что ПЭ, развившаяся на фоне ХАГ на любом сроке, протекает тяжелее, чем поздняя ПЭ, о чем свидетельствуют более ранние сроки родоразрешения и худшие исходы для плода.
Согласно нашим результатам, наилучшие исходы как для матери, так и для плода имели место в группах ГАГ и неосложненной ХАГ. Вероятно, это связано с высокой комплаентностью к проводимой антигипертензивной терапии среди данных пациенток, ведь они значительно чаще принимали всего один антигипертензивный препарат, чем участницы других групп. Важно напомнить, что у всех пациенток с ГАГ АД нормализовалось в течение первых семи дней после родов.
В нашем исследовании подгруппа РуПЭ была малочисленна, несмотря на тщательный поиск пациенток. Мы полагаем, что это связано с тем, что тяжесть ПЭ при ее раннем дебюте практически во всех случаях прогрессивно нарастает. Еще в 2014 г. Американская коллегия акушеров и гинекологов предложила исключить термин «умеренная» ПЭ, поскольку основной чертой этого грозного заболевания является его внезапное и быстрое прогрессирование[17]. Обращалось внимание клиницистов на необходимость особой бдительности в отношении этих пациенток. По мнению экспертов, следует заменить существующую классификацию умеренной и тяжелой ПЭ на «ПЭ с тяжелыми симптомами» и «ПЭ без тяжелых симптомов», что исключает возможность «мягкого» течения ПЭ. Международное общество изучения гипертензивных расстройств во время беременности также поддерживает данные рекомендации[1].
ЗАКЛЮЧЕНИЕ
Согласно представленным результатам, гестационные гипертензивные расстройства вносят неравнозначный вклад в течение беременности. Полученные нами результаты также подтверждают непредсказуемость течения и быстрые сроки перехода умеренной преэклапсии (ПЭ) в тяжелую форму.
Таким образом, при оценке клинико-анамнестических факторов риска с акцентом на перенесенную ПЭ целесообразно выделить группу женщин для тщательного мониторинга с ранних сроков беременности с целью профилактики неблагоприятных исходов (потерь беременности, гипертензивных осложнений, синдрома задержки развития плода). Поскольку среди гипертензивных расстройств беременных наиболее тяжелыми в плане исходов для женщины и новорожденного являются ранняя и поздняя тяжелая ПЭ и ПЭ на фоне хронической АГ, рекомендуется направлять таких беременных в лечебно-профилактические учреждения 3-й группы.








