ВВЕДЕНИЕ
Сепсис представляет собой максимальную степень генерализации инфекции, приводящую к полному истощению и неспособности иммунных сил организма ее локализовать, к системному ответу на воспаление, полиорганной недостаточности[1]. Септическими осложнениями в акушерстве (СОА) вызваны 11% случаев материнской смерти (МС) в мире. Этот процент выше в странах с низким и средним уровнем экономического развития (13,7% в странах Южной Азии, 10,3% в странах, расположенных к югу от Сахары, в сравнении с 4,7% в экономически развитых государствах) и увеличивается во всем мире[2]. СОА представляют основную угрозу МС в сроке беременности до 22 недель[3]. В России с 2017 по 2018 г. показатель материнской смертности повысился с 8,8 до 9,1 на 100 000 детей, родившихся живыми; в числе основных причин МС, наравне с акушерским кровотечением, акушерской эмболией, разрывом матки и т. д., отмечен сепсис во время родов и в послеродовом периоде[4].
Современные достижения в медицине, особенно в условиях высоких ресурсов, позволяют отнести сепсис к потенциально предотвратимым причинам прямой МС[5] с возможностью исхода в ситуацию near miss (едва не умершие, NM)[6], хотя и неравной в различных странах[7–10], федеральных округах РФ[11]. В Российской Федерации истинная частота разных исходов сепсиса неизвестна[1], имеются расхождения даже в статистических данных федерального уровня, публикуемых Минздравом РФ и Росстатом[4].
Цель исследования — оценка ресурса г. Москвы в снижении материнской смертности при угрожающих жизни СОА.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено многоцентровое ретро- и проспективное исследование, основанное на экспертизе историй родов, осложненных угрожающими жизни СОА, с различным исходом. Период исследования: 2013 г. (1 января) — 2019 г. (31 декабря). Количество медицинских центров — 27 (г. Москва).
Отобрано 60 историй, составивших две группы: МС (n = 10) и NM (n = 50). В группу МС включались все пациентки с данным исходом в указанный период. Выборка историй с NM основывалась на применении таблицы случайных чисел, сгенерированной при помощи пакета анализа данных программы Excel 2007. Критерии СОА соответствовали федеральным клиническим рекомендациям (протоколу лечения) «Септические осложнения в акушерстве» (2017)[3], NM — рекомендациям ВОЗ[6].
Статистический анализ
Статистический анализ данных обеспечен программами Statistica 12.0, Microsoft Excel 2007.
Оценивали число женщин (n), диапазон значений (min — max), для параметрических данных среднее значение и стандартное отклонение (М ± SD), для непараметрических — медиану (Me) и интерквартильный интервал (IQR). Статистическую значимость различий (p) при нормальности распределения данных определяли по t-критерию Стьюдента, при ненормальности распределения — по U-критерию Манна — Уитни. Для оценки различий в частоте исходов применяли критерий хи-квадрат (χ2), при числе наблюдений менее 10 — χ2 с поправкой Йейтса. Тесноту связи фактора риска с исходом интерпретировали с использованием отношения шансов (ОШ) и его 95%-го доверительного интервала (ДИ). Дифференцировку исхода на основании критического значения независимого предиктора оценивали методом бинарной логистической регрессии (англ. logit model). Различие групп (критерий лямбда Уилкса, его значимость — р) по выбранному параметру определяли при помощи дискриминантного анализа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Составлена сравнительная характеристика женщин с угрожающими жизни СОА, входивших в группы МС и NM.
Анализ прегестационных общеклинических данных не показал статистически значимых межгрупповых различий по возрасту (Me = 34 года; IQR = 28–35 (18–41) и Me = 31 год; IQR = 27–34 (19–41) в группах МС и NM соответственно; р = 0,37) и по ИМТ (Me = 23,60 кг/м2; IQR = 20,98–29,93 (19,26–30,86) и Me = 24,31 кг/м2; IQR = 22,00–27,20 (19,30–36,81); р = 0,61), хотя в группе NM величина ИМТ достигала 36,81 кг/м2.
С учетом интенсификации миграционных процессов, значимых в отношении рисков развития угрожающих жизни состояний (в 2018 г. прирост мигрантов в Российскую Федерацию составил 124 854 человека, в Москву — 98 763, из них международных — 12 669[12])[13], большей величины обусловленной сепсисом материнской смертности у городских женщин в сравнении с сельскими (в 2018 г. — 0,75 против 0,50[4]) оценена значимость местожительства как предиктора неблагоприятного исхода СОА. Доля жительниц Москвы в группах МС и NM была сопоставимой (40,0% и 60,0% соответственно; χ2 = 1,41; р = 0,24); процент жительниц иных стран (Украины, Республики Беларусь, Киргизии, Узбекистана, Армении) в группе МС статистически значимо превосходил таковой в группе NM (50,0% против 12,0%; χ2 = 5,7; р = 0,02), что было сопряжено с увеличением шанса неблагоприятного исхода (ОШ = 7,33; 95%-й ДИ: 1,63–33,02).
Зарегистрированный брак имел протективный эффект: он преобладал в группе NM (54,0% против 10,0%; χ2 = 4,84; р = 0,03), повышая шанс выживания (ОШ = 10,57; 95%-й ДИ: 1,24–89,76). Тренд современного мегаполиса — социальное неблагополучие чаще выявлялось в группе МС (20,0% против 6,0%; χ2 = 0,7; р = 0,4) и увеличивало шанс летального исхода, но его влияние не имело статистической значимости (ОШ = 3,92; 95%-й ДИ: 0,56–27,25). Этот результат продемонстрировал возможности мегаполиса в предупреждении СОА-обусловленной МС у наркозависимых и ВИЧ-инфицированных женщин.
Гинекологические заболевания, в отличие от социальных факторов, не предопределяли исход угрожающих жизни СОА (p > 0,05). Хронические ВЗОМТ повышали шанс МС, но статистически незначимо (ОШ = 12,25; 95%-й ДИ: 0,99–151,36).
Неотягощенный предыдущими беременностями репродуктивный анамнез не исключал угрозу жизни при СОА и не влиял на их исход. Доля первобеременных в группах МС и NM была сопоставимой и крайне высокой (по 40,0%; χ2 = 0,13; р = 0,11), значительно превышавшей общероссийский показатель (в 2018 г. — 17,4%[4]). Доля первородящих также имела сопоставимо высокие значения (40,0% и 56,0% в группах МС и NM соответственно; χ2 = 0,02; р = 0,96).
У женщин исследуемой когорты имелась прогнозируемо высокая[3], сопоставимая в группах (р > 0,05) частота экстрагенитальных заболеваний: болезней органов дыхания (хронический тонзиллит, ОРВИ), мочевой системы (хронический пиелонефрит, острый цистит), органов пищеварения (хронический панкреатит, гастрит), инфекционных болезней (ВИЧ, гепатиты В или С), ожирения, — а также перенесенных оперативных вмешательств на органах брюшной полости (ушивание перфоративной язвы желудка, холецистэктомия, осложненный перитонитом аппендицит, абдоминальное ранение). Этот параметр не увеличивал риск МС в условиях мегаполиса.
Таким образом, прегестационными конфаундерами МС при СОА явились социальные факторы (местожительство, социальное благополучие).
Осложненное течение беременности (отслойка хориона, ретрохориальная гематома, кровотечение, истмико-цервикальная недостаточность, требовавшая хирургической коррекции, ОРВИ, бактериальный вагиноз, обострение Herpes labialis и острый фарингит, полиартрит с болевым синдромом, острый флегмонозный аппендицит, обострение хронического вирусного гепатита С, флегмона желудка, распространенный серозно-фибринозный перитонит, приведший к абдоминальному сепсису, внебольничная пневмония) преобладало в группе NM. Только в этой группе отмечены пролабирование плодного пузыря, преждевременный разрыв плодных оболочек (р = 0,047).
Дифференцирована структура угрожающих жизни СОА с различным исходом (табл. 1). Как видно из таблицы 1, ресурс мегаполиса позволил искоренить инфекцию амниотической полости и плодных оболочек как причину МС, но синдром токсического шока остался непреодолимой преградой для выживания.
Таблица 1
Дифференцированная структура угрожающих жизни септических осложнений в акушерстве с различным исходом (n = 60)
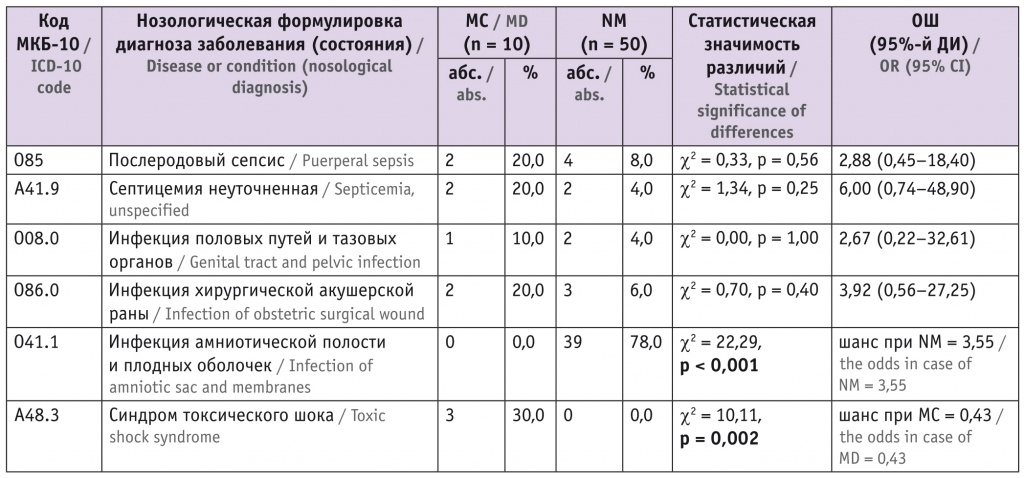
Примечание. В таблицах 1–4 МС — материнская смерть, NM — near miss.
Несмотря на сопоставимый в группах срок беременности при первой явке в женскую консультацию (Ме = 8 недель; IQR = 6–23 и Ме = 10 недель; IQR = 8–12 в группах МС и NM соответственно; р = 0,74), отсутствие наблюдения в женской консультации ассоциировалось с фатальным исходом СОА, оно было отмечено у половины женщин в группе МС и у 14% — в группе NM (χ2 = 4,69; р = 0,03; ОШ = 6,14; 95%-й ДИ: 1,41–26,84).
Способ госпитализации в стационар не был сопряжен с исходом СОА. Пациентки групп МС и NM с сопоставимой частотой были доставлены бригадами скорой медицинской помощи (80,0% и 72,0% соответственно; χ2 = 0,02; р = 0,9), обратились в стационар самостоятельно (20,0% и 22,0%; χ2 = 0,08; р = 0,78). Направлялись врачом женской консультации только пациентки группы NM (6,0%; χ2 = 0,0; р = 1,0).
В акушерский стационар третьего уровня были госпитализированы 76,67% пациенток исследуемой когорты. Госпитализация в акушерский стационар второго уровня, независимо от канала госпитализации, статистически значимо чаще происходила в группе МС (50,0% против 10,0%; χ2 = 6,97; р = 0,009) и прогнозируемо повышала шанс неблагоприятного исхода (ОШ = 9,00; 95%-й ДИ: 1,92–42,24)[3, 14]. При госпитализации в стационар третьего уровня жительницы Москвы не имели преимуществ перед жительницами иностранных государств ни в группе МС (χ2 = 0,39; р = 0,53), ни в группе NM (χ2 = 0,13; р = 0,72).
СОА отличались гетерогенностью и развивались в разные гестационные периоды (на раннем, позднем сроке беременности, при родоразрешении), после родов, предопределяя исход угрожающих жизни СОА. Медианы срока беременности при возникновении СОА в группах МС (Me = 20 недель; IQR = 17–38) и NM (Me = 29 недель; IQR = 25–35) были сопоставимы (р = 0,32). Вероятность МС повышалась, если угрожающие жизни СОА возникали при беременности менее 22 недель (ОШ = 49,00; 95%-й ДИ: 4,74–506,62) или более 37 недель (ОШ = 4,10; 95%-й ДИ: 0,92–18,29). Ресурс мегаполиса значительно повысил шанс благоприятного исхода при угрожающем жизни СОА в сроке 22–36 недель беременности (ОШ = 47,25; 95%-й ДИ: 5,24–426,44).
При развитии СОА в стационаре интервал времени до критического ухудшения состояния при разных исходах был сопоставим (р = 0,93) и варьировал в группе МС от 0 до 3 суток (Me = 1; IQR = 0–2), в группе NM от 0 до 11 суток (Me = 1; IQR = 0–2). При поступлении в стационар с СОА медианы постгестационных суток не определяли исход и были сопоставимы (Ме = 10; IQR = 9–11 и Ме = 13,5; IQR = 8–19 в группах МС и NM соответственно; р = 0,77).
Дородовое излитие околоплодных вод / преждевременный разрыв плодных оболочек наблюдали у 31 из 49 женщин группы NM в сроке от 19 до 39 недель беременности (Me = 28; IQR = 25–31) и у единственной женщины группы МС в сроке 38 недель (χ2 = 6,39; р = 0,012); эти факторы повышали шанс благоприятного исхода СОА (ОШ = 13,78; 95%-й ДИ: 1,59–119,29). Диапазон безводного промежутка широко варьировал. Статистически значимого межгруппового различия по этому показателю не установлено, хотя максимальные его значения были при NM-исходе.
В исследуемой когорте отсутствовали статистически значимые межгрупповые различия в частоте родоразрешения через естественные родовые пути (10,0% и 48,0% в группах МС и NM соответственно; р = 0,06), интранатального кесарева сечения (КС) (10,0% и 8,0%; р = 0,68) и экстренного КС (40,0% и 42,0%; р = 0,82). В группе NM срок беременности при КС варьировал от 23 до 41 недели (Me = 31; IQR = 28–33), пациенткам зачастую требовался корпоральный или истмико-корпоральный разрез на матке, что минимизировало возможность попытки вагинальных родов в последующем. Доношенный срок беременности совокупно с родоразрешением путем КС повышал шанс МС (ОШ = 21,0; 95%-й ДИ: 1,83–240,53), равно как и выкидыш (40,0% и 2,0% в группах МС и NM соответственно; р < 0,001; ОШ = 32,67; 95%-й ДИ: 3,12–342,4). СОА в сроке до 22 недель при любом исходе беременности (выкидыше, неразвивающейся беременности) были сопряжены с еще более высоким шансом МС (ОШ = 49,0; 95%-й ДИ: 4,74–506,62).
Хориоамнионит требовал КС только в группе NM (68,0%; χ2 = 5,32; р = 0,02). В группе МС показанием к КС у единственной пациентки явилось СОА (диссеминированное внутрисосудистое свертывание крови (ДВС), сепсис), у одной — септическое, но не акушерское осложнение (деструктивная внебольничная пневмония), у остальных женщин показаниями были акушерские несептические осложнения (преждевременная отслойка нормально расположенной плаценты, клинически узкий таз, хроническая внутриутробная гипоксия плода, выраженное маловодие у возрастной первородящей). Очевидно, что ресурс мегаполиса позволил преодолеть глобальный фактор риска МС — хориоамнионит, но оказался неэффективным при ургентном развитии тяжелых акушерских осложнений. Сочетание последних с септическими осложнениями, усугубленное неакушерскими конфаундерами (уровнем стационара, местом проживания, уровнем социального благополучия, наличием экстрагенитальных заболеваний), явилось фатальным.
Несостоятельность рубца на матке осложнила 10,0% от всех КС в когорте, статистически незначимо повысив вероятность МС (ОШ = 2,88; 95%-й ДИ: 0,21–39,68). Релапаротомия, отягчающий акушерский фактор[15], доминировала в группе МС и повышала шанс неблагоприятного исхода (ОШ = 6,71; 95%-й ДИ: 1,13–40,08), экстирпация матки была выполнена только в группе МС (χ2 = 5,07; р = 0,03).
Следствия СОА показаны на рисунке. Как видно из представленных данных, септический шок, ДВС/коагулопатия, пневмония, тромбоэмболия легочной артерии, перитонит, острая почечная недостаточность / «шоковые почки», нетравматическое внутримозговое кровоизлияние, перипартальная кардиомиопатия и кишечная непроходимость диагностированы статистически значимо чаще (р < 0,05) или исключительно в группе МС. Вероятность неблагоприятного исхода значительно увеличивали септический шок (ОШ = 216,0; 95%-й ДИ: 17,66–2641,58), ДВС (ОШ = 36,0; 95%-й ДИ: 5,4–240,15) и пневмония (ОШ = 7,67; 95%-й ДИ: 1,51–38,98).
Рис. Следствия септических осложнений в акушерстве в группах исследования, %.
* P < 0,05
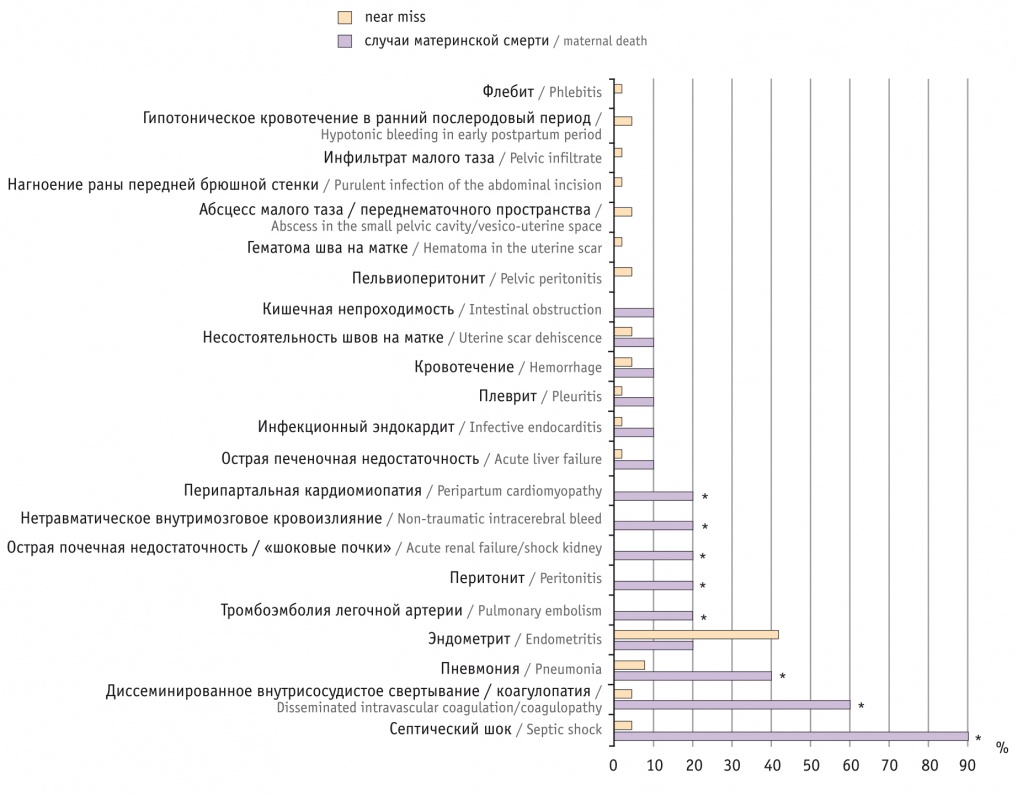
Пельвиоперитонит, гематома шва на матке, абсцесс малого таза или переднематочного пространства, нагноение раны передней брюшной стенки, инфильтрат малого таза, гипотоническое кровотечение в раннем послеродовом периоде, флебит в условиях мегаполиса ассоциировались с выживанием. Острая печеночная недостаточность, в отличие от почечной, инфекционный эндокардит, плеврит, кровотечение, несостоятельность швов на матке, эндометрит, сохраняя угрозу жизни, не исключали исхода в ситуацию NM.
Установлены статистически значимые клинические маркеры исхода СОА: стартовые (при поступлении в стационар) значения минимального систолического (75,7 ± 8,17 и 96,38 ± 9,84 мм рт. ст. в группах МС и NM соответственно; р < 0,0001) и диастолического артериального давления (АД) (Me = 41,5 мм рт. ст.; IQR = 40–45 и Me = 60 мм рт. ст.; IQR = 60–70; р < 0,0001), частоты дыхательных движений (ЧДД) (Me = 23/мин; IQR = 20–40 и Me = 18/мин; IQR = 16–18; р = 0,00003) и сердечных сокращений (ЧСС) (Me = 130 уд/мин; IQR = 120–160 и Me = 109 уд/мин; IQR = 96–114; р = 0,00001).
Не выявлена значимость температуры тела (38,48 ± 2,63 и 38,29 ± 1,31 °C в группах МС и NM соответственно; р = 0,81) — общепризнанного мировым сообществом признака СОА[3], критерия «Системы раннего предупреждения» (англ. Early Warning Systems, EWS) и ее модификаций[2, 16]. Не являлся предиктором МС синдром системного воспалительного ответа, диагностированный у 100% женщин группы МС и сопоставимого числа пациенток группы NM (64,0%; χ2 = 3,57; р = 0,06). Кардиоваскулярные и респираторные критерии шкалы быстрой последовательной оценки органной недостаточности (англ. quick Sequential Organ Failure Assessment, qSOFA) при МС- и NM-исходах имели сопоставимую частоту (р > 0,05), оценка неврологической дисфункции по шкале Глазго в обеих группах превышала 15 баллов.
Клиническая вариабельность и неуниверсальность патогенеза угрожающих жизни СОА[1, 17] отразились в диапазоне гематологических маркеров (табл. 2).
Таблица 2
Гематологические маркеры исхода угрожающих жизни септических осложнений в акушерстве у женщин групп исследования
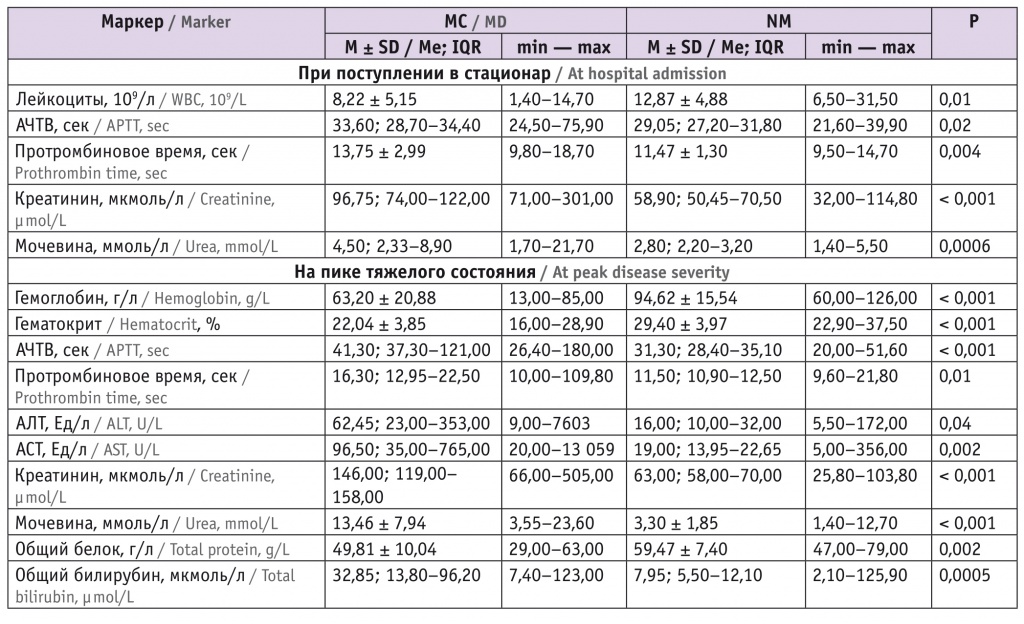
Достоверными признаками исхода угрожающих жизни СОА явились показатель протромбина (лямбда Уилкса = 0,778; p < 0,005), но не тромбоцитов (лямбда Уилкса = 0,997; p = 0,73)[3], уровень креатинина (лямбда Уилкса = 0,676; p < 0,0001)[3], а также его комбинация с показателем мочевины (лямбда Уилкса = 0,577; p < 0,0001) при поступлении в стационар. Концентрация билирубина в крови, являющаяся маркером сепсиса[3], не была статистически значимым классификатором исхода (лямбда Уилкса = 0,925; p = 0,26). Кратность повышения/снижения гематологических показателей определила точку невозврата при СОА (табл. 3).
Таблица 3
Кратность повышения/снижения лабораторных показателей на пике тяжести септических осложнений в акушерстве
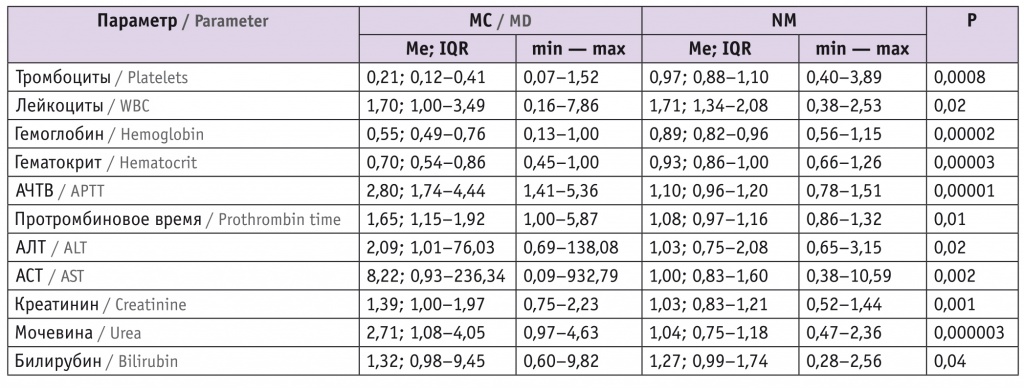
Снижение уровней тромбоцитов, гемоглобина, гематокрита и повышение значений АЧТВ, протромбинового времени, креатинина, мочевины, АЛТ, АСТ, билирубина подтвердили весомость коагуляционной, почечной и печеночной дисфункций при угрожающих жизни СОА[1, 3]. Выявлена дифференцирующая исход кратность изменения показателей крови, рутинно не контролируемых при СОА[2, 3], при дифференциальной диагностике NM[3, 6].
Оценена предиктивная значимость органной недостаточности по шкале оценки ассоциированной с сепсисом органной дисфункции (англ. Sepsis-related Organ Failure Assessment, SOFA) и биомаркеров сепсиса в отношении исхода угрожающих жизни СОА[3] (табл. 4).
Таблица 4
Маркеры оценки тяжести септических осложнений в акушерстве в группах исследования
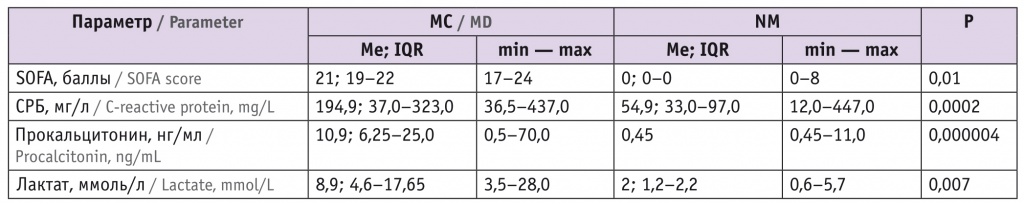
Примечание. SOFA — шкала оценки ассоциированной с сепсисом органной дисфункции.
Группы МС и NM статистически значимо различались по показателям шкалы SOFA, которые только при МС многократно превышали критерии сепсиса, а также по значениям лактата венозной крови, CРБ и прокальцитонина — высокоинформативных маркеров сепсиса и других критических состояний.
Созданы logit-модели прогнозирования исхода угрожающих жизни СОА, на основании которых установлены критические значения клинических и лабораторных маркеров (точки возврата/невозврата). Шанс выживания повышали: систолическое АД более 80 мм рт. ст. и диастолическое — более 45 мм рт. ст.; ЧДД менее 30/мин; ЧСС менее 125 уд/мин; уровень лейкоцитов в крови более 5 × 109/л и его повышение менее чем в 5 раз; АЧТВ менее 52 сек и его увеличение менее чем в 1,5 раза; протромбиновое время менее 14,5 сек и его увеличение менее чем в 1,4 раза; показатель креатинина менее 100 мкмоль/л и его увеличение менее чем в 1,7 раза; показатель мочевины менее 6 ммоль/л и его увеличение менее чем в 2,5 раза; рост уровней тромбоцитов более чем в 0,5 раза, гемоглобина более чем в 0,6 раза, гематокрита более чем в 0,7 раза, АЛТ менее чем в 5 раз, билирубина менее чем в 4 раза; содержание лактата менее 4,0 ммоль/л; уровень прокальцитонина ниже 7,0 нг/мл; оценка по шкале SOFA менее 12 баллов.
Основным локусом инфекции в группах МС (90,0%) и NM (94,0%) прогнозируемо явилась матка (χ2 = 0,05; р = 0,82)[3], у единиц это были легкие (χ2 = 0,0; р = 1,0) и почки (χ2 = 0,81; р = 0,37).) Микробиота цервикального канала и полости матки при МС и NM статистически значимо не различалась. Отличием женщин группы МС стало выделение в крови живых культур Staphylococcus saprophyticus и Klebsiella pneumoniae (р = 0,03) либо более одного микроорганизма (р = 0,04).
Несмотря на крайне тяжелое состояние матерей, неблагоприятный исход для плода в группе МС отсутствовал, а в группе NM произошел у 6,12% пациенток (χ2 = 0,63; р = 0,43) при экстремальной недоношенности (22–23 недели). Исход для плода, в отличие от материнского, не был связан с социальными характеристиками женщины.
Весовые параметры новорожденных широко варьировали. В группе МС во всех случаях (n = 5) отсутствовали маловесные новорожденные — 2640–3850 г (Me = 3160 г; IQR = 2950–3520), что отражало потенциал организма матери противостоять экстрагенитальным заболеваниям и осложнениям гестации, ургентное развитие сочетанных септических и несептических акушерских осложнений, приведших к МС, возможность сохранить жизнь ребенку при родоразрешении в условиях мегаполиса. В группе NM медиана веса была статистически значимо ниже (Me = 1410 г; IQR = 940–2070; р = 0,003) и из 48 плодов 85,42% были маловесными: 29,17% — с экстремально низким (760 г; IQR = 670–900), 25,0% — с очень низким (1335 г; IQR = 1240–1400), 31,25% — с низким весом (1910 г; IQR = 1730–2170). 78,57% новорожденных с экстремальной недоношенностью выжили благодаря маршрутизации и госпитализации женщины в стационар соответствующего уровня.
Выводы
СОА сохраняют угрозу жизни женщины, включая первобеременных, но в условиях мегаполиса МС потенциально предотвратима[18].
Крайняя гетерогенность СОА, отсутствие универсальных предикторов обосновывают сложности их диагностики[1, 17, 19]. В представленной работе установлены критические значения маркеров СОА, определяющие лимит организма по противостоянию угрожающим жизни СОА, и возможности мегаполиса в плане предотвращения МС.
Показано, что неблагоприятный исход угрожающего жизни СОА конкурентно ургентным акушерским причинам предопределяют социальные конфаундеры (местожительство, социальное благополучие). Это согласуется с современным разделением факторов риска сепсиса на акушерские (англ. obstetric-related) и ассоциированные с пациенткой (англ. patient-related)[20], контроль и модификация последних находятся вне компетенции акушера-гинеколога. Гестационные факторы риска подтверждают значимость преконцепционного консультирования, предполагающего профилактику осложненного течения беременности, обострения или дебюта экстрагенитальных заболеваний. Сопряженный с МС срок беременности менее 22 недель, связь МС с госпитализацией в стационар второго уровня требуют своевременной маршрутизации пациентки с угрожающим жизни СОА в лечебное учреждение соответствующего уровня и профиля.
ЗАКЛЮЧЕНИЕ
Ресурс мегаполиса позволяет исключить случаи материнской смерти (МС), обусловленной инфекцией амниотической полости и плодных оболочек, предоставляет возможность предотвратить МС вследствие послеродового сепсиса, септицемии неуточненной, инфекции хирургической акушерской раны, половых путей и тазовых органов, но бессилен при синдроме токсического шока.
Несмотря на потенциал мегаполиса, родоразрешение путем кесарева сечения при доношенном сроке беременности, несостоятельность рубца на матке повышают шанс МС при септических осложнениях в акушерстве (СОА), релапаротомия и экстирпация матки, септический шок, диссеминированное внутрисосудистое свертывание и пневмония угрожаемы по МС.
Ресурс мегаполиса продемонстрировал высокую эффективность в отношении предотвращения МС у женщин с угрожающими жизни СОА при дородовом излитии околоплодных вод / преждевременном разрыве плодных оболочек и длительном безводном промежутке, недоношенной беременности; обеспечил родоразрешение живыми плодами, в том числе в 78,57% случаев экстремально недоношенных, и позволил сохранить всем женщинам группы near miss репродуктивный орган (матку), потенциал естественной фертильности.
Поступила: 01.05.2020
Принята к публикации: 12.05.2020








