ВВЕДЕНИЕ
В настоящее время неинвазивный пренатальный ДНК-скрининг (НИПС) занимает важное место в программе антенатального обследования беременных [1]. НИПС может быть использован как в качестве скрининга второй линии при высоком риске хромосомной анеуплоидии, не ассоциированной с ультразвуковыми маркерами, так и в качестве самостоятельного исследования по желанию беременной. В то же время растет число женщин старшего репродуктивного возраста с отягощенным акушерским анамнезом, экстрагенитальной патологией, осложненным течением данной беременности, неблагоприятным исходом предыдущих беременностей. В этих клинических ситуациях выполнение НИПС для принятия аргументированного решения о необходимости инвазивных диагностических процедур имеет исключительное значение. Важнейшим параметром при проведении ДНК-скрининга является доля плодовой ДНК в материнском кровотоке. Известно, что при фракции плодовой ДНК менее 4% снижается точность теста либо проведение исследования невозможно, так как не позволяет выдать корректный результат [1].
В течение последних лет группы отечественных и зарубежных исследователей анализировали причины низкой фракции плодовой ДНК и ее взаимосвязь с последующими осложнениями и исходами беременности [2–5].
Среди причин феномена низкой фракции плодовой ДНК указывались избыточная масса тела или ожирение, индивидуальные особенности данной беременности, плод с хромосомной анеуплоидией, а также использование различных групп лекарственных препаратов, среди которых особое внимание уделяется низкомолекулярным гепаринам (НМГ) [2, 3, 6–8].
Несмотря на то что патогенетический механизм данного феномена представляется неясным, авторы описывают отдельные клинические наблюдения, указывающие на возможную связь лекарственной терапии и низкой фракции плодовой ДНК [4, 9]. В частности, в одной из публикаций отмечено, что через 36 часов после отмены НМГ эноксапарина удалось достигнуть порога 5,74% фракции плодовой ДНК, вследствие чего проведение теста стало возможными и был установлен высокий риск трисомии 21, подтвержденный инвазивной диагноcтической процедурой [3].
Но в других публикациях четкой связи между приемом лекарственных препаратов и низкой фракцией плодовой ДНК выявить не удалось [7]. Согласно клиническим рекомендациям ведущих акушерских сообществ, НМГ назначают только при тромбофилии высокого риска либо у женщин с перенесенным тромбозом [10]. Однако в последние годы показания для использования НМГ во время беременности расширяются, в частности их назначают для предотвращения плацента-ассоциированных осложнений беременности у женщин с отягощенным акушерским анамнезом и неблагоприятным исходом предыдущей беременности вследствие тяжелой преэклампсии, плацентарной недостаточности, антенатальной гибели плода. В результате увеличивается число беременных, принимающих НМГ с целью профилактики акушерских и тромботических осложнений.
При сочетании со старшим репродуктивным возрастом и отягощенным акушерским анамнезом часто появляется необходимость выполнения НИПС именно у женщин, получающих лечение НМГ.
Цель исследования: оценка влияния терапии НМГ на проведение НИПС хромосомной патологии плода.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 162 женщины в сроках от 10 до 25 недель беременности, у которых был проведен НИПС за период с 01.01.2019 г. по 31.03.2021 г. Протокол исследования одобрен Комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. До включения в исследование у всех участниц получено письменное информированное согласие.
Всего за указанное время в лаборатории молекулярно-генетических методов ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России НИПС выполнили 1505 пациенткам. Из них нами выбраны 49 беременных с низкой фракцией плодовой ДНК (менее 4%), составивших I группу исследования. Низкая фракция плодовой ДНК подтверждалась при повторном заборе крови получением аналогичных данных, в противном случае пациентки в исследование не включались. Среди участниц I группы 17 получали НМГ и 32 не получали.
Беременные с нормальной фракцией плодовой ДНК — II группа (n = 113) — выбраны произвольно из общей базы данных. Среди них 56 женщин принимали НМГ и 57 их не принимали.
Для определения доли плодовой ДНК осуществлялась амплификация локусов ДНК с однонуклеотидными полиморфизмами, оба аллеля которых встречаются примерно с равной частотой. Амплификация производилась мультиплексно, т. е. все локусы ДНК амплифицировались одновременно в одной пробирке с применением 53 специфичных пар олигонуклеотидов (праймеров). В качестве субстрата для амплификации служила внеклеточная ДНК, выделенная из плазмы.
НИПС проводили с помощью высокопроизводительного секвенирования (Next Generation Sequencing) на приборах Ion Proton или Ion S5 (Thermo Fisher Scientific, США). Для каждого образца готовили два варианта библиотек для секвенирования: библиотеки для секвенирования внеклеточной ДНК и библиотеки для таргетного секвенирования частотных однонуклеотидных полиморфизмов. Приготовление библиотек для высокопроизводительного секвенирования ДНК осуществляли без этапа разрушения (шеринга) первоначальной ДНК, поскольку свободно циркулирующая ДНК в значительной степени фрагментирована.
Статистическая обработка материала проводилась с помощью пакетов программ IBM SPSS Statistics (версия 23). Нормальность распределения значений в выборках определяли с использованием тестов Колмогорова — Смирнова и Шапиро — Уилка. При нормальном распределении количественные данные представляли как среднее арифметическое (М) и стандартное отклонение (SD). При распределении, не соответствующем нормальному, данные представляли медианой (Me) с 95%-ным ДИ, минимальным и максимальным значениями. Статистическую значимость различий между частотными показателями оценивали с помощью χ2-теста, между непрерывными величинами — с помощью U-теста Манна — Уитни. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Доля беременных с низкой фракцией плодовой ДНК — 3,2% от числа всех протестированных пациенток (49 из 1505).
Сроки забора крови для определения плодовой ДНК значимо не различались и составили 13,8 ± 2,2 нед в I группе и 13,9 ± 2,4 нед во II группе (p = 0,9). Большинство женщин проходили НИПС по собственному желанию, настаивая на выполнении более точного скринингового обследования, исходя из отягощенного акушерского анамнеза и осложненного течения данной беременности. Необходимо отметить, что у женщин с предшествующим бесплодием, привычным выкидышем чаще отмечаются отклонения в биохимических маркерах комбинированного скрининга I триместра, что повышает тревогу будущих родителей.
Лечение НМГ проводилось по следующим показаниям: тромбофилия высокого риска, тромботические осложнения в анамнезе, наличие потерь беременности в анамнезе после 22 недель, раннее развитие и тяжелое течение преэклампсии и задержки роста плода в исходе предыдущих беременностей.
Доля плодовой ДНК во II группе колебалась от 4% до 25,2%. Проанализированы два клинических наблюдения с экстремально высоким уровнем плодовой ДНК (превышающим 25%). В одном случае беременность у женщины с привычным выкидышем сопровождалась неоднократными кровотечениями на сроках беременности до 22 недель и закончилась преждевременными родами. Второе клиническое наблюдение представляет больший интерес в связи с неясным генезом неоднократных потерь беременности при развитии раннего маловодия, ранней задержки роста плода с последующим прерыванием беременности с нормальным кариотипом до 22 недель. Подобный исход наблюдался у женщины 5 раз, включая текущую беременность. Полученные данные позволяют предположить, что крайне высокие показатели плодовой ДНК могут служить маркером развития плацента-ассоциированных осложнений беременности.
Проанализированы значения низкой фракции плодовой ДНК в I группе, которые колебались от 1,2% до 3,9%.
Уровни плодовой ДНК у женщин, получавших и не получавших терапию НМГ, представлены на рисунке.
Рис. Доля плодовой ДНК у обследованных пациенток.
* Отличия от I группы статистически значимы (p < 0,05)
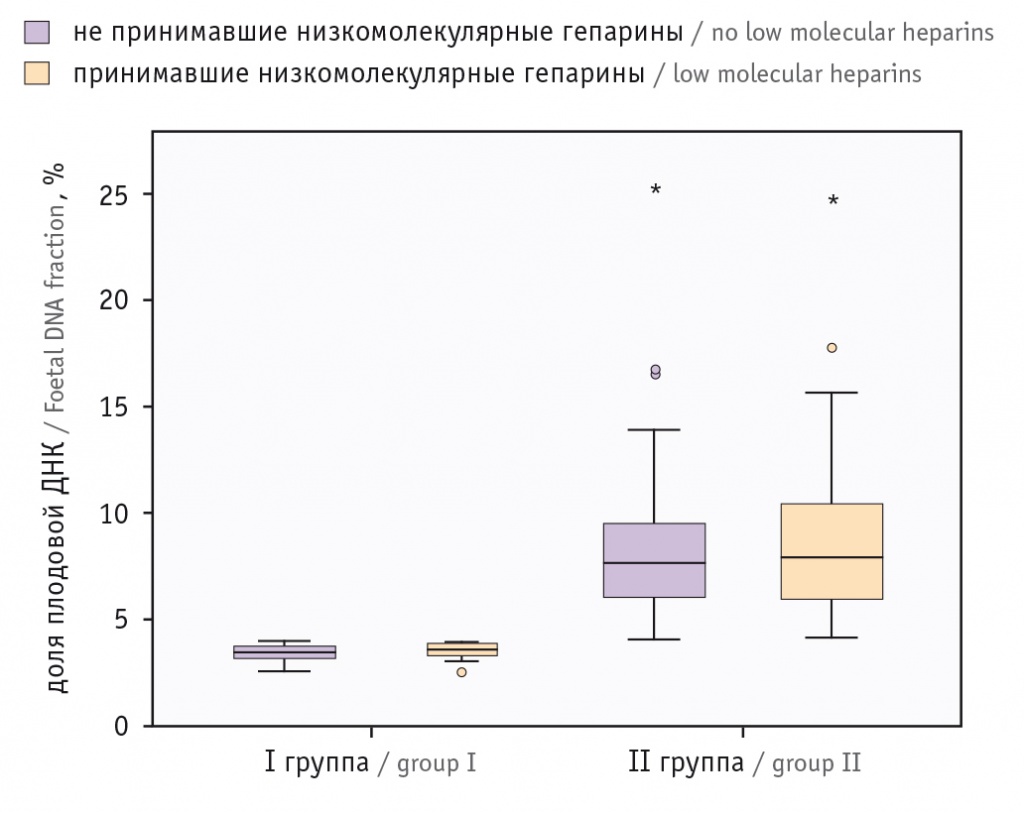
В I группе (с низкой фракцией плодовой ДНК) при отсутствии терапии НМГ медиана значений составила 3,5% (3,2–3,8%), при приеме НМГ — 3,6% (3,4–3,9%), во II группе — 7,7% (6,1–9,5%) и 7,9% (6,0–10,5%) соответственно, значимых различий в обоих случаях не было (p = 0,29 и p = 0,7 соответственно).
Особенностью данного исследования является относительно большое число женщин, получавших терапию НМГ по различным показаниям, прошедших НИПС, — 73 (56 беременных с нормальной фракцией и 17 с низкой фракцией плодовой ДНК).
ЗАКЛЮЧЕНИЕ
В нашем исследовании показано, что лечение низкомолекулярными гепаринами (НМГ) не оказывает воздействия на долю плодовой ДНК в крови беременной при проведении неинвазивного пренатального ДНК-скрининга (НИПС). Следовательно, отсутствует необходимость отменять НМГ перед проведением НИПС либо воздерживаться от назначения НМГ до его выполнения. Необходимы дальнейшие исследования для определения факторов, приводящих к низкой доле плодовой ДНК в периферической крови беременных.
Поступила: 03.09.2021
Принята к публикации: 13.09.2021








