Среди всех онкологических заболеваний колоректальный рак (КРР) занимает третье место в мире и четвертое — в России[2]. Итоги состоявшейся в 2010 г. Всероссийской переписи населения свидетельствуют о его старении. Более пятой части жителей страны находятся в возрасте старше 60 лет. В 50% случаев КРР диагностируют у лиц старше 70 лет[2, 5].
У онкологических больных пожилого и старческого возраста (ПСВ) любые осложнения в периоперационном периоде ведут к удлинению сроков до продолжения комбинированного или комплексного лечения, а иногда и не позволяют его продолжить. В этих возрастных группах КРР находится на втором месте среди причин летальных исходов[1, 12, 14]. Количество осложнений после операций остается высоким и варьирует от 35% до 60%[7, 26, 43]. Вместе с тем отсутствует единая тактика ведения периоперационного периода у геронтологических больных с опухолями данной локализации[5, 17].
Enhanced Recovery After Surgery (ERAS)/Fast-Track Surgery (ускоренное восстановление/реабилитация после хирургических операций) — применение в рамках периоперационного периода совокупности манипуляций и подходов, доказавших свою эффективность в рандомизированных исследованиях. Однако существующие клинические рекомендации по ведению больных в рамках протокола ERAS описывают общие принципы при плановых операциях на ободочной кишке и органах малого таза, без учета возрастных особенностей пациентов и имеющейся онкологической патологии[24, 36]. Данные литературы по лечению больных КРР старших возрастных групп с применением элементов протокола ускоренного восстановления неоднозначны и зачастую носят противоречивый характер[16, 22, 29, 37, 47].
Цель исследования: оценить влияние внедрения оптимизированного протокола Fast Track (ERAS) на результаты лечения пациентов ПСВ с КРР.
МАТЕРИАЛЫ И МЕТОДЫ
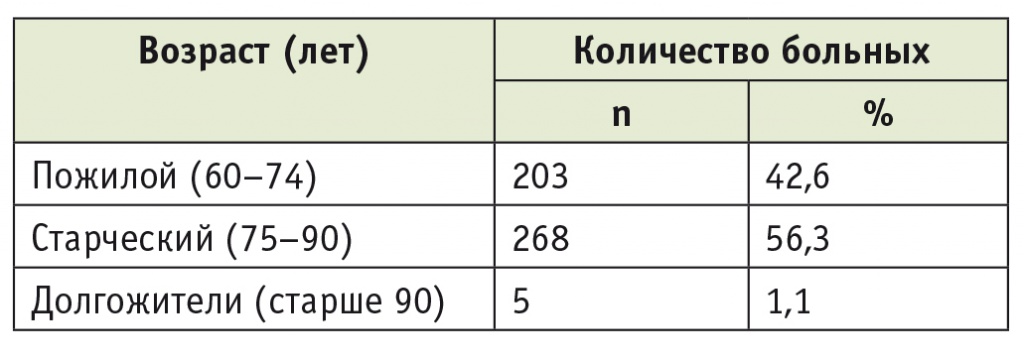
Изучены результаты обследования и лечения 476 пациентов ПСВ с диагнозом КРР, которым были выполнены плановые операции: 63 больным (13,2%) хирургическое лечение осуществлялось с применением лапароскопической методики, остальным — традиционным доступом. Более 90% участников исследования страдали коморбидной патологией в объеме трех и более сопутствующих заболеваний. Средний возраст больных составил 74,8 ± 1,2 года, свыше 50% пациентов были старческого возраста (табл. 1).
Таблица 1
Распределение больных по возрасту (n = 476)
Всем больным до операции выполнялось стандартное лабораторное и инструментальное обследование.
Из основного массива были сформированы две группы пациентов: основная (проспективная, n = 159) и контрольная (ретроспективная, n = 317). В контрольной группе периоперационный период вели традиционно. В основной группе его ведение осуществлялось мультидисциплинарной командой (онколог-хирург, терапевт, анестезиолог, врач ЛФК, радиолог, химиотерапевт, при необходимости эндокринолог, невролог) с применением элементов сформированного оптимизированного протокола Fast Track (ERAS).
Для определения тактики хирургического лечения у пациентов оценивали функциональную операбельность. Для этого, наряду с количественными методами оценки (лабораторная диагностика, в том числе оценка уровня ракового эмбрионального антигена, обязательная гистологическая верификация диагноза, определение распространенности опухолевого процесса с использованием ультразвуковой и компьютерной томографии органов брюшной и грудной полостей, УЗИ сердца), использовали качественные методики. Для предоперационной оценки применяли комплекс шкал Preoperative Assessment of Cancer in the Elderly (PACE), включавший: шкалу оценки ежедневной деятельности (Activities of Daily Living), инструментальной ежедневной деятельности (Instrumental Activities of Daily Living), утомляемости, вызванной онкологическим процессом (Brief Fatigue Inventory), оценки ментального статуса (Mini-Mental State Examination), гериатрическую шкалу депрессии (Geriatric Depression Scale), шкалу оценки нутриционного статуса (Mini Nutritional Assessment)[11, 15, 33, 38, 45]. Оценивали соматический статус больного по шкале Восточной объединенной онкологической группы США (Eastern Cooperative Oncology Group), операционно-анестезиологический риск по шкале Американского общества анестезиологов (American Society of Anesthesiologists)[13], рассчитывали индексы прогнозируемой послеоперационной летальности у больных КРР (CR-POSSUM) и оценки вероятности развития осложнений с учетом тяжести и количества сопутствующей патологии (индекс коморбидности по Charlson)[34]. Качество жизни определяли с помощью стандартного опросника SF-36 и специализированного опросника для больных КРР CR-29 Европейской организации по исследованию и лечению рака (European Organisation for Research and Treatment of Cancer), переведенного нами на русский язык[44].
Тактика рациональной периоперационной нутритивно-метаболической терапии в основной группе заключалась в выявлении пациентов с исходным белково-энергетическим дефицитом и в оптимизации их нутриционной поддержки. При этом учитывали не только ИМТ, но и динамику изменений массы тела (МТ), т. е. отклонение фактической МТ от обычной для данного человека величины за 1–6 месяцев[4, 6, 8].
При предоперационной подготовке по показаниям осуществляли интенсивную коррекцию трофологического статуса за счет искусственного лечебного питания. В период от 10 до 14 дней применяли комплексную диету из продуктов лечебного стола. Дополнительно к диете, в зависимости от объема съеденной пищи, назначали жидкую питательную смесь с высоким содержанием белка (6,65–7,6 г на 100 мл) и энергии (1,2–2,0 ккал в мл): 480 мл/сут питательной смеси (2 пакетика) при потреблении пациентом 75% суточного рациона питания и более и 720 мл/сут (3 пакетика), если объем потребляемой пищи был менее 75% суточного рациона.
У каждого пациента рассчитывали энерготраты покоя и высчитывали фактический суточный расход энергии. С учетом потребностей такой подход в среднем обеспечивал покрытие энергетических и пластических нужд пациента в объеме не менее 25 ккал/кг и 1,5 г белка/кг в сутки соответственно[8, 10, 20, 35].
В рамках послеоперационной нутриционной поддержки применяли раннее энтеральное питание, в том числе как метод профилактики пареза ЖКТ и скорейшего восстановления моторики тонкой кишки. Методика энтерального питания предусматривала назначение 500 мл гипокалорической (0,5 ккал/мл) питательной смеси уже в первые сутки после оперативного вмешательства. В последующие 2–3 суток использовали стандартное разведение смеси (1 ккал/мл) в дополнение к продуктам лечебного стола. Объем питательной смеси увеличивали постепенно — на 250–500 мл/сут[9].
В предоперационном периоде в основной группе также максимально подробно информировали пациентов и родственников о предстоящем лечении с детальным описанием возможных вариантов течения заболевания и обоснованием необходимости как можно более ранней реабилитации (мобилизации) больных ПСВ. Больные группы высокого риска (перенесшие острый инфаркт миокарда, острое нарушение мозгового кровообращения, страдающие гипертонической болезнью III стадии, субкомпенсированным сахарным диабетом, имеющие 4-ю степень риска развития сердечно-сосудистых осложнений) на догоспитальном этапе после дополнительных исследований (УЗИ сердца, оценка функции внешнего дыхания) осматривались анестезиологом. Формировалась рациональная инфузионная программа предоперационной подготовки с применением препаратов, повышающих функциональный резерв, с коррекцией анемии и повторной оценкой состояния по окончании инфузий[23]. Мы отказались от рутинной механической подготовки кишечника с использованием макрогола и подобных препаратов[25, 28]. Пациенты основной группы соблюдали до операции бесшлаковую диету, заключавшуюся в отказе от приема в пищу сырых овощей и фруктов и хлебобулочных изделий, а также в приеме 10%-го раствора магнезии по 3–5 ст. ложек в течение 4 суток с отменой за сутки до предполагаемой даты операции. Больным было разрешено принимать жидкую пищу за 6 часов и жидкость за 2 часа до наркоза[24, 36]. Проводилась стандартизованная профилактика тромбоэмболических осложнений (низкомолекулярные гепарины на сутки до операции).
Распределение больных по вариантам хирургических вмешательств представлено в таблице 2. Стадирование осуществлялось согласно международной классификации TNM 7-го пересмотра [3].
Таблица 2
Распределение больных по вариантам хирургических вмешательств (n = 476)
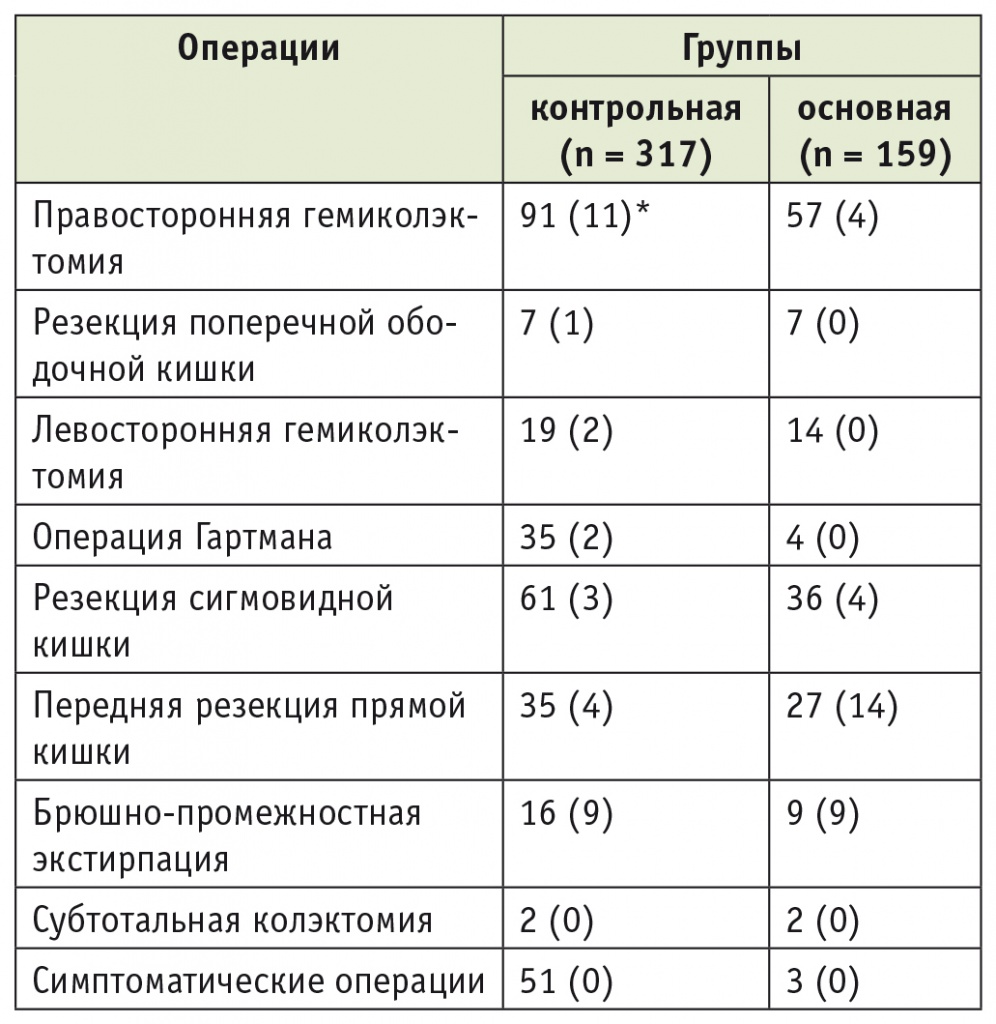
Примечание. В скобках указано количество лапароскопических операций в общем числе хирургических вмешательств.
В интраоперационном периоде в рамках оптимизированного протокола ускоренного восстановления Fast Track всем больным хирургическое вмешательство выполнялось в условиях комбинированной анестезии (регионарной — спинальной и/или эпидуральной) с применением короткодействующих анестетиков и ранним прекращением ИВЛ. Все пациенты были экстубированы в условиях операционной. Обязательным условием являлось поддержание нормотермии путем обогрева больных во время операции, осуществлялась также периоперационная антибиотикопрофилактика. Инфузионная терапия носила рестриктивный характер и состояла в осуществлении инфузий в объеме не более 20–25 мл/кг МТ[19, 24]. Немаловажную роль в редукции хирургического стресса у данной категории больных играет внедрение малоинвазивных (лапароскопических) методик хирургического вмешательства. С учетом возраста и коморбидности наших больных при лапароскопических операциях крайне важно максимально редуцировать негативное влияние длительного карбоксиперитонеума на все органы и системы пациента при сохранении нормального объема брюшной полости, безопасности и удобства оперирования[30, 31, 41]. Для этого лапароскопическое вмешательство выполнялось в условиях глубокого нервно-мышечного блока (НМБ) под контролем TOF-мониторирования (train of four — серия из четырех импульсов), достигавшегося применением рокурония с последующей быстрой реверсией НМБ сугаммадексом, при давлении карбоксиперитонеума 8–10 мм рт. ст.[40]. Это позволяло максимально рано активизировать пациентов в рамках протокола ускоренного восстановления[27]. Мы старались избегать рутинного дренирования брюшной полости[24, 36].
Из числа элементов оптимизированного протокола Fast Track в послеоперационном периоде были применены максимально ранняя вертикализация и активизация пациентов, чему способствовала мультимодальная анальгезия (эпидуральная в сочетании с НПВП) с минимальным применением опиоидных анальгетиков, и раннее (в первые 48 часов) энтеральное питание согласно разработанному протоколу. В совокупности это предупреждало послеоперационный парез кишечника. При гладком течении больным в послеоперационном периоде не назначали антибиотики. Максимально рано удаляли дренажи и катетеры. Продолжалась профилактика тромбоэмболических осложнений. Послеоперационная инфузионная терапия также носила рестриктивный характер[46].
Оценка отдаленных результатов лечения была проведена в сроки от 3 до 52 месяцев у 156 (98,1%) больных основной группы. Основным критерием оценки являлась трехлетняя выживаемость пациентов. Отслеживание результатов продолжается.
Статистическую обработку результатов исследования выполняли с помощью пакета компьютерных программ Microsoft Excel. Различие средних величин, оцененное по параметрическому критерию Стьюдента, считали статистически значимым при p < 0,05[42].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При анализе ближайших и отдаленных результатов лечения больных основной группы в сопоставлении с совокупными баллами методики PACE, прогностических индексов и опросников изучения качества жизни SF-36 и СR-29 установлено:
1) низкая оценка по трем и более шкалам комплекса шкал PACE статистически значимо (р < 0,05) свидетельствует о низкой функциональной операбельности онкологических больных ПСВ и высоком риске развития послеоперационных осложнений;
2) рост индекса коморбидности по Charlson свыше 3 баллов в сочетании с увеличением индекса CR-POSSUM более 5 баллов и показателями качества жизни по шкалам опросника SF-36 ниже 50 баллов статистически значимо (р < 0,05) коррелирует с увеличением числа осложнений и требует проведения комплексной предоперационной подготовки[11].
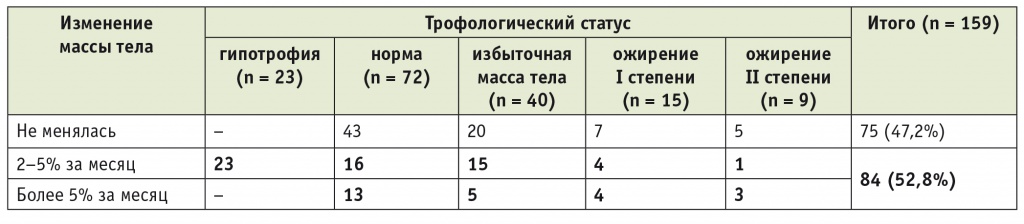
Предложенный протокол нутритивно-метаболической терапии позволил при оценке трофологического статуса в основной группе выявить больных с ИМТ, свидетельствовавшим об избыточном питании или ожирении. Однако при этом более чем у 50% пациентов основной группы была отмечена значимая (2–5% за месяц) или выраженная (> 5% за месяц) динамика потери МТ, что требовало проведения коррекции на всех этапах лечения (табл. 3).
Таблица 3
Распределение показателей трофологического статуса у больных основной группы
В основной группе абсолютное большинство пациентов начинало энтеральное питание в пределах первых 48 часов послеоперационного периода. На этом фоне белковый пул у них восстанавливался уже к 5-м суткам послеоперационного периода, тогда как в контрольной группе — не ранее 8-х суток (р < 0,05), что совпадает с данными литературы[32].
Средний койко-день в отделении интенсивной терапии составил в основной группе 1,7 ± 0,3, что почти в 3 раза ниже, чем в контрольной (4,5 ± 1,2; р < 0,05).
Сроки удаления дренажей в основной группе уменьшились почти в 2 раза и составили 2,5 ± 0,2 суток против 4,3 ± 1,4 суток в контроле (р < 0,05). Сходная статистически значимая разница отмечена и при сравнении среднего времени стояния мочевого катетера: в основной группе этот показатель снизился с 4,5 ± 0,6 до 2,0 ± 0,4 суток, что привело к существенному сокращению количества эпизодов мочевой инфекции (р < 0,05).
В основной группе снизилась частота назначения опиоидных анальгетиков: они использовались лишь у 50 (31,4%) пациентов, тогда как в контрольной группе данные препараты после операции были назначены в 94,4% случаев (р < 0,05). Не было случаев тромбоэмболических осложнений и развития синдрома послеоперационной тошноты и рвоты, которому в зарубежной литературе уделяется немало внимания[24].
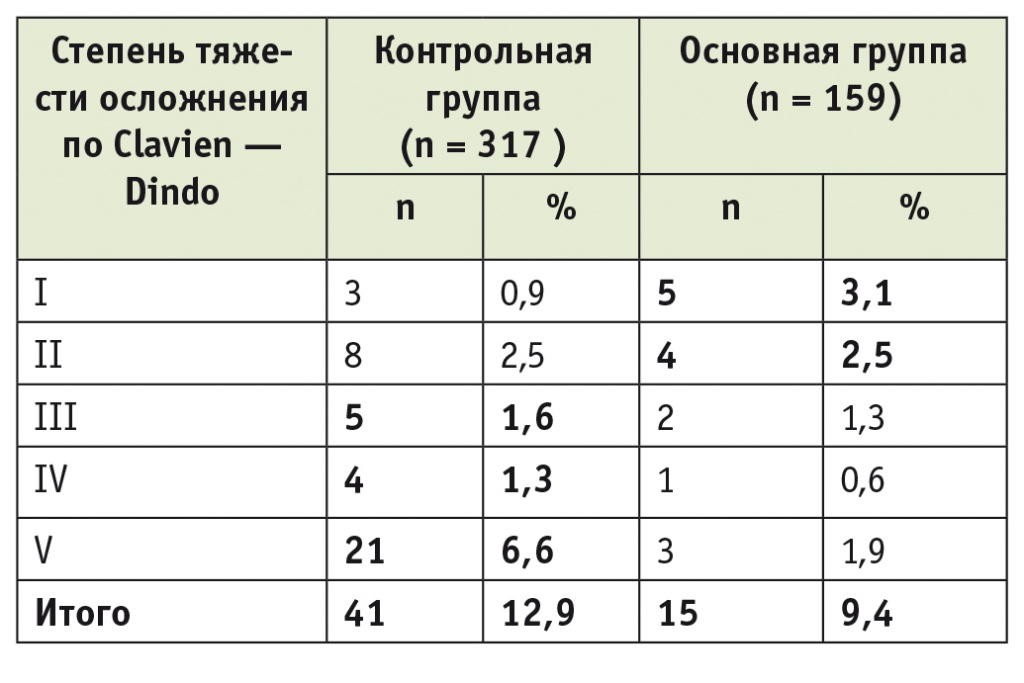
Анализ осложнений по классификации Clavien — Dindo показал статистически значимое снижение их частоты в основной группе по сравнению с контрольной (табл. 4)[21]. Все выявленные осложнения в основной группе были связаны с отступлением или несоблюдением каких-либо элементов протокола Fast Track, при этом превалировали осложнения I–II степени, тогда как в контрольной группе — III–V степени (р < 0,05).
Таблица 4
Количество и тяжесть послеоперационных осложнений (n = 476)
Несостоятельность анастомоза в основной группе отмечена лишь в одном случае (0,6%), тогда как в контрольной данное осложнение имело место у 12 (3,8%) пациентов.
Анализ 30-дневной летальности показал, что среди пациентов основной группы данный исход встречался в 3,5 раза реже, чем в контрольной (р < 0,05).
На фоне внедрения протокола Fast Track средний послеоперационный койко-день у геронтологических онкобольных при открытых операциях уменьшился в 2 раза и составил 7,2 ± 2 суток (в контрольной группе — 13,5 ± 2,3 суток), а при лапароскопических операциях сократился еще больше — до 4,8 ± 1,2 суток (для обоих видов операций р < 0,05). Полученные результаты вполне соответствуют данным литературы[27, 47].
Изучение результатов опросников, оценивавшихся до операции и на 5-е и 7-е сутки послеоперационного периода после лапароскопических и открытых операций соответственно, показало статистически значимое (р < 0,05) улучшение большинства показателей качества жизни при применении элементов оптимизированного протокола Fast Track. Аналогичные сведения приводят и другие исследователи[18, 39].
По результатам оценки отдаленных результатов лечения, проведенной в сроки от 3 до 52 месяцев у 98,2% больных основной группы, общая кумулятивная выживаемость пациентов составила 84,3 ± 1,3%. Это выше данного показателя в контрольной группе — 53,1 ± 2,5% (р < 0,05).
Таким образом, оптимизированный протокол ускоренного восстановления после хирургических операций Fast Track для лечения геронтологических больных с диагнозом КРР является мультимодальной концепцией, направленной на оптимизацию периоперационной терапии с сохранением адекватного онкологического результата. Этот комплекс мероприятий снижает стрессорную реакцию на хирургическое вмешательство и улучшает метаболический ответ на него. Бесспорно, реализация данной концепции должна осуществляться мультидисциплинарной командой. Очень важно точно соблюдать элементы протокола.
Сравнительно недавно многие элементы протокола Fast Track в большой хирургии еще не применялись, а попытки их внедрения упирались в догмы традиционного ведения хирургических пациентов относительно продолжительности послеоперационного голодания, сроков стояния зондов и дренажей, необходимости длительного постельного режима и т. п. Проведенное исследование показывает, что даже у больных ПСВ с присущим им комплексом сопутствующих проблем, отягощенных злокачественным заболеванием, применение оптимизированного алгоритма ускоренного восстановления на всех этапах периоперационного периода приводит к более быстрому восстановлению, снижению частоты тяжелых осложнений, уменьшению количества применяемых опиоидных анальгетиков, сокращению времени стояния дренажей и катетеров и длительности пребывания в отделении интенсивной терапии и в стационаре, а также к повышению качества жизни, что совпадает с литературными данными по использованию протокола ERAS при плановых хирургических вмешательствах[14, 16, 29, 30, 32, 46, 47].
ЗАКЛЮЧЕНИЕ
Полученные результаты позволяют утверждать, что опыт внедрения оптимизированного протокола ускоренного восстановления после хирургических операций Fast Track (ERAS) у больных колоректальным раком старших возрастных групп приводит к уменьшению койко-дня, снижению вариабельности исходов и частоты осложнений, минимизации летальности и к улучшению непосредственных и отдаленных результатов лечения, а также качества жизни. Несомненна необходимость в продолжении исследований для накопления доказательной базы, адаптации протокола к российским реалиям и стандартизации с утверждением в виде клинических рекомендаций.








