Во всем мире, в том числе в нашей стране, активно развивается мультимодальная концепция периоперационного сопровождения пациентов Fast Track, направленная на улучшение результатов лечения, сокращение количества осложнений и сроков пребывания в стационаре [15]. Комплекс лечебных задач обширен и осуществляется на всех периоперационных этапах [1]. Одним из значимых компонентов концепции Fast Track является оптимизация анестезиологического обеспечения, что подразумевает не только широкое использование регионарных методов анестезии и современных короткодействующих анестетиков, но и оптимизацию инфузионной терапии. Вопрос инфузионной поддержки особенно актуален при обширных и длительных оперативных вмешательствах. Неадекватная инфузионная терапия может приводить к гиповолемии и, следовательно, к гипоперфузии и ишемии органов и тканей, способствуя развитию органной дисфункции. Одним из первых в условиях гиповолемии начинает страдать ЖКТ, так как слизистая оболочка стенки кишки постоянно регенерирует, имеет высокую степень метаболической активности и крайне чувствительна к ишемии. При этом для нарушения спланхнической перфузии достаточно всего 10–15%-го снижения внутрисосудистого объема [13]. Ситуацию усугубляет селективная вазоконстрикция мезентериальных артериол, являющаяся одним из основных механизмов поддержания системного АД в условиях гиповолемии [26]. Помимо нарушения барьерной функции, слизистая оболочка стенки кишки в условиях ишемии активно синтезирует острофазовые белки, цитокины и гормоны, способствующие развитию синдрома системной воспалительной реакции (ССВР), синдрома полиорганной недостаточности и других тяжелых осложнений [10, 18, 23, 25]. При этом широко распространенное в клинической практике «решение» проблемы гиповолемии — увеличение объема инфузионной терапии во время оперативного вмешательства — не только не снимает проблему, но и создает дополнительный риск.
Во-первых, рутинные параметры гемодинамики — АД, ЧСС, центральное венозное давление — являются интегративными и зависят не от одного лишь объема циркулирующей крови (ОЦК). Данные показатели даже при серьезном дефиците ОЦК в 25–30% могут оставаться в пределах нормальных значений, что не позволяет использовать их в качестве критериев эффективного управления инфузионной терапией [2, 12].
Во-вторых, увеличение объема инфузии вовсе не означает ответного увеличения работы сердца: эмпирическая инфузионная нагрузка приводит к росту сердечного выброса лишь в половине случаев (как у больных в критических состояниях, так и у относительно «здоровых» плановых хирургических пациентов) [17, 24].
В-третьих, последствия немотивированной высокообъемной инфузии не менее опасны, чем гиповолемия. На локальном уровне содержание жидкости в тканях хирургически поврежденной стенки кишки увеличивается на 10%, и даже минимальные объемы инфузии (5 мл/кг) могут удваивать отек [8]. Как и при ишемии, это ведет к нарушению барьерной функции стенки кишки и выделению медиаторов воспаления, способных инициировать ССВР. Чрезмерное увеличение ОЦК приводит к перерастяжению правого предсердия и высвобождению предсердного натрий-уретического пептида. Последний оказывает деструктивное воздействие на систему эндотелиального гликокаликса, разрушение которой ведет к перемещению жидкости и крупных молекул в интерстиций, в том числе уже скомпрометированного ЖКТ, повышая риск развития ССВР [3, 7]. Если при гиповолемии можно увеличить ОЦК в течение нескольких минут, то элиминация избытка жидкости из интерстиция происходит крайне медленно: в зависимости от соматического состояния пациента и объема хирургического вмешательства она может длиться до нескольких суток.
Инфузионная терапия в периоперационном периоде изучена довольно тщательно, но остаются вопросы, нуждающиеся в уточнении. В отношении качественного состава все более или менее ясно: сбалансированные кристаллоидные растворы удовлетворяют базисную потребность в жидкости, в то время как коллоиды способствуют восполнению внутрисосудистого объема. Но, несмотря на утилитарное удобство этой концепции, мы по-прежнему не знаем «идеального объема» переливаемой жидкости, в медицинском сообществе продолжаются дискуссии по данному вопросу и представляются различные точки зрения [6, 11, 14, 19]. Тем не менее за последние годы сформирована трендовая концепция «базисной» инфузионной терапии: при обширных и длительных хирургических вмешательствах объемы инфузии должны быть минимальными и покрывать базисные потребности с учетом видимых и перспирационных потерь [9]. Базисная потребность пациента в жидкости равна 1–1,5 мл/кг/ч, перспирационные потери составляют еще около 1,5 мл/кг/ч [16]. Таким образом, «базисный» темп инфузии, приблизительно равный 3 мл/кг/ч, теоретически покрывает потребности в жидкости у любого хирургического пациента без риска развития гипер- или гиповолемии. Однако есть ряд факторов риска развития гиповолемии, которые трудно учитывать, например исходное состояние пациента, особенности патофизиологии основного заболевания, аспекты предоперационной подготовки.
На практике реализуется далеко не полный список штатных мероприятий концепции Fast Track. В частности, пункты, касающиеся предоперационного голодания и подготовки ЖКТ, в нашей стране пока не являются ни общепринятыми, ни даже общепризнанными, и это не позволяет говорить об «идеальном» предоперационном волемическом статусе у ряда пациентов. Значимое влияние на внутрисосудистый сектор независимо от исходного состояния пациента оказывает также общая и регионарная анестезия. При этом инфузионная терапия остается главным инструментом поддержания функции системы транспорта кислорода, обеспечивающей адекватный уровень тканевого дыхания. Отсутствие корреляции между ОЦК и рутинными параметрами гемодинамики делает стратегически важным поиск надежных, оперативных и простых в применении параметров гемодинамического мониторинга, позволяющих определить тактику инфузионной терапии и оценить ее адекватность.
В качестве мониторных показателей наиболее перспективны такие функциональные параметры гемодинамики, как вариабельность ударного объема (ВУО) и пульсового давления (ВПД), которые успешно применяются в протоколах целенаправленной терапии (ЦНТ) и доказали свою эффективность в большой абдоминальной хирургии [4, 20–22]. Возможность контроля ВУО и ВПД реализована во многих системах инвазивного и минимально инвазивного гемодинамического мониторинга (PiCCO, Vigileo, PulsioFlex, LiDCOrapid), что позволяет не только оценивать состояние внутрисосудистого сектора, но и прогнозировать повышение сердечного выброса в ответ на инфузионную нагрузку у пациентов в условиях ИВЛ [5].
Целью исследования, проведенного авторами статьи на базе ФГБУ «Клиническая больница» Управления делами Президента РФ, было изучение влияния интраоперационной ЦНТ, управляемой на основании мониторинга ВУО, на послеоперационные результаты больших хирургических вмешательств на органах ЖКТ.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное исследование вошли 64 пациента, которые были госпитализированы для планового оперативного вмешательства предполагаемой длительностью не менее 3 часов на органах брюшной полости с нарушением целостности тонкой или толстой кишки и формированием межкишечного анастомоза. Состояние больных соответствовало 2–3-му классам по шкале ASA. Оперативное вмешательство проводили в условиях сочетанной (эндотрахеальной и эпидуральной) анестезии. Индукцию анестезии осуществляли пропофолом (1,5–2,0 мг/кг) и фентанилом (2 мкг/кг). Для миорелаксации назначали рокурония бромид под контролем нейромышечной проводимости (TOF-Watch). Поддерживали анестезию севофлураном (МАК 0,7–1,0) под контролем мониторинга глубины анестезии (BIS в пределах 40–60) и эпидуральной анальгезией ропивакаином 0,2% в сочетании с фентанилом. У всех пациентов выполняли мониторинг ЭКГ, температуры тела, данных пульсоксиметрии, капнографии. Пациенты были рандомизированы на две группы, сопоставимые по демографическим показателям (возраст, пол, ИМТ) и проявлениям сопутствующей патологии.
В первой группе (контроль, n = 32) инфузионную терапию проводили сбалансированными кристаллоидными растворами (раствор Рингера), темп инфузии поддерживали на уровне 4–5 мл/кг/ч. Увеличение темпа инфузии и показания для дополнительного болюсного введения растворов определяли на основании данных рутинного мониторинга гемодинамики (АД, ЧСС) и степени кровопотери с учетом интраоперационной ситуации. При снижении среднего АД (САД) ниже 60 мм рт. ст. и отсутствии эффекта от дополнительного болюсного введения жидкости до 5–10 мл/кг использовали введение вазопрессоров (эфедрин в дозе 0,1–0,2 мг/кг). Если гипотензию не удавалось скорригировать в течение 20–30 минут, переходили к продленной инфузии допамина с начальной дозировкой 10 мкг/кг/мин и последующим титрованием дозы для поддержания САД в пределах 70–90 мм рт. ст. ЧСС поддерживали на уровне не ниже 50 уд/мин, при уменьшении использовали атропин.
Во второй группе (группа ЦНТ, n = 32) базисную инфузионную терапию проводили в том же режиме, а дополнительное болюсное введение растворов и применение вазоактивных препаратов осуществляли строго на основании данных минимально инвазивного мониторинга гемодинамики (Vigileo; Edwards Lifesciences Corporation, США). Основной целью являлось поддержание ВУО менее 13% путем болюсной инфузионной нагрузки раствором Рингера (около 3–5 мл/кг), направленной на достижение сердечного индекса (СИ) не менее 2 л/мин/м2. При ВУО менее 13% и сохранявшемся СИ менее 2 л/мин/м2 использовали болюсное введение эфедрина в дозе 0,1–0,2 мг/кг. Если тактика была неэффективной в течение 20–30 минут, переходили к инфузии допамина с начальной скоростью 10 мкг/кг/мин и последующим титрованием дозы для поддержания САД в пределах 70–90 мм рт. ст., а СИ более 2,5 л/мин/м2. При ВУО более 13% и неэффективности двух попыток инфузионной нагрузки в сочетании с СИ менее 2 л/мин/м2 осуществляли введение эфедрина и допамина по вышеописанной схеме. ЧСС поддерживали способами, аналогичными тем, которые применялись в контрольной группе. Алгоритм ЦНТ представлен на рисунке.
Рис. Протокол интраоперационной целенаправленной терапии.
Примечание. ВУО — вариабельность ударного объема; САД — среднее артериальное давление; СИ — сердечный индекс
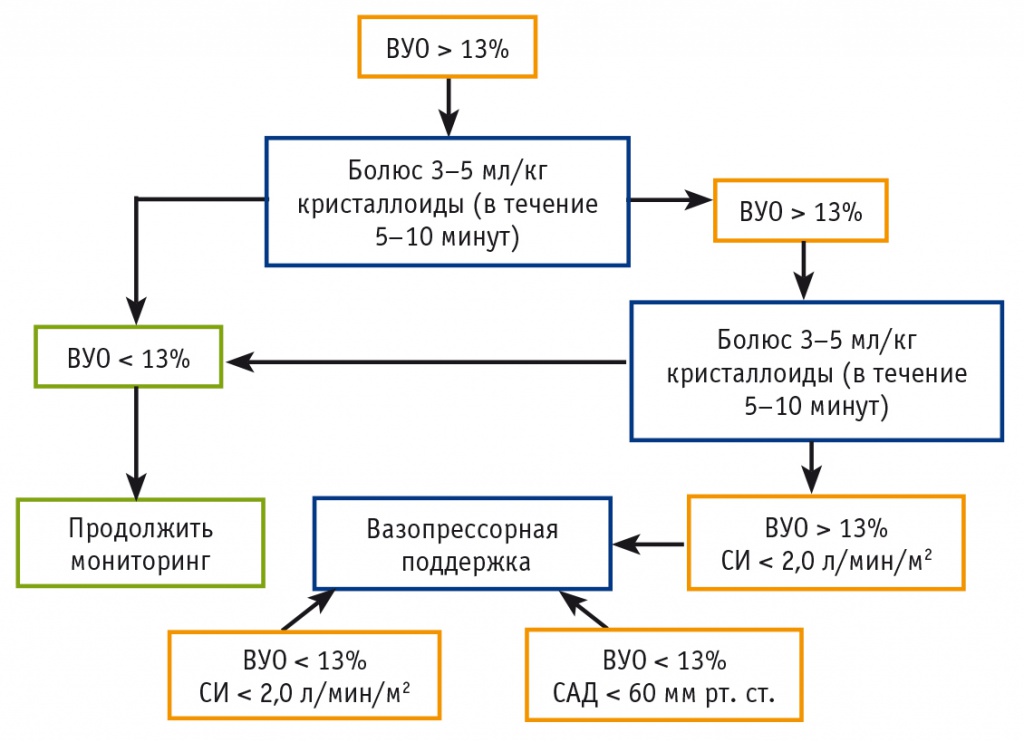
Дополнительно параметры гемодинамики фиксировали на шести этапах: I этап — перед индукцией анестезии; II — через 10 минут после индукции; III — через 1 час после начала операции; IV — после основного этапа операции (наложение межкишечного анастомоза); V — после ушивания брюшной полости; VI — после экстубации (при продленной ИВЛ — перед вывозом из операционной). На II и IV этапах оценивали адекватность тканевой оксигенации по уровню лактата артериальной крови. Всех пациентов наблюдали в условиях отделения анестезиологии и реанимации (ОАР). В течение первых суток послеоперационного периода им проводили базисную инфузионную терапию раствором Рингера из расчета 1,5–2 мл/кг/ч.
В качестве основного клинического исхода оценивали частоту мониторируемых осложнений в течение 28 дней после операции. В числе вторичных исходов определяли уровень лактата артериальной крови после основного этапа операции, степень проявления органной дисфункции на следующие сутки после оперативного вмешательства, длительность пребывания в ОАР и стационаре, сроки восстановления функций ЖКТ.
Для статистического анализа данных использовали пакеты программ Microsoft Excel 2013, MedCalc v. 11.5 и IBM SPSS Statistics v. 22. При анализе результатов исследования нормальность распределения оценивали с помощью теста Шапиро — Уилка. В зависимости от распределения данные представляли как среднее арифметическое (М) ± средне-квадратичное отклонение (σ) или в виде медианы (Ме) с 25-м и 75-м перцентилями. Значимость различий оценивали с помощью параметрических и непараметрических тестов: t-критерия Стьюдента или U-критерия Манна — Уитни в зависимости от типа распределения. Для анализа качественных признаков использовали тест χ2 и точный критерий Фишера. Результаты всех тестов считали статистически значимыми при р ˂ 0,05.
РЕЗУЛЬТАТЫ
Значимых различий между группами по продолжительности оперативного вмешательства (в группе ЦНТ 260 (225–360) минут, в контрольной группе 280 (210–435) минут; р ˃ 0,05) и объему кровопотери (в группе ЦНТ 100 (100–300) мл, в контрольной группе 125 (100–300) мл; р ˃ 0,05) не отмечено.
Параметры гемодинамики отражены в таблице 1. Статистически значимые различия в уровне САД наблюдались на III, IV и VI этапах операции — во всех случаях САД было выше в группе ЦНТ. По ЧСС группы не имели значимых различий ни на одном этапе оперативного вмешательства.
Таблица 1
Параметры гемодинамики на различных этапах оперативного вмешательства (М ± σ)
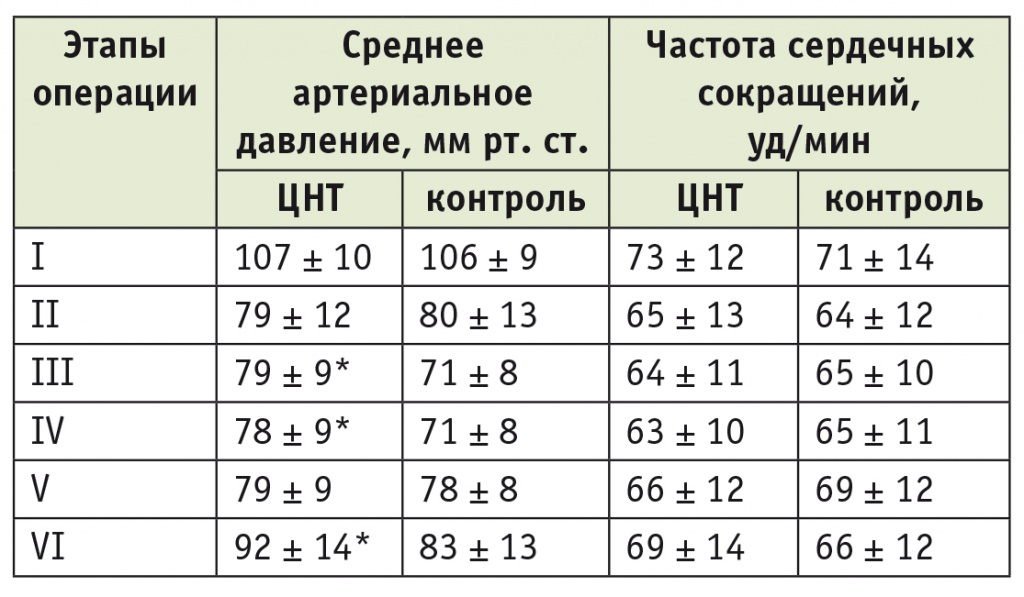
* Различие с контрольной группой статистически значимо: р ˂ 0,05.
Примечание. В таблицах 1–2 ЦНТ — группа целенаправленной терапии.
В группе ЦНТ количество пациентов с эпизодами гипотензии, т. е. с САД менее 60 мм рт. ст., нуждавшихся в болюсном введении вазопрессоров, составило 10 человек против 16 в контрольной группе, с учетом повторных эпизодов — 17 и 32 соответственно. Постоянная вазопрессорная поддержка потребовалась 2 пациентам в группе ЦНТ и 2 пациентам в контрольной группе.
Итоговый объем интраоперационной инфузии в группе ЦНТ был ниже, чем в контрольной группе, как в абсолютных значениях, так и в пересчете на массу тела и время: 2700 (2000–3500) мл против 3400 (2500–4600) мл (р ˂ 0,05) и 6,7 ± 0,8 мл/кг/ч против 8,8 ± 1,8 мл/кг/ч (р ˂ 0,001) соответственно. Темп диуреза в группах не имел значимых различий и составил 75 ± 20 мл/ч в группе ЦНТ и 72 ± 32 мл/ч в контрольной группе (р ˃ 0,05).
В группе ЦНТ болюсное введение жидкости для увеличения преднагрузки на основании мониторинга ВУО (ВУО > 13%) потребовалось 22 пациентам (68,8%), было отмечено 45 таких наблюдений, включая повторные. При этом только у 6 пациентов данные эпизоды сопровождались снижением САД ниже 60 мм рт. ст., у остальных 16 больных эпизоды гиповолемии отмечали при САД более 60 мм рт. ст.
Инфузионная терапия в первые сутки после оперативного вмешательства составила 1,6 ± 0,4 мл/кг/ч в группе ЦНТ против 1,6 ± 0,3 мл/кг/ч в контрольной группе (р ˃ 0,05).
Как отмечено выше, состояние тканевой перфузии и оксигенации оценивали по содержанию лактата артериальной крови на II и IV этапах оперативного вмешательства. Перед началом операции уровень лактата в группах достоверно не различался: 0,85 (0,7–0,9) ммоль/л в группе ЦНТ против 0,75 (0,6–0,9) ммоль/л в контрольной группе (р ˃ 0,05); после основного этапа операции различия по этому показателю достигли статистической значимости: 0,6 (0,6–0,8) и 0,9 (0,6–1,2) ммоль/л соответственно (р ˂ 0,05).
Значимых различий в сроках пребывания в ОАР и стационаре между группами не отмечено: средняя продолжительность нахождения в ОАР для группы ЦНТ составила 1 день (1–1) и для контрольной группы 1 день (1–2) (р ˃ 0,05); средняя длительность пребывания в стационаре в группе ЦНТ равнялась 11 (8–15) дням, а в контрольной группе 13 (9–16) дням (р ˃ 0,05).
На следующие сутки после оперативного вмешательства в группе ЦНТ пациентов с признаками органной дисфункции (≥ 1 баллу по шкале SOFA) было меньше, чем в контрольной группе: 12 против 20 (р ˂ 0,05).
Восстановление перистальтики в группе ЦНТ отмечалось через 16 (13–18) часов против 23 (18–38) часов в контрольной группе (р ˂ 0,001). Пациенты группы ЦНТ начинали самостоятельно принимать пищу на 3-и сутки послеоперационного периода, в среднем через 66 (44–90) часов после операции, а пациенты контрольной группы — на 5-е сутки, через 90 (68–134) часов (р ˂ 0,05).
В группе ЦНТ осложнения развились у 10 (31,2%) пациентов, в контрольной группе — у 19 (59,4%) (р ˂ 0,05). Таким образом, пациентов с осложнениями в группе ЦНТ было на 47,5% меньше (табл. 2). Несостоятельность межкишечного анастомоза имела место у 3 пациентов контрольной группы, и лишь один подобный случай был в группе ЦНТ. В релапаротомии или повторном хирургическом вмешательстве нуждались 1 и 4 пациента групп ЦНТ и контроля соответственно. В контрольной группе один пациент умер в результате прогрессирования синдрома полиорганной недостаточности, в группе ЦНТ летальных исходов не было.
Таблица 2
Виды осложнений, выявленных у обследованных пациентов
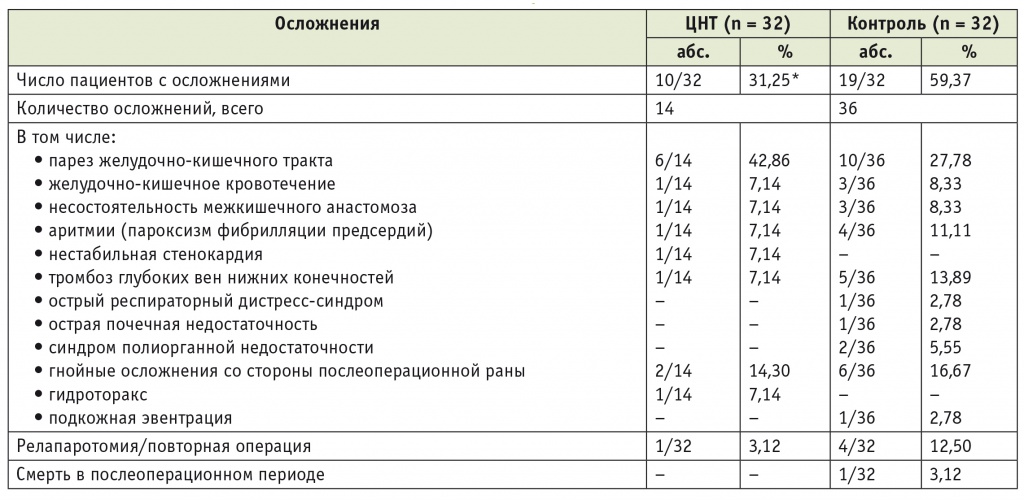
* Различия с контрольной группой статистически значимы: p < 0,05.
Примечание. Прочерки в таблице означают отсутствие осложнения.
В обеих группах превалировали осложнения со стороны ЖКТ (около 50%). При этом, как видно из таблицы 2, в контрольной группе они встречались в 2 раза чаще (16 осложнений у 14 пациентов), чем в группе ЦНТ (8 осложнений у 7 пациентов) (р ˂ 0,05).
В группе ЦНТ отмечена тенденция к уменьшению количества сердечно-сосудистых осложнений, инфекционных осложнений со стороны послеоперационной раны и частоты тромбоза глубоких вен нижних конечностей (см. табл. 2).
ОБСУЖДЕНИЕ
При больших абдоминальных операциях интраоперационная инфузионная ЦНТ с использованием в качестве ключевого параметра ВУО способствует уменьшению количества послеоперационных осложнений.
В обеих группах преобладали осложнения со стороны ЖКТ, что объяснялось непосредственным механическим воздействием на органы ЖКТ и высокой чувствительностью стенки кишки к ишемии. Органы спланхнической зоны также подвергались довольно длительным эпизодам ишемии при стабильных рутинных показателях гемодинамики (САД ˃ 60 мм рт. ст.). Такие «скрытые» эпизоды гиповолемии в группе ЦНТ наблюдались в 36 случаях у 16 пациентов, и, благодаря оперативному выявлению с помощью мониторинга ВУО, они были своевременно скорригированы инфузионной нагрузкой. Очевидно, что похожие эпизоды имели место и в контрольной группе, но там они не верифицировались ввиду отсутствия специфического мониторинга. Возникавшие при этом нарушения перфузии в слизистой оболочке ЖКТ послужили причиной увеличения количества послеоперационных осложнений и дисфункции органов ЖКТ.
В исследовании выявлена тенденция к снижению послеоперационных койко-дней в группе ЦНТ, но для ее подтверждения требуются бóльшие размеры выборки. Хотя продолжительность пребывания в стационаре является важным показателем качества медицинской помощи, не стоит забывать, что на нее могут влиять многие факторы, включая предоперационное физическое состояние пациента, социальные аспекты и особенности медицинского учреждения.
ЗАКЛЮЧЕНИЕ
Результаты представленного исследования позволяют заключить, что целенаправленная терапия (ЦНТ) на основе вариабельности ударного объема является достаточно тонким инструментом оптимизации инфузионной коррекции гиповолемии и дает возможность уменьшить количество осложнений после больших абдоминальных операций. Это определяет перспективы применения ЦНТ в клинической практике в целом и при реализации концепции Fast Track в частности.








