Инфекция области хирургического вмешательства (ИОХВ) является второй по частоте нозокомиальной инфекцией после пневмонии: ИОХВ развиваются у 2–5% пациентов после чистых операций вне органов брюшной полости и осложняют течение до 20% всех абдоминальных операций [9, 16]. По данным российского многоцентрового исследования ЭРГИНИ, ИОХВ составляют около 15% всех нозокомиальных инфекций, развивающихся в скоропомощных стационарах России [18]. Данные Центров по контролю и профилактике заболеваний США (англ. Centers for Disease Control and Prevention) свидетельствуют о выявлении около 500 тысяч случаев ИОХВ в год [16, 17]. Каждый случай инфекции требует существенных дополнительных затрат и увеличивает продолжительность лечения в среднем на 7 суток. Пациенты с инфекциями, возникшими после операций, проводят на 60% больше времени в ОРИТ, в 5 раз чаще требуют повторной госпитализации и имеют в 2 раза бóльшую летальность [7, 15].
Одним из компонентов высококачественной хирургической помощи и эффективным подходом к снижению частоты ИОХВ, наряду с совершенствованием хирургической техники и соблюдением правил асептики и антисептики, является периоперационная антибиотикопрофилактика. Обоснованием ее внедрения послужили данные, полученные во второй половине XX века: экспериментальные и клинические исследования убедительно показали, что антибиотикопрофилактика позволяет снизить частоту послеоперационных инфекционных осложнений с 20–40% до 1,5–5% [7, 11]. В настоящее время целесообразность профилактического применения антибиотиков при хирургических операциях не вызывает сомнения — в литературе дискутируются вопросы не о том, нужна ли она, а о том, какой антибиотик и в каком режиме следует применять в том или ином случае с точки зрения максимальной клинической эффективности и фармакоэкономической обоснованности [5].
Периоперационная антибиотикопрофилактика с целью снижения риска развития ИОХВ должна проводиться у всех пациентов, подлежащих аортокоронарному шунтированию, кардиохирургическим операциям, операциям на сосудах и органах брюшной полости, артропластике тазобедренного и коленного суставов, гистерэктомии. Эти оперативные вмешательства являются наиболее частыми, и у специалистов нет разногласий в отношении того, что при них необходимо применять периоперационную профилактику с помощью антибиотиков. Пациентам с подтвержденной инфекцией до оперативного лечения антибиотикопрофилактика не проводится, вместо нее выполняют антимикробную терапию.
Согласно определению Комитета по антимикробным препаратам Американского общества хирургических инфекций (Surgical Infection Society), профилактическим применением антибиотиков является их назначение больному до микробной контаминации операционной раны или развития раневой инфекции, а также при наличии признаков контаминации и инфекции, если первичным методом лечения является хирургическое вмешательство, а назначение антибиотика имеет своей целью снизить до минимума риск развития ИОХВ [13].
Другими словами, антибиотикопрофилактика, в отличие от антибиотикотерапии, подразумевает назначение антибактериального средства при отсутствии активного инфекционного процесса и высоком риске развития инфекции с целью его предупреждения. Исходя из определения понятия «антибиотикопрофилактика», можно сформулировать ее цель и задачу:
-
цель антибиотикопрофилактики — предупреждение развития ИОХВ в послеоперационном периоде и уменьшение стоимости и продолжительности лечения больных в стационаре;
-
задача антибиотикопрофилактики — создание терапевтических (бактерицидных) концентраций антибиотика в тканях, подвергающихся бактериальной контаминации во время операции — в период от разреза до закрытия раны.
В зависимости от риска развития ИОХВ выделяют четыре типа операций (табл. 1) [2, 5, 6]. При разных типах оперативных вмешательств риск развития ИОХВ составляет от < 5% до > 20% (табл. 2) [1, 6].
Таблица 1
Типы операций в зависимости от риска развития инфекции области хирургического вмешательства [2, 5, 6]

Таблица 2
Частота послеоперационных инфекционных осложнений в зависимости от типа оперативных вмешательств
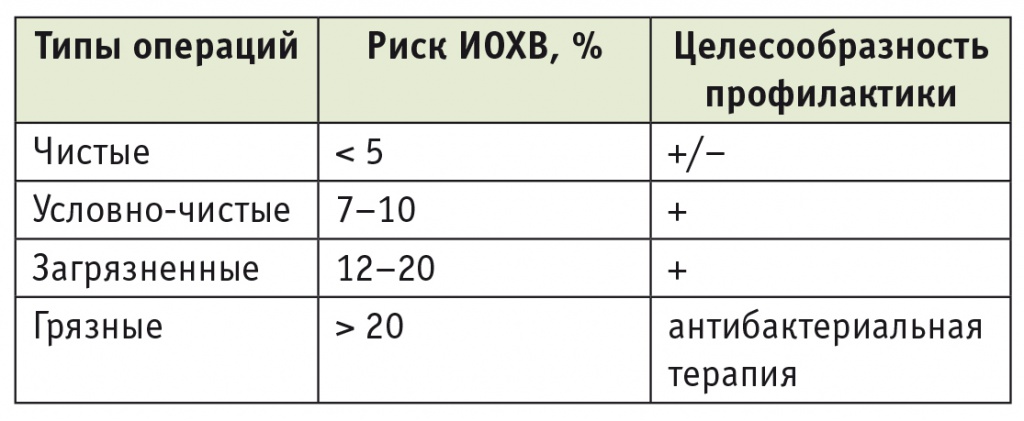
Примечание. ИОХВ — инфекция области хирургического вмешательства
Периоперационная антибиотикопрофилактика показана при всех условно-чистых и загрязненных операциях. При чистых оперативных вмешательствах она проводится в случаях, когда потенциальная инфекция представляет серьезную угрозу жизни и здоровью больного (протезирование клапанов сердца, аортокоронарное шунтирование, имплантация суставов), а также при наличии у больного факторов риска ИОХВ: сахарного диабета, ожирения или истощения, цирроза печени, алкоголизма, наркомании, хронической почечной недостаточности (ХПН), иммуносупрессии (терапия глюкокортикоидами, цитостатиками, ВИЧ), спленэктомии.
Следует учитывать, что микробная контаминация операционной раны неизбежна даже при идеальном соблюдении правил асептики и антисептики и к концу операции в 80–90% случаев раны бывают обсеменены различной микрофлорой, чаще всего стафилококками. Как показано в классической работе J. F. Burke, если в течение первых трех часов после контаминации операционной раны уменьшить количество попавших в нее бактерий, то можно существенно снизить риск развития послеоперационной раневой инфекции [8]. Это достигается введением антибиотика за 30–60 минут до начала операции. Вводить антибиотик более чем за час до операции, а также интраоперационно или после окончания оперативного вмешательства неэффективно в плане снижения частоты ИОХВ.
При осуществлении периоперационной антибиотикопрофилактики необходимо стремиться не к полной эрадикации микроорганизмов из операционной раны, а к снижению их количества до того уровня, при котором иммунная система в состоянии защитить макроорганизм от развития инфекции.
Эффективная концентрация антибиотика в операционной ране, превышающая МПК для возбудителей раневой инфекции, должна сохраняться на протяжении всей операции, и особенно необходимо ее поддержание к моменту наложения швов, когда микробная контаминация достигает максимума.
В настоящее время большинство специалистов по антимикробной терапии и хирургическим инфекциям придерживаются сходных взглядов на тактику проведения периоперационной профилактики ИОХВ. Эта позиция подробно отражена в зарубежных и отечественных документах по периоперационной антибиотикопрофилактике [2, 3, 5, 6]. Обобщенные рекомендации по профилактическому применению антибиотиков у хирургических больных представлены в таблице 3 [2, 4].
Таблица 3
Режимы периоперационной антибиотикопрофилактики при хирургических операциях [2, 4]
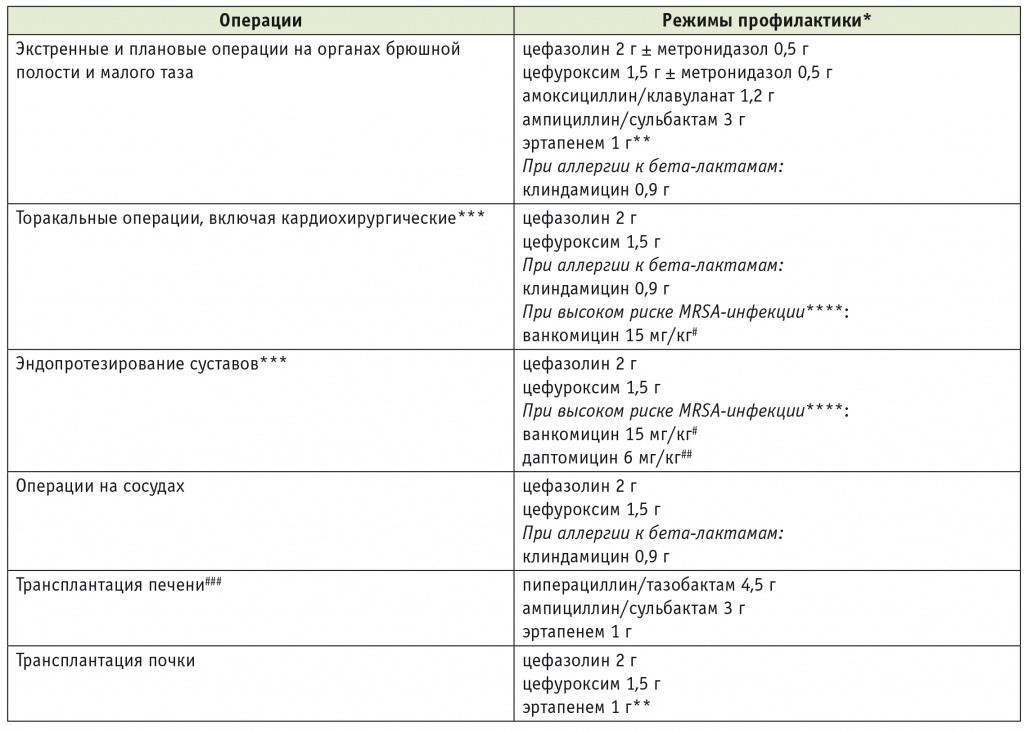
* Антибиотики с целью профилактики вводят внутривенно однократно за 30–60 минут до начала операции (ванкомицин — за 120 минут). В большинстве случаев достаточно одной предоперационной дозы препарата. При длительных операциях целесообразно интраоперационное введение дополнительной дозы антибиотика: цефазолина, цефуроксима, амоксициллина/клавуланата и клиндамицина — через 4 часа; ампициллина/сульбактама — через 2–3 часа. Продление антибиотикопрофилактики после окончания операции не увеличивает ее эффективность, но повышает риск селекции антибиотикорезистентных штаммов и осложнений, в частности антибиотикоассоциированной диареи, вызываемой Clostridium difficile.
** Эртапенем применяют при высоком риске осложнений и коморбидности (сахарный диабет, цирроз печени, ВИЧ и другой иммунодефицит, истощение), а также при риске колонизации антибиотикорезистентными микроорганизмами в результате предшествующего применения антибиотиков.
*** В случаях высокого риска осложнений допускается продление антибиотикопрофилактики на 24–72 часа в послеоперационном периоде, хотя существенной доказательной базы более высокой эффективности продленной профилактики не получено.
**** На высокий риск развития MRSA-инфекции указывают колонизация слизистой носа MRSA, предшествующее применение фторхинолонов, высокий уровень MRSA в отделении.
# Ванкомицин может применяться только в случаях крайней необходимости — при риске развития MRSA-инфекции и аллергии на бета-лактамные антибиотики.
## Даптомицин применяют при документированном высоком риске послеоперационной инфекции, вызываемой MRSA; следует учитывать действие этого антибиотика не только на планктонные, но и на сесильные (находящиеся в биопленках) формы стафилококков.
### Оптимальная продолжительность антибиотикопрофилактики при трансплантации органов не определена. Вероятно, продление профилактики на 3–5 дней в послеоперационном периоде допустимо. Более длительные сроки профилактики нерациональны из-за риска селекции резистентных бактерий и суперинфекции, вызываемой токсинпродуцирующими штаммами C. difficile.
Примечание. MRSA — Methicillin-resistant Staphylococcus aureus (S. aureus, резистентный к метициллину).
Следует выделить три основных условия эффективной периоперационной антибиотикопрофилактики ИОХВ:
1) своевременность введения антибиотика;
2) выбор оптимального антибиотика;
3) адекватная продолжительность периоперационной антибиотикопрофилактики.
1. Время введения антибиотика с целью профилактики инфекции области хирургического вмешательства
Антибактериальная профилактика является наиболее эффективной, когда антибиотики применяют внутривенно в период от 30 до 60 минут до разреза кожи (при использовании ванкомицина — за 2 часа до разреза). Это позволяет достичь бактерицидной концентрации препарата в тканях и в сыворотке крови в момент разреза кожи и снизить риск инфекции. В 70–80-е годы XX века было показано, что основной причиной неэффективности профилактики является введение антибиотика после операции; с другой стороны, риск инфекций возрастал, если антибиотики назначались слишком рано (более чем за 2 часа до разреза кожи) или слишком поздно (после проведения разреза) [8].
2. Выбор оптимального антибиотика для периоперационной профилактики
В спектр активности антибиотика для периоперационной профилактики должны входить наиболее актуальные возбудители ИОХВ. Перечень потенциальных возбудителей ИОХВ довольно широк, однако первичная роль в развитии раневой инфекции принадлежит микрофлоре кожи (стафилококки), которая первой контаминирует операционную рану.
Эспериментальные и клинические исследования показали, что основным условием эффективности антибиотика для интраоперационной профилактики является его высокая и быстрая бактерицидная активность против грамположительных микроорганизмов, прежде всего стафилококков. Этому требованию наиболее соответствуют бета-лактамные антибиотики, из которых оптимальными являются цефалоспорины I и II поколения — цефазолин и цефуроксим. Использование для профилактики цефалоспоринов с более широким спектром активности (цефалоспорины III поколения) не проводило к повышению эффекта профилактики (иногда частота инфекций даже возрастала), но существенно увеличивало риск селекции резистентных бактерий (прежде всего энтеробактерий, продуцирующих бета-лактамазы расширенного спектра, и Staphylococcus aureus, резистентного к метициллину, — MRSA), а также риск развития осложнения — суперинфекции, вызываемой Clostridium difficile [5, 11]. Таким образом, в настоящее время использование цефалоспоринов III поколения (цефтриаксон, цефотаксим) с целью профилактики ИОХВ считают нерациональным.
Рутинное применение ванкомицина с профилактической целью не рекомендуется ни при каком типе операций, однако рост инфекций, связанных с оказанием медицинской помощи, вызванных резистентными к оксациллину стафилококками и внебольничными MRSA, может быть обоснованием применения ванкомицина с учетом данных локального мониторинга микрофлоры. Кроме того, он может использоваться наравне с другими указанными препаратами при наличии документированной анафилаксии к бета-лактамам. Применение ванкомицина с профилактической целью обоснованно, например, в случаях известной колонизации пациента MRSA и риска развития MRSA-инфекций в результате предшествующей госпитализации, длительного контакта пациента с лицами, у которых имеется тяжелая хроническая патология, лечения хронических язв, проведения программного гемодиализа, продолжительной госпитализации пациента в отделении с высоким уровнем колонизации MRSA до проведения операции. При этом следует учитывать, что по природной антистафилококковой активности и бактерицидности ванкомицин существенно уступает бета-лактамным антибиотикам, т. е. он не может считаться оптимальным средством периоперационной профилактики.
Перспективным является применение даптомицина с целью периоперационной профилактики ИОХВ при эндопротезировании суставов. Преимущество даптомицина перед ванкомицином состоит в более высокой и быстрой бактерицидной активности в отношении стафилококков — как MRSA, так и чувствительных к оксациллину. Немаловажным фактором является также способность даптомицина воздействовать не только на планктонные, но и на сесильные (находящиеся в биопленках) формы стафилококков, что актуально при инфекциях имплантов.
При высоком риске контаминации раны анаэробными бактериями, особенно Bacteroides spp. (в абдоминальной хирургии, при операциях на органах малого таза), к цефалоспорину рекомендуется добавить метронидазол или использовать ингибиторозащищенные пенициллины, обладающие более широким антимикробным спектром и антианаэробной активностью: амоксициллин/клавуланат или ампициллин/сульбактам (последний характеризуется более коротким периодом полувыведения, поэтому при операции, продолжающейся более двух часов, необходимо его интраоперационное введение). В отсутствие риска анаэробных инфекций более адекватными для профилактики считают цефалоспорины I и II поколений, обладающие большей антистафилококковой активностью.
При проведении антибиотикопрофилактики в колоректальной хирургии у пациентов с высоким риском послеоперационных инфекционных осложнений (медикаментозная иммуносупрессия, рак толстой кишки, ВИЧ, хроническая алкогольная поливисцеропатия, цирроз печени, ХПН, сахарный диабет, истощение) в развитии ИОХВ, наряду со стафилококками и анаэробами, участвуют грамотрицательные энтеробактерии. В связи с этим расширение спектра антибиотика для интраоперационной профилактики становится оправданным. В таких ситуациях для профилактики рекомендуется использовать карбапенемовый антибиотик эртапенем, который в 2007 г. был одобрен Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США (Food and Drug Administration) по этим показаниям. Это было сделано после публикации результатов сравнительного применения эртапенема и цефотетана для профилактики раневой хирургической инфекции при колоректальных операциях: при использовании эртапенема количество инфекций было достоверно ниже на 10%, при этом не обнаружено возрастания количества инфекций, вызванных C. difficile. В качестве еще одного показания для использования эртапенема с целью периоперационной антибиотикопрофилактики может рассматриваться ситуация с высоким риском развития послеоперационных инфекций, вызванных полирезистентными энтеробактериями, прежде всего у пациентов, получавших в ближайшее время антибиотики с лечебной или профилактической целью.
При аллергии на бета-лактамы целесообразно использовать линкозамиды — линкомицин или клиндамицин. Последний антибиотик является оптимальным ввиду его более высокой антистафилококковой активности.
Аминогликозиды не имеют обоснованного применения при интраоперационной профилактике из-за риска нейромышечной блокады в сочетании с миорелаксантами; кроме того, их природная антистафилококковая активность уступает активности бета-лактамов и линкозамидов. Применение фторхинолонов при периоперационной профилактике практически не изучено, и их не рекомендуют использовать с этой целью, за исключением случаев проведения урологических операций. Кроме того, следует учитывать низкую природную антистафилококковую активность ципрофлоксацина и офлоксацина.
3. Продолжительность периоперационной антибиотикопрофилактики
Продолжительность профилактического применения антибиотиков играет важную роль не только в собственно профилактике инфекций, но и в снижении риска селекции резистентной флоры. Иногда во время длительных (более 4 часов) операций или при большой (> 1500 мл) кровопотере может возникнуть необходимость в их повторном введении. Однако последующие введения антибиотиков (продолжение профилактики после ушивания операционной раны) не обладают доказанной эффективностью. Во многих исследованиях показано, что короткий курс профилактики, который начинается незадолго до разреза кожи, так же эффективен, как продолжительный курс (в течение 24 часов и более) [11, 12, 14]. Кроме того, продолжительное введение антибактериального препарата может приводить к развитию суперинфекции C. difficile и способствовать селекции антибиотикорезистентных штаммов бактерий, что доказано в нескольких исследованиях [10, 12].
Идеальна одна предоперационная доза антибиотика. Максимальная продолжительность профилактики не должна превышать 24 часов после окончания операции. Большинством экспертов одобрено прекращение профилактики в течение 24 часов, при этом достигнуто согласие по безопасности и более высокой эффективности применения препаратов узкого спектра, направленных против наиболее вероятных возбудителей раневой инфекции (стафилококки и стрептококки). Превалирует мнение, что профилактику необходимо проводить только во время операции, вводя дополнительную дозу антибиотика при длительных вмешательствах. Наличие дренажей в полостях или катетеров не является обоснованным аргументом в пользу продолжения антибиотикопрофилактики [2, 6].
Продление профилактики на 24–72 часа возможно при очень высоком риске инфекционных осложнений либо в ситуациях, когда инфекции представляют непосредственную угрозу жизни и здоровью больного (кардиохирургические операции, трансплантация органов) или их лечение будет сопровождаться существенными финансовыми затратами (эндопротезирование суставов).
Оценка эффективности периоперационной антибиотикопрофилактики
Интраоперационную антибиотикопрофилактику хирургической инфекции считают неэффективной в случаях:
-
возникновения ИОХВ, а также абсцессов в зоне первичного операционного разреза и/или в брюшной полости (в том числе перитонита);
-
не находящего объяснения использования антибиотиков в течение 4 недель после первичной операции (если после операции в истории болезни пациента отсутствует диагноз инфекции, но ему назначают антибиотик, то это назначение расценивается как лечение раневой инфекции, скрытой врачами);
-
необходимости в дренировании операционной зоны, расхождения швов или разведения краев операционной раны через 48 часов и позже после операции.
Инфекцию в отдаленных от зоны операции областях (например, инфекцию мочевыводящих путей, пневмонию, синусит, инфицирование внутрисосудистых катетеров) не рассматривают как критерий неэффективности периоперационной антибиотикопрофилактики.
Профилактическое применение антибиотиков не заменяет общепринятых санитарно-гигиенических мероприятий, направленных на снижение риска инфекционных осложнений, методов асептики и антисептики. Антибиотикопрофилактика не может компенсировать недостаточный опыт и технические ошибки хирурга, нарушения санитарно-эпидемиологического и температурного режима в операционной, обширную кровопотерю и угнетение иммунитета. Периоперационная антибиотикопрофилактика не способна также предотвратить развитие таких актуальных нозокомиальных инфекций, как пневмония, инфекция мочевыводящих путей, катетерассоциированные инфекции.
ЗАКЛЮЧЕНИЕ
Адекватно проведенная периоперационная антибиотикопрофилактика является важным компонентом концепции Fast Track, так как она способствует снижению частоты осложнений, сокращению потребления медикаментов и в конечном счете — уменьшению длительности пребывания больного в отделении интенсивной терапии и в стационаре в целом.








