В 2017 г. в журнале International Journal of Reproductive Medicine опубликована статья «Выводы и рекомендации группы экспертов Индии по контролируемой стимуляции яичников в рамках вспомогательных репродуктивных технологий» [2]. С целью улучшения результатов ЭКО эксперты попытались ответить на ряд вопросов, в том числе решить, какое оптимальное количество ооцитов необходимо получить, чтобы добиться наибольшей результативности используемых программ. Установлено, что существует тесная связь между количеством полученных ооцитов и частотой живорождений: в ходе контролируемой стимуляции яичников должны быть получены 10–15 ооцитов, однако авторы подчеркивают, что чем больше число полученных ооцитов, тем выше вероятность развития синдрома гиперстимуляции яичников (СГЯ).
У женщин с хронической ановуляцией Группы II по ВОЗ выбор исходной дозы рекомбинантного ФСГ и модальности последующих корректировок дозы являются критическими для контроля риска чрезмерной стимуляции [3]. Для пациенток с СПКЯ особенно актуально применение стратегии контролируемой стимуляции овуляции низкими дозами рекомбинантного ФСГ, поскольку это позволит снизить вероятность развития такого грозного осложнения, как гиперстимуляция [4].
Цель исследования: сравнить результативность традиционного и низкодозированного протоколов контролируемой стимуляции суперовуляции в преодолении ановуляторного бесплодия с использованием программ ЭКО у женщин с хронической ановуляцией (ВОЗ — Группа II).
Материалы и методы
Исследование было проведено на базе ООО «Клиника ЗДОРОВЬЯ», г. Москвы (главный врач — к. м. н. Гнетецкая В. А.) в 2014–2016 гг. в рамках научного направления кафедры акушерства и гинекологии с курсом перинатологии медицинского факультета Медицинского института Российского университета дружбы народов «Репродуктивное здоровье населения Московского мегаполиса и пути его улучшения в современных экологических и социальноэкономических условиях», номер государственной регистрации — 01.9.70 007346, шифр темы — 317712 (заведующий кафедрой — заслуженный деятель науки РФ, членкорр. РАН, профессор Радзинский В. Е.).
В исследование были включены 57 женщин в возрасте 23–35 лет с хронической ановуляцией (ВОЗ — Группа II) [1], которые получали лечение женского бесплодия в программах ЭКО. Все пациентки были стратифицированы на две группы в зависимости от дозы используемого гонадотропина в рамках контролируемой стимуляции суперовуляции. Участницам первой группы (n = 32) проводили стимуляцию гонадотропинами в суммарной дозе 1000–1250 Ед на цикл, женщинам второй группы (n = 25) — в суммарной дозе 300–525 Ед на цикл. Во всех случаях использовали монотерапию рекомбинантным ФСГ.
Всем пациенткам производили динамическое УЗИ в реальном времени на ультразвуковом аппарате Аcuson Х150 (Siemens Medison, Германия) с использованием абдоминального датчика частотой 3,5 МГц и вагинального датчика частотой 6,5 МГц. Проводили ультразвуковой мониторинг числа и размера фолликулов, а также толщины эндометрия во всех стимулированных циклах.
Предиктором состояния фолликулярного резерва считали количество антральных фолликулов до 10 мм в диаметре, определяемых по УЗИ на 2–3й день менструального цикла. У всех участниц исследования было подтверждено наличие мультифолликулярных яичников (более 10 фолликулов в одном скане в каждом яичнике).
Содержание гормонов в сыворотке крови определяли иммуноферментным методом. Исследовали пролактин, ЛГ, ФСГ, антимюллеров гормон (АМГ), свободный тироксин, тиреотропный гормон, эстрадиол, прогестерон, общий тестостерон. За норму считали показатели здоровых женщин репродуктивного возраста с регулярным ритмом менструаций. Состояние гипоталамогипофизарнояичниковой системы оценивали в раннюю фолликулиновую фазу менструального цикла.
Результаты спермограммы определяли в соответствии с рекомендациями ВОЗ по лабораторному исследованию спермы человека (2010) [5], у всех пациенток супруг был фертилен.
Стимуляцию проводили гонадотропными препаратами. Дозы препаратов и схемы подбирали индивидуально с учетом уровней ЛГ, ФСГ, а также параметров ультразвукового мониторинга роста фолликулов и толщины эндометрия. Использовали протокол стимуляции суперовуляции, представленный на рисунке.
Рис. «Короткий» протокол стимуляции суперовуляции
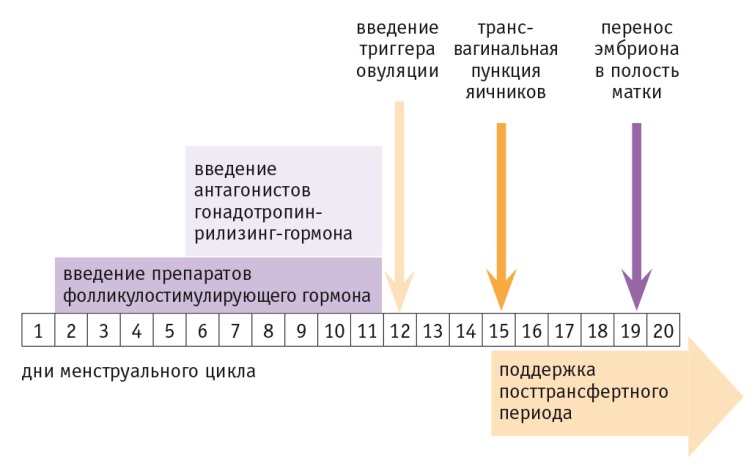
Стимуляцию суперовуляции проводили по «короткому» протоколу: со 2–3го дня менструального цикла вводили гонадотропные препараты, по достижении диаметра лидирующего фолликула ≥ 16 мм (6–7й день стимуляции) всем пациенткам назначали антагонисты ГнРГ.
Пункцию фолликулов производили через 35–36 часов после введения триггера овуляции. Пунктировали и аспирировали все фолликулы диаметром более 16 мм.
Сперму получали путем мастурбации сразу же после успешно выполненной пункции. По стандартному протоколу проводили осеменение ооцитов in vitro. Через 16–20 часов после осеменения ооциты подвергали визуальному контролю под бинокулярной лупой (40–75кратное увеличение) и/или на инвертированном микроскопе при 200кратном увеличении.
Зиготы, имевшие признаки патологии оплодотворения (три и более пронуклеусов, грубая зернистость или лизис цитоплазмы, вакуолизация), в дальнейшей работе не использовали и уничтожали. Отобранные нормальные зиготы переносили в лунку (или микрокапли) со свежей питательной средой и культивировали в течение 30 и более часов (стадии 8 бластомеров, морула, бластоциста) до момента переноса в полость матки. Контроль характера дробления предимплантационных эмбрионов осуществляли дважды в течение рабочего дня. Эмбрионы с согласия женщины подвергали криоконсервации и хранили в жидком азоте. Время переноса эмбрионов определял гинеколог (лечащий врач) совместно с эмбриологом и пациенткой.
Отбираемые для переноса эмбрионы оценивали, исходя из критериев 6балльной шкалы оценки ЭКО. Эмбрионы с оценкой 1 и 2 не подлежали переносу в матку женщины.
Перенос эмбрионов осуществляли при помощи катетера COOK (CooK, Австралия). После переноса эмбрионов и извлечения катетера последний просматривали под микроскопом для исключения возможности их оставления в нем. В 100% наблюдений переносили в полость матки один эмбрион. Все процедуры проводили в амбулаторных условиях.
Всем пациенткам дополнительно назначали микронизированный прогестерон интравагинально в дозе до 600 мг/сут. В случаях СГЯ перенос эмбрионов в полость матки не производили. Полученные эмбрионы подвергали витрификации с последующим их переносом в рамках криопротокола. При задержке развития эндометрия со дня пункции фолликула назначали эстрадиола валерат в дозе 2–4 мг/сут до момента диагностики беременности и далее в зависимости от ее течения до 5–6й недели гестации. С целью диагностики беременности определяли βсубъединицу ХГЧ в сыворотке крови (количественный анализ). Для подтверждения факта наступившей маточной беременности и установления локализации имплантировавшегося эмбриона проводили УЗИ органов малого таза трансвагинальным доступом.
После подтверждения наступления беременности пациенток вели в соответствии с общепринятыми нормативными документами (Приказ Минздрава России от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)» [6].
Статистическую обработку массива полученных данных проводили с помощью пакета прикладных программ Statistica 6.0 компании Stat Soft Inc. (США). Достоверность различий между сравниваемыми показателями оценивали методами вариационной статистики с использованием критериев Стьюдента (t) и χ² или непараметрического критерия Вилкоксона — Манна — Уитни для несвязанных совокупностей. Различия признавали статистически значимыми при р < 0,05 (t > 2,0).
Результаты
Проведенный анализ показал, что средний возраст пациенток сравниваемых групп достоверно не различался, в первой группе он составил 31,7 ± 2,5 года, во второй — 30,9 ± 3,1 года (р > 0,05).
Основной жалобой всех пациенток было бесплодие (100%). Первичным бесплодием страдали 75,4% женщин, вторичным — 24,6%, без различия между группами (р > 0,05). Длительность бесплодия у участниц варьировала от 1 года до 7 лет и составила в среднем 4,17 ± 2,0 года.
Изучение репродуктивного анамнеза у пациенток, страдающих вторичным бесплодием, показало, что в среднем на одну женщину приходилось 1,07 ± 0,06 беременности. Из них лишь 35,7% завершились родами. В первой группе у двух пациенток имелись указания на оперативные вмешательства (тубэктомию) по поводу трубной беременности. У каждой второй женщины с вторичным бесплодием был в анамнезе артифициальный аборт. Большинству (71,4%) первый аборт сделали до брака (р < 0,05).
В целом, у пациенток с вторичным трубноперитонеальным бесплодием исходы ранее наступавших беременностей выглядели следующим образом: артифициальный аборт — 53,1%, эктопическая беременность — 38,7%, роды — 32,6%. Значимых межгрупповых различий не выявлено (р > 0,05).
При исследовании основных маркеров состояния фолликулярного аппарата у женщин с хронической ановуляцией средний уровень ФСГ составил 2,8 ± 1,4 МЕд/мл, средний уровень ЛГ — 6,1 ± 2,0 МЕд/мл. Содержание АМГ оказалось на верхней границе или достоверно выше допустимых значений и составило в среднем 8,0 ± 4,9 нг/мл. Уровни АМГ и ФСГ свидетельствуют о мультифолликулярном состоянии яичников в обеих изучаемых группах, что не противоречит существующим представлениям для пациенток с СПКЯ [7, 8].
В первой группе стимуляция гонадотропинами в суммарной дозе 1000–1250 Ед на цикл позволила получить от 11 до 21 ооцитов. Соотношение «зрелые/незрелые» составило 6,5 : 3,5. В ходе культивирования отобранных нормальных зигот было получено в среднем 5–7 бластоцист. Во второй группе, в которой стимуляцию гонадотропинами проводили в суммарной дозе 300–525 Ед на цикл, получили 2–5 ооцитов, соотношение «зрелые/незрелые» составило 9 : 1. Количество полученных бластоцист — от 2 до 5.
В обеих группах оба протокола показали одинаковую скорость роста фолликулов. Аспирацию фолликулов в обеих группах производили при достижении размеров средних или зрелых фолликулов ≥ 16 мм.
Уровни эстрадиола сыворотки не были эквивалентны в двух группах во время введения триггера овуляции. Триггер подбирали индивидуально (841 ± 360 пг/мл против 425 ± 480 пг/мл в низкодозированном гонадотропиновом протоколе).
Анализ показателей фолликулогенеза и раннего эмбриогенеза (табл. 1) показал, что количество аспирированных фолликулов в группах достоверно отличалось.
Таблица 1
Показатели фолликулогенеза и раннего эмбриогенеза, М ± m

* Р < 0,05.
Как видно из таблицы 1, среднее число ооцитов, полученных при аспирировании фолликулов, в первой группе было в 6,3 раза больше. Абсолютное число зрелых ооцитов у участниц первой группы также оказалось больше (р < 0,05), однако почти каждый третий (31%) ооцит был незрелым, то есть непригодным к осеменению. В то же время в низкодозированных гонадотропиновых протоколах количество незрелых ооцитов было на 10% меньше по сравнению с таковым в общепринятых протоколах (р < 0,05).
Как видно из данных, представленных в таблице 1, бластоцист было достоверно больше в первой группе. Однако в низкодозированных гонадотропиновых протоколах перенос эмбриона был осуществлен в 100% наблюдений в рамках текущего лечебного цикла, в то время как в обычных гонадотропиновых протоколах перенос эмбриона у 68,75% женщин пришлось отменить в пользу криопротокола в связи с высоким риском развития СГЯ.
Частота зафиксированных биохимических беременностей в исследуемой группе в целом составила 42,1%, частота клинически подтвержденных — 31,6% (табл. 2).
Таблица 2
Частота наступления беременности на цикл
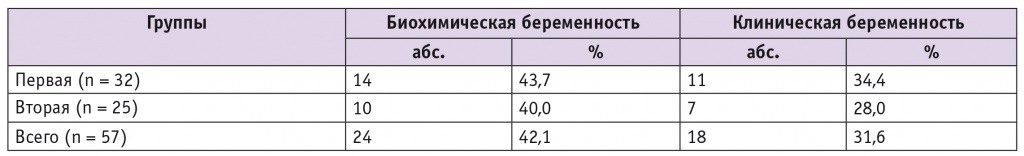
При по частоте как биохимических, так и клинических беременностей значимых различий между группами выявлено не было (р > 0,05). В то же время в первой группе у 9,4% пациенток имел место СГЯ легкой степени, в то время как во второй группе данное осложнение не диагностировали вовсе.
Заключение
Проведенное исследование показало, что использование рассчитанной стратегии стимуляции гонадотропинами в низких дозах у пациенток с хронической ановуляцией (ВОЗ — Группа II) не только не снижает частоту наступления клинических беременностей, но и не имеет достоверных отличий от общепринятых протоколов по результативности. Низкодозированные протоколы, снижая суммарное количество применяемых гонадотропинов в цикле при контролируемой стимуляции суперовуляции в протоколах ЭКО и способствуя повышению частоты получения зрелых ооцитов (90% против 65%, p < 0,05), закономерно уменьшают затратность программ ЭКО. Ввиду отсутствия необходимости использования криопротоколов на фоне низкого риска синдрома гиперстимуляции яичников их применение снижает общее время достижения результата.








