ВВЕДЕНИЕ
Сахарный диабет 2 типа (СД2) — хроническое прогрессирующее заболевание, характеризуется нарушением практически всех видов обмена и все чаще обозначается как метаболическое заболевание. Более 80% пациентов с СД2 имеют либо избыточную массу тела (МТ), либо ожирение, что увеличивает риск летальности более чем в 7 раз[1, 2]. В последние 100 лет при формировании целей лечения СД2 обращают внимание на достижение гликемического контроля. Однако, несмотря на колоссальные усилия, включающие персонифицированный подход к терапии, совершенствование технологий по управлению СД2, образовательные программы, даже в случае достижения контроля гликемии смертность продолжала увеличиваться1. Согласно данным Международной диабетической федерации в 2021 г. летальность по причине СД составила 6,7 млн человек, что в большей степени связывают с пандемией коронавирусной инфекции, а также с развитием у пациентов кардиоваскулярных и цереброваскулярных осложнений2.
Парадигма лечения СД2 изменилась, когда в 2015 г. произошло важное событие — озвучены революционные результаты исследования EMPA-REG OUTCOME, которые показали снижение по сравнению с плацебо смертности от сердечно-сосудистых заболеваний на 38% (р < 0,001), первичной комбинирированной конечной точки (смерть от сердечно-сосудистых причин, случаи нефатальных инфарктов миокарда и мозговых инсультов) на 14% (р = 0,04), общей смертности на 32% (р < 0,001), количества госпитализаций по поводу хронической сердечной недостаточности на 35% (р < 0,002) при использовании стандартной сахароснижающей терапии (эмпаглифлозина) и относительно незначительном снижении уровня гликированного гемоглобина (HbA1c)[3].
Начиная с 2015 г. стало очевидно, что препараты класса ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ2) действительно могут повлиять на показатели смертности. В частности, по результатам исследований CANVAS и CANVAS-R получено снижение риска MACE (3 основных нежелательных сердечно-сосудистых явления – нефатальный инфаркт миокарда, нефатальный инсульт и сердечно-сосудистая смерть) на 14% по сравнению с плацебо на фоне применение второго представителя иНГЛТ2 — канаглифлозина[4, 5]. Исследование DECLARE-TIMI 58 продемонстрировало снижение риска развития сердечно-сосудистых осложнений и хронической болезни почек у пациентов с СД2 на фоне терапии дапаглифлозином[6–8].
Во всех упомянутых исследованиях при использовании иНГЛТ2 ученые не выявили значимого снижения уровня HbA1c. Это указывает на то, что существуют другие, ранее неизвестные факторы, которые, помимо нарушенного гликемического контроля, могут повлиять на риск развития и прогрессирование осложнений, а также на преждевременную смертность. К тому же большой интерес связан с тем, что при использовании препаратов из группы иНГЛТ2 во всех исследованиях у пациентов зафиксировано снижение МТ до 3–4 кг.
Цель исследования — изучение метаболических эффектов эмпаглифлозина у пациентов с СД2 и ожирением.
Задачи исследования — оценить у пациентов с СД2 и ожирением на фоне приёма иНГЛТ2:
-
антропометрические показатели: МТ, индекс МТ (ИМТ), окружность талии (ОТ);
-
корреляционную взаимосвязь между уровнем лептина и массой жировой ткани (МЖТ);
-
динамические изменения интегратора метаболического здоровья — адипонектина;
-
динамику выраженности инсулинорезистентности с помощью расчета индекса HOMA-IR.
Дизайн: одноцентровое проспективное рандомизированное исследование.
Клиническое исследование одобрено локальным этическим комитетом ФГБУ ДПО РМАНПО Минздрава России (протокол № 14 от 27.10.2020) и соответствует Хельсинкской декларации, положениям национального стандарта РФ ГОСТ Р52379-2005 о надлежащей клинической практике и положениям от 01.04.2006, Приказом Министерства здравоохранения РФ от 01.04.2016 № 200н «Об утверждении правил надлежащей клинической практики» и положения Качественной Клинической Практики (GCP). Исследование проведено в городской поликлинике ГБУЗ МО «Домодедовская центральная городская больница» с марта 2021 г. по август 2022 г. Все пациенты подписали форму информированного согласия на участие в исследовании.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании приняли участие 46 человек (10 мужчин и 36 женщин) в возрасте 37–69 лет с ИМТ 30,0–43,9 кг/м2 и ранее установленными СД2 и ожирением. Длительность СД2 составила 1–19 лет. Все пациенты, участвующие в исследовании, в качестве сахароснижающей терапии принимали метформин. Отсутствие в анамнезе приёма препаратов из группы иНГЛТ2 являлось критерием включения.
Критерии невключения: диабетический кетоацидоз, хроническая болезнь почек, скорость клубочковой фильтрации менее 45 мл/мин/1,73 м2, наличие инфекций мочеполовой системы, беременность и период грудного вскармливания, наследственные нарушения: непереносимость галактозы, недостаточность лактозы, глюкозо-галактозная мальабсорбция.
До назначения исследуемого препарата пациентам проведен общий осмотр, расчет ИМТ (≥ 30 кг/м2), измерение ОТ (> 94 см у мужчин и > 84 см у женщин). Для измерения роста использовали стандартный вертикальный ростомер с точностью до 0,5 см, для МТ — напольные весы с точностью до 0,1 кг. Динамику углеводного обмена оценивали посредством определения уровня глюкозы плазмы натощак (норма до 6,1 ммоль/л) и уровня HbA1c (целевой уровень менее 7%). Для изучения метаболизма жировой ткани определяли уровень лептина в сыворотке крови (норма для женщин — 3,7–11,0 нг/мл, для мужчин — 2,0–5,6 нг/мл) и уровень адипонектина в сыворотке крови (норма для женщин — 7,6–15,2 мкг/мл, для мужчин — 5,5–11,1 мкг/мл). Чувствительность к инсулину оценивали по индексу HOMA-IR:
Значение индекса HOMA-IR < 2,5 считали нормальным. Динамику МЖТ измеряли посредством проведения биоимпедансометрии с помощью аппарата НТЦ «Медасс».
Статистический анализ. Статистическая обработка результатов проведена с помощью пакета программ Jamovi Desctop 2.2.5. Анализ данных осуществляли по параметрическим критериям, т.к. большинство распределений исследуемых признаков не отличалось от нормального. Качественные данные представлены в виде абсолютных значений. Взаимосвязь между двумя показателями до и после воздействия оценивали с использованием t-критерия Стьюдента. Значение р < 0,05 считали статистически значимым.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пациенты с СД2 и ожирением, о чем свидетельствуют увеличенные показатели МТ, ИМТ, ОТ, МЖТ при относительно нормальных показателях гликемии, рандомизированы методом случайных чисел на 2 группы. В основной группе (n = 22) в качестве лечения пациентам рекомендована комбинированная терапия: препарат из группы иНГЛТ2 эмпаглифлозин в дозе 25 мг/сут и метформин в дозе 2000 мг/сут. Группу контроля составили пациенты (n = 24) на монотерапии метформином в дозе 2000 мг/сут. Исходные показатели участников в обеих группах сопоставимы и представлены в табл. 1.
Таблица 1
Исходные показатели пациентов, участвующих в исследовании
Чрез 6 мес в основной группе средний уровень глюкозы венозной плазмы натощак составил 6,04 ± 0,78 ммоль/л (снижение на 0,46 ммоль/л; р = 0,301), уровень HbA1c — 5,89 ± 0,56% (снижение на 0,34%; р = 0,628). В группе контроля уровень глюкозы венозной плазмы натощак — 5,97 ± 0,92 ммоль/л (р = 0,906), уровень HbA1c — 6,08 ± 0,67% (р = 0,109). Таким образом, в обеих группах сохранялся удовлетворительный контроль гликемии независимо от интенсификации терапии, значимой разницы между группами не выявлено. Полученные нами результаты согласуются с данными исследования EMPA-REG OUTCOME, в котором после 12 нед наблюдения снижение уровня HbA1c в среднем составило 0,3–0,5%[3].
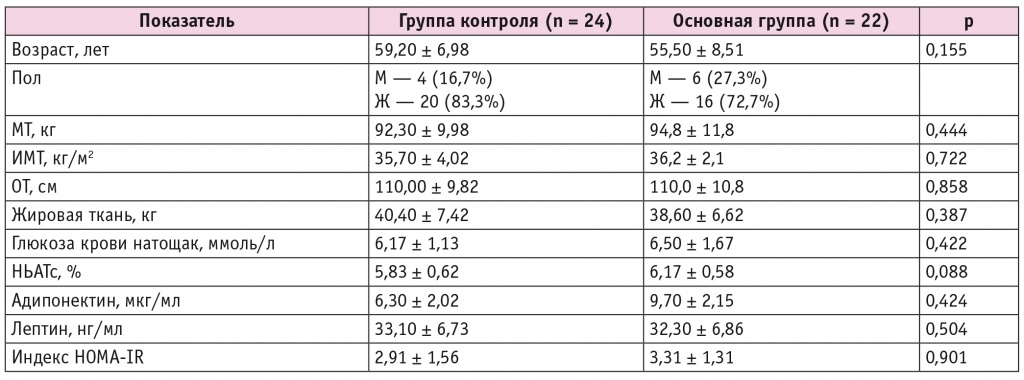
Наряду с не столь выраженным гликемическим эффектом в основной группе установлена положительная динамика антропометрических параметров и, что самое важное, маркеров метаболического здоровья. Статистически значимо (р = 0,035) снизилась МТ — с 94,8 ± 11,8 до 88,1 ± 9,6 кг (95% ДИ 0,045–1,20; в среднем 6,5 кг) по сравнению с группой контроля, в которой снижения МТ не достигнуто — 92,3 ± 9,98 и 92,1 ± 11,6 кг; р = 0,379 (95% ДИ –0,24–0,63). Механизм снижения МТ на фоне приема препаратов из группы иНГЛТ2 подробно описан в исследованиях EMPA-REG OUTCOME, CANVAS и др.[9, 10]. Снижение МТ главным образом связано с глюкозурией и осмотическим диурезом, следствием чего является потеря МЖТ со значительным уменьшением массы висцеральной жировой ткани[11–14].
Результаты нашего исследования согласуются с данными клинических исследований (рис. 1). Так, в основной группе через 6 мес наблюдения на фоне снижения МТ установлено значимое уменьшение ОТ с 110,0 ± 10,8 до 106,00 ± 9,13 см; р = 0,041 (95% ДИ 0,03–1,69). Показатель ОТ является общепризнанным диагностическим критерием наличия висцерального ожирения. Кроме того, в основной группе на фоне снижения МТ получено статистически значимое снижение ИМТ — с 36,2 ± 2,1 до 32,70 ± 1,64 кг/м2; р = 0,005 (95% ДИ 1,14–15,4). В группе контроля не установлено достоверных изменений антропометрических показателей от исходных величин: ОТ до включения в исследование — 110 ± 9,82 см, через 6 мес результат оставался прежним — 110 ± 10,3 см; р = 0,421 (95% ДИ –2,25–3,09); ИМТ исходно — 35,7 ± 4,02, через 6 мес — 35,3 ± 4,45 кг/м2; р = 0,349 (95% ДИ –0,23–0,64).
Рис. 1. Динамика антропометрических показателей в основной группе (А) и группе контроля (B)
Снижение ИМТ связано со снижением МЖТ. При проведении биоимпедансометрии в основной группе установлено статистически значимое снижение МЖТ с 38,6 ± 6,62 до 36,4 ± 6,8 кг; р = 0,01 (95% ДИ 0,16–1,23). На терапии метформином значимого снижения МЖТ не получено — исходно 40,4 ± 7,42 кг, через 6 мес — 39,2 ± 8,32 кг; р = 0,266 (95% ДИ –0,75–2,70).
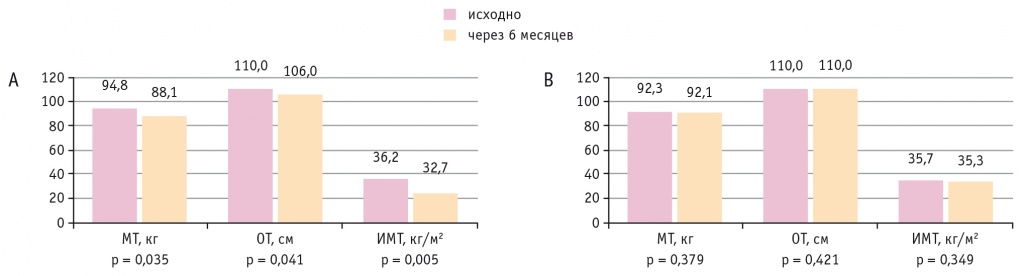
Полученная положительная динамика антропометрических показателей в основной группе коррелирует со статистически значимым снижением одного из маркеров метаболического здоровья — лептина — в среднем с 28,8 ± 11,0 до 21,0 ± 9,13 нг/мл; р = 0,035 (95% ДИ 0,06–1,73). В основной группе у 9 (52,9%) пациентов выявлена положительная корреляционная взаимосвязь между снижением уровня МЖТ и уровнем лептина (r = 0,68; p = 0,045). В группе контроля исходно уровень лептина составил 33,1 ± 6,73, через 6 мес — 30,4 ± 9,01 нг/мл; р = 0,389 (95% ДИ –0,28–0,71) (рис. 2). При проведении корреляционного анализа значимой взаимосвязи между количеством МЖТ и уровнем лептина не установлено (r = 0,331; p = 0,171; n = 18).
Рис. 2. Сравнительные результаты уровня лептина через 6 мес терапии в группах монотерапии метформином и комбинированной терапии метформином и эмпаглифлозином
У пациентов с СД2 и ожирением мы также изучили уровень адипонектина, который в настоящее время рассматривается как один из значимых маркеров метаболического здоровья. Этот адипокин циркулирует в крови в нескольких изоформах, наиболее биологически активной является высокомолекулярная изоформа, обладающая множеством положительных эффектов, в частности, антиапоптотическим, противовоспалительным, онкопротективным, антиатерогенным. Адипонектин способствует улучшению чувствительности к инсулину в тканях-мишенях, играет большую роль в регуляции энергетического обмена и т.д.[15–17]. С другой стороны, низкий уровень адипонектина может служить маркером метаболического нездоровья. По данным современной литературы, отмечено снижение уровня адипонекина в плазме крови у пациентов с СД2, ожирением, атеросклерозом[18, 19].
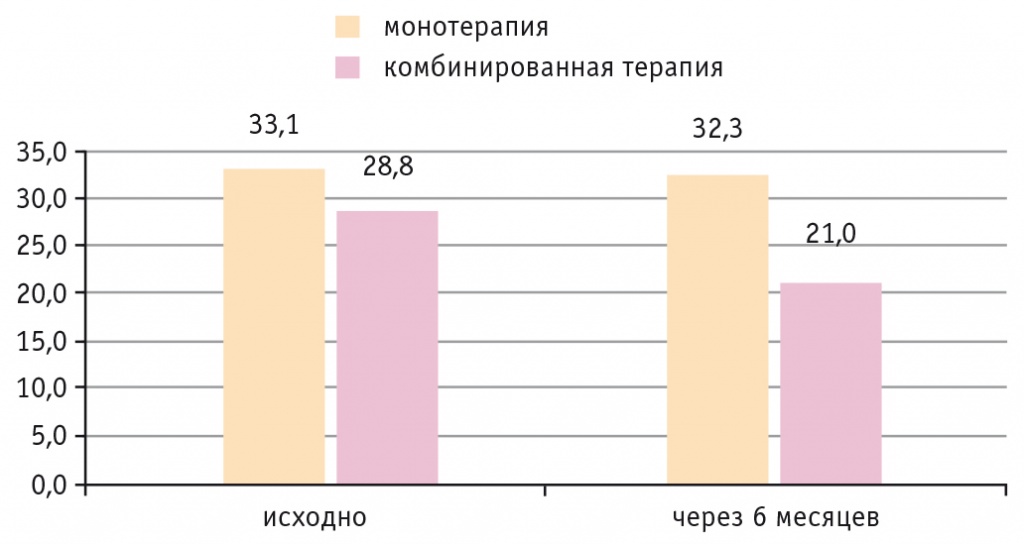
У пациентов основной группы базальный уровень адипонектина составил 9,70 ± 2,15 мкг/мл, а через 6 мес его концентрация значимо увеличилась до 13,0 ± 3,18 мкг/мл; р = 0,002 (95% ДИ –9,81–(–1,33)) по сравнению с группой контроля — 6,3 ± 2,02 мкг/мл и 8,73 ± 2,5 соответственно; р = 0,132 (95% ДИ –2,8–4,02) (рис. 3).
Рис. 3. Сравнительные результаты уровня адипонектина через 6 мес терапии в группах монотерапии метформином и комбинированной терапии метформином и эмпаглифлозином
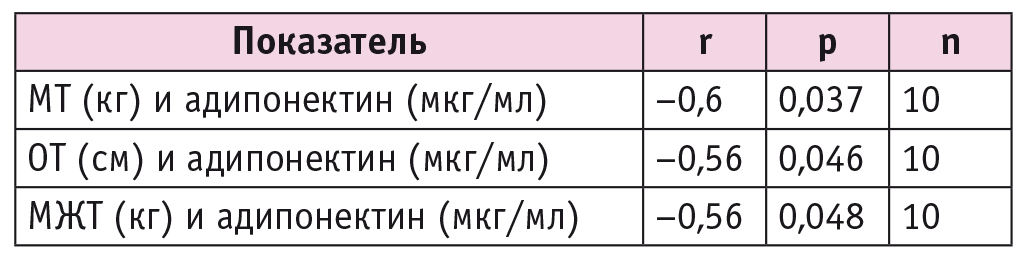
Особенно важно, что при проведении корреляционного анализа в основной группе установлена отрицательная взаимосвязь средней силы между уровнем адипонектина и антропометрическими показателями: МТ (r = –0,6; р = 0,037; n = 10), ОТ (r = –0,56; р = 0,046; n = 10), МЖТ (r = –0,56; р = 0,048; n = 10) (табл. 2). Полученные результаты отражают клинически значимое влияние эмпаглифлозина на показатели метаболического здоровья. Кроме того, по данным литературы известно, что снижение МТ и увеличение уровня адипонектина запускает механизмы регрессии метаболических нарушений, в том числе за счет улучшения чувствительности к инсулину[20].
Таблица 2
Корреляционный анализ между уровнем адипонектина (мкг/мл), антропометрическими показателями и МЖТ в основной группе через 6 мес
Основой ассоциации ожирения и нарушений углеводного обмена является наличие у пациентов инсулинорезистентности (ИР). Гиперинсулинемия, неизбежно развивающаяся на фоне ИР, приводит к увеличению МТ, тем самым формируется порочный круг, что способствует развитию других патофизиологических состояний, например, артериальной гипертензии, гиперлипидемии, атеросклероза и др.[15].
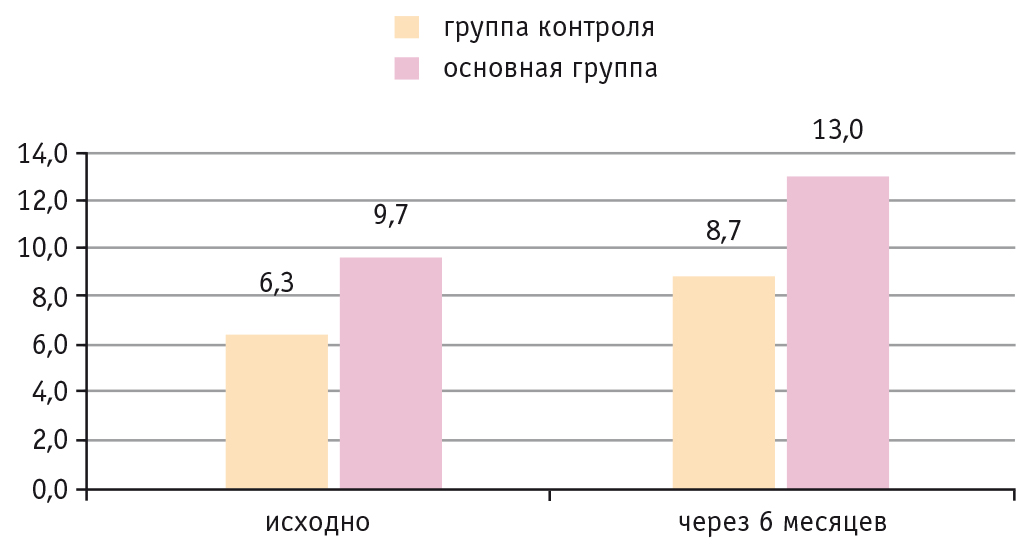
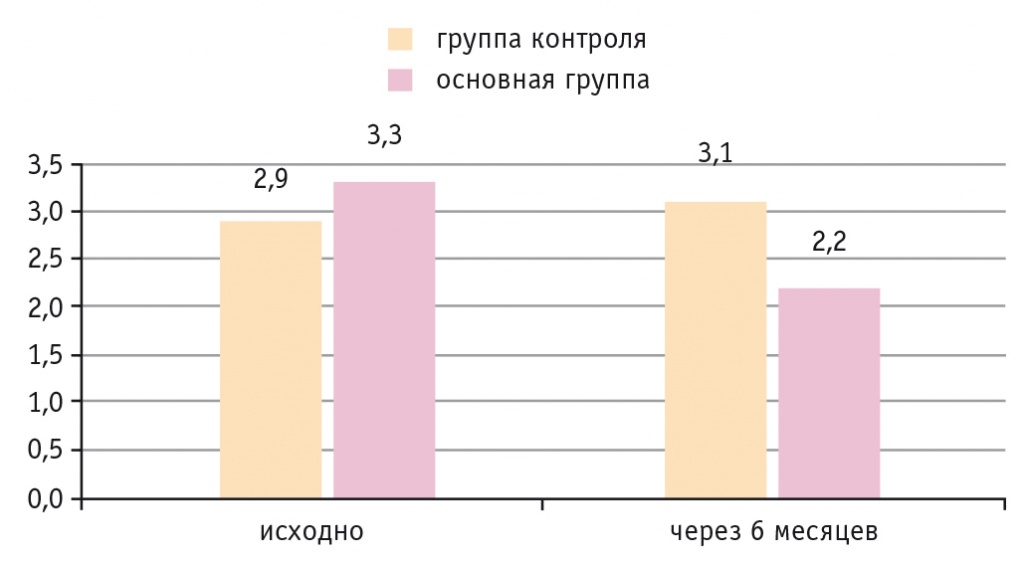
Расчет индекса HOMA-IR позволил нам установить его значимое снижение в основной группе более чем на единицу — с 3,3 ± 1,31 до 2,2 ± 1,13; р = 0,011 (95% ДИ 0,48–5,17) (рис. 4). В то же время индекс HOMA-IR в группе контроля исходно составил 2,91 ± 1,56, через 6 мес — 3,08 ± 1,89; р = 0,746 (95% ДИ –1,0–0,9). Полученные нами результаты не согласуются с данными литературы, возможно, потому что для оценки динамики чувствительности к инсулину в этой группе требуется большее время наблюдения.
Рис. 4. Сравнительные результаты индекса HOMA-IR через 6 мес терапии в группах монотерапии метформином и комбинированной терапии метформином и эмпаглифлозином
Определенный интерес представляют результаты, полученные в группе монотерапии метформином, свидетельствующие об отсутствии статистически значимой динамики уровня лептина, адипонектина и индекса HOMA-IR.
ЗАКЛЮЧЕНИЕ
По результатам проведенного нами исследования в обеих группах наблюдения у пациентов с СД2 в сочетании с ожирением независимо от интенсификации терапии сохранялся удовлетворительный контроль гликемии. Следует подчеркнуть, что в группе комбинированной терапии метформином и эмпаглифлозином по сравнению с группой монотерапии метформином наряду с не сильно выраженным гликемическим эффектом получена статистически значимая положительная динамика антропометрических показателей (снижение МТ, ИМТ, уменьшение ОТ), а также уменьшение МЖТ. Особенно важно, что у подавляющей части пациентов на терапии метформином и эмпаглифлозином на фоне улучшения антропометрических показателей установлена положительная динамика маркеров метаболического здоровья — увеличение уровня высокомолекулярного адипонектина, снижение уровня лептина и индекса HOMA-IR. Полученные результаты подтверждают клинически значимые негликемические эффекты эмпаглифлозина, что доказывает целесообразность более активного применения в клинической практике препаратов из группы иНГЛТ2 для коррекции метаболических нарушений у пациентов с СД2 и ожирением.
Поступила: 15.05.2023
Принята к публикации: 19.06.2023
________
1 WHO. World Health Organization. 2016. ProMED-mail website. URL: www.who.int/mediacentre/factsheets/fs311/en/ (дата обращения: 16.09.2022).
2 International Diabetes Federation: Diabetes Atlas, 2nd ed. Brussels, International Diabetes Federation, 2022. URL: https://diabetesatlas.org (дата обращения: 16.09.2022).








