Синдром поликистозных яичников (СПЯ) является наиболее распространенным эндокринным заболеванием у женщин и основной причиной ановуляторного бесплодия [4]. Так как симптоматика заболевания крайне разнообразна, диагностика синдрома может быть затруднена. На сегодняшний день приняты Роттердамские критерии диагностики этого состояния (European Society of Human Reproduction and Embryology/American Society for Reproductive Medicine, 2003): 1) клинические или биохимические признаки гиперандрогении; 2) ановуляция; 3) поликистозные яичники по данным УЗИ. Для постановки диагноза достаточно двух критериев из трех [31].
Появляется все больше свидетельств того, что СПЯ влияет на всю жизнь: начинаясь в утробе матери у генетически предрасположенных женщин, он проявляется клинически в период полового созревания, продолжается в течение репродуктивного периода. Пациентки с СПЯ подвержены более высокому риску развития сердечно-сосудистых заболеваний, гипертонии, сахарного диабета и других метаболических осложнений, особенно после менопаузы. В репродуктивном возрасте заболевание может привести к ановуляторному бесплодию и провоцировать развитие гестационных осложнений (выкидыша, гестационного диабета и преэклампсии) [1, 4]. Поэтому крайне важна ранняя диагностика СПЯ, только тогда пациентке будет обеспечено тщательное наблюдение для уменьшения риска осложнений.
В патогенез заболевания вовлечены многие факторы: генетические, эндокринные и факторы внешней среды. В 1980 г. G. Burgher сообщил о сочетании гиперандрогении и гиперинсулинемии у женщин с СПЯ. Была сформирована концепция, объясняющая регуляцию стероидогенеза инсулином и инсулиноподобным фактором роста (ИФР) [5].
Инсулинорезистентность (ИР) определяется как состояние, при котором нормальные концентрации инсулина реализуют субнормальные воздействия на гомеостаз глюкозы и ее утилизацию [9]. Имеющиеся данные свидетельствуют о том, что СПЯ ассоциируется с периферической невосприимчивостью инсулина и, как следствие, с гиперинсулинемией. Ожирение, которое часто встречается при СПЯ, усиливает оба эти отклонения. Резистентность к инсулину присутствует у 65–80% больных СПЯ, она диагностируется с помощью модели Homeostasis Model Assessment of Insulin Resistance-IR (HOMA-IR), косвенно позволяющей рассчитать показатель ИР, и провоцирует развитие гипергликемии и прогрессирование сахарного диабета 2 типа, а также увеличивает риск сердечно-сосудистых заболеваний [18].
Инсулин оказывает действие на печень, жировую ткань, мышцы и яичники. При СПЯ сохраняется высокая чувствительность яичников к инсулину, несмотря на резистентность остальных органов и систем. Это приводит к овариальной гиперандрогении вследствие прямого стимулирующего действия инсулина и ИФР-1 на овариальные стромальные клетки. Инсулин также ответственен за блокировку созревания и атрезию овариальных фолликулов, вызывает дефицит активности ароматазы и дальнейшее усугубление гиперандрогении. Андрогены подавляют продукцию глобулина, связывающего половые гормоны (ГСПГ), и глобулина, связывающего ИФР-1 (ИФР-1-СГ), вырабатываемые в печени. ГСПГ и ИФР-1-СГ связываются с андрогенами (тестостероном и дигидротестостероном) и уменьшают их биологическую доступность. Снижение уровней ГСПГ и ИФР-1-СГ увеличивает биодоступность андрогенов [10].
Окислительный стресс всегда наблюдается у пациенток с СПЯ, даже если у них нормальная масса тела и нет метаболических нарушений. Окислительный стресс, который хорошо известен как участник патогенеза сердечно-сосудистых заболеваний, оказывает влияние на ИР и уровни андрогенов у таких пациенток. Он наносит ущерб не только сосудам, но и репродуктивной системе. При этом существующие у пациенток ИР и гипергликемия — самостоятельные факторы, нарушающие баланс окислителей и антиоксидантов [33].
Одним из мощных антиоксидантов, регулирующих окислительный стресс, является мелатонин, главный гормон эпифиза всех позвоночных. Он выполняет множество функций в организме: стимулирует иммунную систему, синхронизирует циркадианные ритмы, регулирует цикл сна и бодрствования, а также репродуктивную функцию [14]. Его синтез происходит ночью в отсутствие света, падающего на сетчатку, днем же или при наличии искусственного освещения его продукция прекращается. Сразу же после образования мелатонин из пинеалоцитов попадает в кровь, а затем в другие жидкости организма: желчь, спинномозговую и амниотическую жидкости, слюну, сперму, фолликулярную жидкость яичников.
Помимо пинеалоцитов мелатонин синтезируется во многих клетках и тканях, в том числе в органах репродуктивной системы: яичниках, матке и плаценте. Для его синтеза используются те же ферментные системы, что и в пинеалоцитах, при этом продукция не зависит от фазы «день/ночь». Что управляет синтезом мелатонина в этих органах, остается неясным. Мелатонин, продуцируемый экстрапинеально, как полагают, исполняет роль паракоида, аутокоида и антиоксиданта [14].
Мелатонин оказывает существенное влияние на репродуктивную систему женщин; гормон считается необходимым для фолликулогенеза и воздействует на выработку стероидов и изменения клеточных сигналов на ткани-мишени. Предположительно мелатонин участвует в регуляции начала полового созревания, времени овуляции, в сохранении беременности и в развитии менопаузы [12].
Инверсия циркадианных ритмов, т. е. бодрствование в ночное время (интенсивная учеба, работа в ночную смену, нарушения сна, а также засыпание с искусственными источниками света), нарушает синтез мелатонина, что в дальнейшем может привести к хронической ановуляции. Многими исследователями подтверждено влияние изменения цикла «сон/бодрствование» на физиологические процессы в организме. Снижение продукции мелатонина под действием светового излучения во время ночных смен оказывает большое влияние на энергетический метаболизм рабочих, что негативно сказывается на их здоровье. Исследования демонстрируют, что избыточный вес и ожирение более распространены среди работающих в ночную смену, чем среди тех, кто работает днем [6, 22]. Кроме того, посменная работа и работа в ночное время связаны с повышенным риском развития других метаболических расстройств, таких как ИР, сахарный диабет, дислипидемия и метаболический синдром [8, 15, 23, 24].
Среди женщин с СПЯ распространены нарушения сна, например недостаточный сон и признаки бессонницы (трудность засыпания и поддержания сна; пробуждение слишком рано; сон, не восстанавливающий силы) [25]. Главные последствия — дневная усталость, сонливость и раздражительность. Эти расстройства могут появиться при отсутствии синдрома обструктивного апноэ сна (СОАС), при котором возникают остановки дыхания во время сна. Обнаружено, что у пациенток с СПЯ распространенность СОАС, который не зависит от ИМТ, более высока [13].
Нарушения сна могут быть одним из предикторов депрессии у женщин, страдающих СПЯ [27]. При этом сомнологические нарушения иногда сопровождают аффективные и тревожные расстройства, а также соматические дисфункции [30]. Среди пациенток с СПЯ часто встречаются такие психосоциальные нарушения, как депрессия, тревога, неудовлетворенность своим телом, эпизодическая булимия и пониженное сексуальное удовлетворение [11].
Трудности при засыпании, раннее пробуждение, сокращение времени сна, а также сонливость в дневное время способны оказать негативное влияние на качество жизни пациенток с СПЯ. В литературе отмечены также другие побочные действия на здоровье при нарушениях сна в этой группе больных. Появление СОАС может привести к серьезному усилению метаболических нарушений, а также симптомов гиперандрогении [7]. Именно поэтому своевременная оценка и соответствующее лечение нарушений сна у женщин с СПЯ очень важны.
Цель исследования: изучить взаимосвязь сомнологических и метаболических нарушений при СПЯ, а также обосновать эффективность их терапии мелатонином в комплексном лечении СПЯ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили среди пациенток, обратившихся в отделение эндокринной гинекологии ФГБУ «Эндокринологический научный центр» Минздрава России (директор — академик РАН, профессор И. И. Дедов) в период с 2013 по 2016 г.
В исследовании участвовали 60 пациенток с СПЯ в возрасте 17–35 лет и 60 здоровых женщин с регулярным менструальным циклом. Участницы обеих групп не отличались по возрасту и ИМТ. Средний возраст составил 25 лет.
Критериями включения в основную группу стали возраст от 17 до 35 лет включительно; нерегулярный менструальный цикл; признаки поликистозных яичников по данным УЗИ; клинические признаки гиперандрогении; отсутствие какой-либо гормональной терапии в течение 6 месяцев до исследования; информированное согласие на комплексное обследование и лечение.
Критерии исключения: противопоказания к предлагаемому лечению; наличие хронических экстрагенитальных заболеваний в стадии обострения и субкомпенсации; выявление острых и обострения хронических воспалительных заболеваний половых органов; опухолевидные и опухолевые заболевания половых органов.
На I этапе были отобраны 30 пациенток с СПЯ и ИМТ ≥ 25 кг/м2 (1-я подгруппа) и 30 пациенток с СПЯ и ИМТ < 25 кг/м2 (2-я подгруппа). 3-ю подгруппу составили 30 здоровых женщин с ИМТ ≥ 25 кг/м2, 4-ю подгруппу — 30 здоровых женщин с ИМТ < 25 кг/м2. Расчет ИМТ производили по формуле: отношение массы тела (кг) к величине роста в квадрате (м2).
Каждая участница прошла анкетирование, клинико-анамнестическое, гормональное, биохимическое исследование и УЗИ органов малого таза.
Анкетирование пациенток проводили на основании балльной оценки субъективных характеристик сна (времени засыпания и продолжительности сна, количества ночных пробуждений и сновидений, качества утреннего пробуждения). Нормальным считали сон при ≥ 22 баллов, 21–19 баллов — пограничные значения, < 19 баллов — сон нарушен [3]. Вероятность наличия СОАС определяли по анкете скрининга СОАС (его отсутствие регистрировали при значении < 4 баллов) [2]. Эпвортская шкала была использована для оценки дневной сонливости (нормативный показатель ≤ 9 баллов) [20]. Применяли также Госпитальную шкалу тревоги и депрессии [32].
При биохимическом анализе крови определяли показатели липидного спектра (уровни общего холестерина, ЛПВП, ЛПНП, триглицеридов), проводили пероральный глюкозотолерантный тест (ПГТТ) с измерением уровня глюкозы натощак и через 120 минут после начала теста.
Гормональный анализ крови включал определение на 5–7-й день цикла уровней тестостерона, лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, инсулина с последующим расчетом индекса HOMA-IR по формуле оценки ИР (за норму были приняты показатели < 2,7):
[инсулин (мкЕд/мл) — глюкоза (ммоль/л)]/22,5.
На II этапе каждой участнице с СПЯ была подобрана персонифицированная терапия в зависимости от полученных результатов комплексного обследования. При этом 17 (28,3%) пациенткам с признаками гиперандрогении, увеличения объема яичников (более 10 см3), которые нуждались в контрацепции, был назначен КОК, содержащий 30 мкг этинилэстрадиола, 3 мг дроспиренона и 0,451 мг кальция левомефолата.
Если по данным обследования у женщины обнаруживали нарушения углеводного обмена (гиперинсулинемию, нарушенную толерантность к глюкозе), то к терапии КОК добавляли метформин в дозе 1500 мг в сутки. Эту комбинированную терапию получали 3 (5,0%) пациентки.
При наличии сомнологических нарушений по данным первичного анкетирования участницы получали синтетический аналог мелатонина в дозе 3 мг 1 раз в день в течение 3 месяцев. Комбинированную терапию мелатонином, метформином и КОК получали 5 (8,3%), двухкомпонентное лечение мелатонином и КОК — 7 (11,7%) женщин с СПЯ.
При наличии противопоказаний к назначению КОК либо при отказе от данной терапии пациентки принимали гестагены (дидрогестерон). На монотерапии дидрогестероном находились 5 (8,3%) участниц. Метформин и гестаген были назначены 6 (10,0%) пациенткам, 4 (6,7%) женщины получали терапию мелатонином, метформином и дидрогестероном, одна (1,7%) — мелатонином и метформином, еще одна (1,7%) — только метформином, 11 (18,3%) пациенток после операции электрокаутеризации яичников с учетом планируемой беременности не получали лечение.
Длительность приема КОК составила 3–6 месяцев, после чего делали УЗИ с определением объема яичников. После 3 месяцев терапии мелатонином проводили повторное анкетирование для оценки динамики выявленных первичных нарушений после лечения. Для определения эффективности в нормализации углеводного обмена через 3 месяца терапии исследовали уровень инсулина в крови.
Статистическая обработка полученных данных была проведена с использованием прикладных программ Statistica (StatSoft Inc., США, версия 6.0). Для анализа вида распределений применяли критерии Шапиро — Уилка и Лиллиефорса, дисперсии распределений признаков оценивали с помощью F-критерия в процедуре дисперсионного анализа ANOVA. Сравнение независимых групп по количественным признакам осуществляли непараметрическим методом с использованием U-критерия Манна — Уитни.
Зависимые группы по количественным признакам сравнивали непараметрическим методом с применением критерия Вилкоксона. Сравнение независимых групп по качественным признакам проводили непараметрическим методом путем анализа таблиц сопряженности с использованием двустороннего точного критерия Фишера для несвязанных групп. Анализ связи (корреляции) двух количественных признаков осуществлялся непараметрическим методом ранговой корреляции по Спирмену, а количественного и порядкового — по Кендаллу.
Статистически значимыми считали различия при p < 0,05.
Результаты
По данным первичного анкетирования на основании балльной оценки субъективных характеристик сна в подгруппе пациенток с ИМТ ≥ 25 кг/м2 у 60% участниц были обнаружены отклонения в сомнологическом профиле (у 30% — явная патология и у 30% — пограничные значения). В подгруппе пациенток с ИМТ < 25 кг/м2 у 70% выявили сомнологические нарушения (рис.).
Рис. Характеристики сна пациенток с синдромом поликистозных яичников
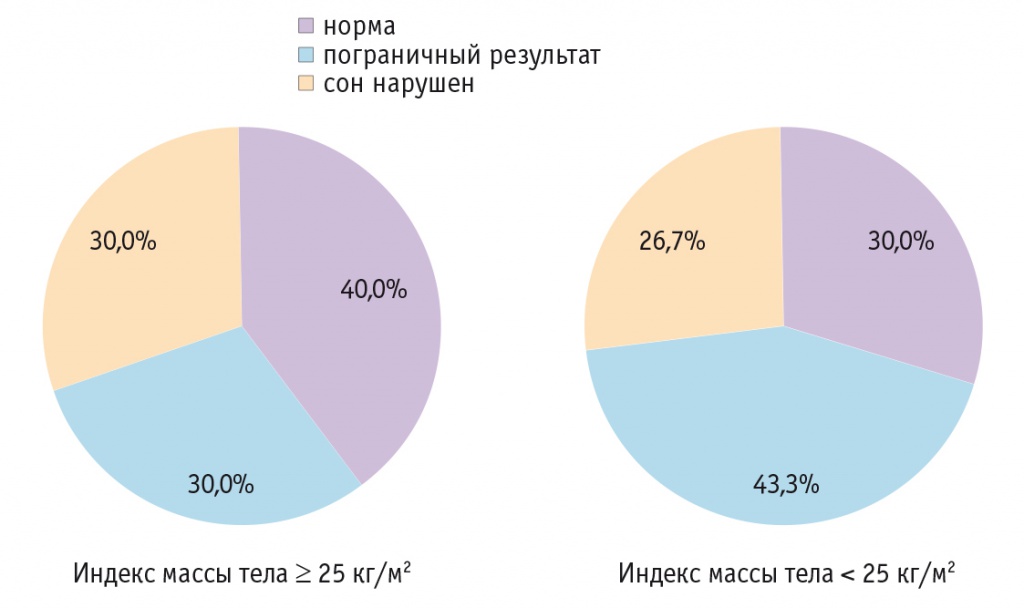
1-я (СПЯ при ИМТ ≥ 25 кг/м2) и 3-я (контроль с ИМТ ≥ 25 кг/м2) подгруппы достоверно различались по степени нарушения сна по данным анкетирования (р = 0,02), как и 2-я и 4-я подгруппы (р = 0,025). Значимой корреляции показателей оценки субъективных характеристик сна с ИМТ не обнаружено.
Скрининг СОАС показал достоверные отличия по данному состоянию между 1-й и 2-й подгруппами (р = 0,026). В 1-й подгруппе у 26,7%, а во 2-й — у 3,3% участниц зарегистрировали признаки СОАС. По данным Эпвортской анкеты подгруппы не отличались: в 1-й превышение нормативного показателя было выявлено у 33,3%, во 2-й — у 20,0%, в 3-й — у 23,3%, в 4-й — у 20,0% участниц.
Анкетирование с помощью Госпитальной шкалы тревоги и депрессии достоверных различий между группами СПЯ и контроля не показало.
По данным ПГТТ подгруппы с СПЯ значимо отличались по выраженности нарушений углеводного обмена: нарушенная толерантность к глюкозе встречалась у 30,0% женщин 1-й подгруппы и только у 6,7% во 2-й (р < 0,05). Уровень глюкозы натощак был также достоверно выше в 1-й подгруппе по сравнению со 2-й (р < 0,05). В группе контроля нарушения углеводного обмена не зарегистрировали. Индекс НОМА-IR был достоверно выше в подгруппе с СПЯ и ИМТ ≥ 25 кг/м2, чем во 2-й и 3-й (р < 0,01 для всех значений); между 2-й и 4-подгруппами значимых отличий не обнаружено.
Сравнительная характеристика биохимических и гормональных показателей у больных СПЯ и участниц группы контроля в зависимости от ИМТ представлена в таблице.
Таблица
Сравнение биохимических и гормональных показателей у участниц исследования в зависимости от индекса массы тела
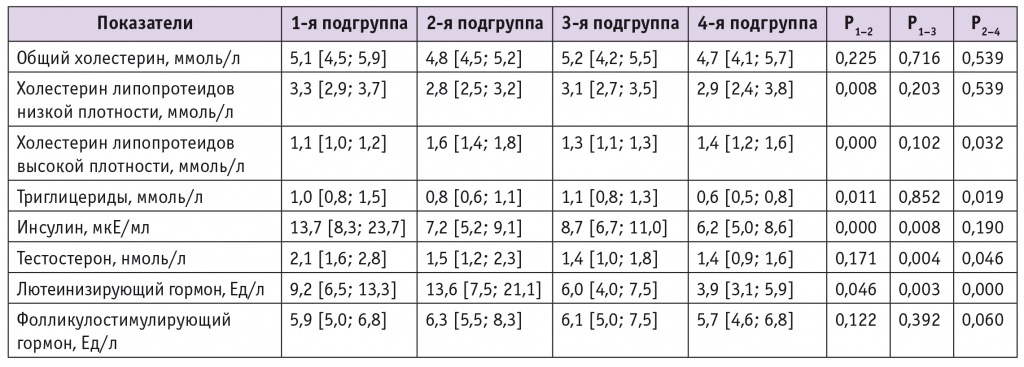
При сравнении двух подгрупп с СПЯ были выявлены достоверно более высокие показатели холестерина ЛПНП, триглицеридов и инсулина и достоверно более низкие значения холестерина ЛПВП в подгруппе с ИМТ ≥ 25 кг/м2. Показатели общего холестерина и ФСГ в этих подгруппах значимо не различались. Содержание инсулина и тестостерона было достоверно выше в подгруппе СПЯ с ИМТ ≥ 25 кг/м2 по сравнению с 3-й подгруппой. Уровень тестостерона был повышен в обеих подгруппах с СПЯ независимо от ИМТ. Концентрация ЛГ была достоверно выше у пациенток с ИМТ < 25 кг/м2 при сравнении с контролем и женщинами с СПЯ и ИМТ ≥ 25 кг/м2 (р < 0,05), при этом последние также имели более высокий показатель ЛГ по сравнению с группой контроля соответствующего веса (р = 0,03).
При сравнительном анализе групп СПЯ и контроля обнаружили значимую корреляцию степени нарушений сна по данным балльной оценки субъективных характеристик сна и уровня инсулина (p < 0,05).
На фоне приема КОК с дроспиреноном, этинилэстрадиолом и левомефолатом кальция у всех пациенток, получавших лечение в течение 3–6 месяцев, объем яичников снизился до нормы (9 см3). Все пациентки отметили уменьшение клинических проявлений гиперандрогении, регулярные менструации.
При сравнении концентраций инсулина до и после лечения метформином было зарегистрировано достоверное снижение уровня инсулина (р < 0,01) и ИМТ (р < 0,01), а также степени нарушений по данным балльной оценки субъективных характеристик сна (р = 0,07). Терапия синтетическим аналогом мелатонина успешно купировала все сомнологические жалобы, что отразилось в повышении количества баллов и достижении нормативных показателей, зафиксированных при контрольном анкетировании.
Обсуждение
Полученные результаты по сомнологическому профилю пациенток с СПЯ согласуются с данными других авторов [16, 26]. Независимо от ИМТ у женщин с СПЯ были выявлены значимые нарушения сна, при этом зарегистрировали корреляцию с уровнем инсулина, что подтверждает необходимость лечения данных нарушений для профилактики развития метаболического синдрома. По данным L. Moran и соавт. (2015), более одной трети женщин с СПЯ часто испытывают трудности при засыпании, а каждая пятая нередко просыпается без причины и не может снова быстро заснуть. Для каждого типа нарушений распространенность превышает таковую среди женщин того же возраста без СПЯ примерно в 2 раза. Избыточный вес и ожирение у женщин с СПЯ имеют минимальное значение в появлении трудностей при засыпании и поддержании сна [26].
Одним из компонентов метаболического синдрома является ИР, которая была выявлена у пациенток с СПЯ на основании расчета индекса НОМА-IR. Промежуточный этап в развитии сахарного диабета — нарушенная толерантность к глюкозе, которая имела место как у пациенток с ИМТ ≥ 25 кг/м2, так и у участниц с нормальным весом, что говорит о независимых от веса факторах появления ИР, что подтверждают и другие авторы [28]. Гиперинсулинемия может приводить к снижению уровня ГСПГ, что дополнительно усугубляет гиперандрогению — один из факторов, влияющих на психологическую составляющую патогенеза СПЯ [17]. Избыток массы тела, рост нежелательных волос на лице и теле, акне, истончение волос кожи головы, нерегулярные менструации и субфертильность также способны стать психологической нагрузкой в этой популяции относительно молодых женщин.
Липидный профиль у пациенток с СПЯ в нашем исследовании продемонстрировал значимые отклонения: выраженная гипертриглицеридемия и повышенный уровень холестерина ЛПНП являются серьезными факторами риска сердечно-сосудистых заболеваний. Абсолютный риск сердечно-сосудистых событий у молодых женщин низок, и лечение статинами редко показано в репродуктивном возрасте при СПЯ. При этом около 50% пациенток с СПЯ в популяции имеют несколько компонентов метаболического синдрома, что повышает риск рака и общей смертности [17].
Как правило, рекомендуется проводить скрининг сердечно-сосудистых факторов риска у женщин с СПЯ на момент постановки диагноза, хотя интервалы для последующего наблюдения четко не определены. Необходимы дополнительные исследования, чтобы определить, надо ли осуществлять различный скрининг в зависимости от возраста и этнической принадлежности [17].
Лечение СПЯ направлено на коррекцию гиперандрогении, снижение веса и повышение чувствительности к инсулину. Следует учитывать отдаленные эффекты лечения на метаболические и сосудистые исходы, поскольку некоторые медицинские вмешательства могут ухудшить метаболический профиль при СПЯ.
Использование КОК в терапевтических целях регулирует менструальный цикл и повышает уровень ГСПГ, что приводит к снижению концентрации свободного тестостерона и уменьшению выраженности гирсутизма. При этом следует отдавать предпочтение КОК с гестагеном, нейтральным по отношению к метаболизму и имеющим максимальный антиандрогенный эффект [19]. Добавление в состав КОК левомефолата кальция — активной формы фолата — позволяет успешно бороться с гипергомоцистеинемией, поскольку выявлена достоверная корреляция между этим патологическим состоянием, фолатным дефицитом и частотой полиморфизма генов фолатного цикла у пациенток с СПЯ [4].
Лечение метформином повышает чувствительность к инсулину и улучшает овуляторную функцию при СПЯ, при этом на гиперандрогению и гирсутизм он значимого влияния не оказывает [21]. Терапией первой линии при нарушенной толерантности к глюкозе являются изменение образа жизни и прием метформина, при этом диета наиболее эффективна для снижения веса, в то время как метформин обладает дополнительным незначительным действием [29].
Заключение
Синдром поликистозных яичников (СПЯ) — состояние, ассоциированное не только с гиперандрогенией и инсулинорезистентностью (ИР), но и с нарушениями сна независимо от ИМТ. Корреляция уровня инсулина со степенью сомнологических нарушений говорит о прямом влиянии циркадианных ритмов сна и бодрствования на развитие метаболических нарушений и ухудшение чувствительности тканей к инсулину. Терапия мелатонином достоверно улучшает субъективные параметры сна.
Сопутствующие синдрому метаболические нарушения, такие как ИР, дислипидемия и нарушенная толерантность к глюкозе, повышают риск серьезных осложнений в виде сахарного диабета и сердечно-сосудистых заболеваний. Учитывая не только гинекологическую составляющую патологического процесса, но и метаболические риски, можно утверждать, что лечение СПЯ требует междисциплинарного подхода с обязательной оценкой сомнологических нарушений и длительного диспансерного наблюдения за пациентками.








