ВВЕДЕНИЕ
Аутоиммунные заболевания щитовидной железы возникают в результате нарушения в организме регуляции иммунной системы, что приводит к иммунной атаке на саму щитовидную железу. Это заболевания, связанные с развитием опосредованных Т-клетками органоспецифических аутоиммунных нарушений. Наиболее распространен в настоящее время аутоиммунный тиреоидит (АИТ), который характеризуется наличием циркулирующих антител и инфильтрацией аутореактивными лимфоцитами щитовидной железы, а в ряде случаев и орбиты[1–4].
Частота АИТ составляет около 5%, однако распространенность носительства антитиреоидных аутоантител (АутоАТ) в популяции значительно выше. Вопрос о роли АутоАТ к компонентам собственных тканей или внутриклеточным ферментам в развитии АИТ достаточно сложен, т. к. динамика их уровней не имеет четкого диагностического и прогностического значения для оценки развития и прогрессирования АИТ. Неизвестно, когда именно носительство АутоАТ переходит в заболевание, всегда это происходит или носительство остается на протяжении всей жизни без возникновения болезни[5].
Нередко обнаруживается иммунологическое совпадение с другими аутоиммунными болезнями и семейным аутоиммунным анамнезом. Существует генетическая предрасположенность к нескольким аутоиммунным патологиям[6]. Из всех вариантов сочетаний аутоиммунных заболеваний наиболее часто дифференцируются СД 1 типа (СД1) и аутоиммунные заболевания щитовидной железы[7, 8]. Существуют ассоциации между АИТ и другими болезнями, системными аутоиммунными нарушениями (СД, ревматоидным артритом, системной красной волчанкой, саркоидозом, псориатическим артритом)[9].
При АИТ и других аутоиммунных расстройствах гуморальные и клеточные иммунные механизмы тесно связаны между собой и имеют перекрестную реакцию. В связи с этим гуморальные и клеточные иммунные механизмы взаимно усиливают ответные реакции, определяя сложные механизмы патогенеза АИТ[10, 11]. Вследствие взаимоотягощающего влияния аутоиммунных заболеваний друг на друга требуется более тщательное наблюдение за пациентами с AИТ и другой аутоиммунной патологией с целью выявления прогрессирования заболевания и ранней диагностики других аутоиммунных нарушений.
Цель исследования: на основании комплексного определения клинических, гормональных и иммунологических маркеров дать сравнительную оценку статуса пациентов с АИТ и АИТ в сочетании с СД1.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено открытое сравнительное исследование с параллельными группами на базе БУ ВО ХМАО-Югры «Сургутский государственный университет», БУ ХМАО-Югры «Нижневартовская городская поликлиника» в период 2013–2018 гг.
В исследование включены 175 пациентов с верифицированным диагнозом АИТ, согласно Клиническим рекомендациям по диагностике и лечению АИТ[12]. Возраст пациентов — 18–55 лет.
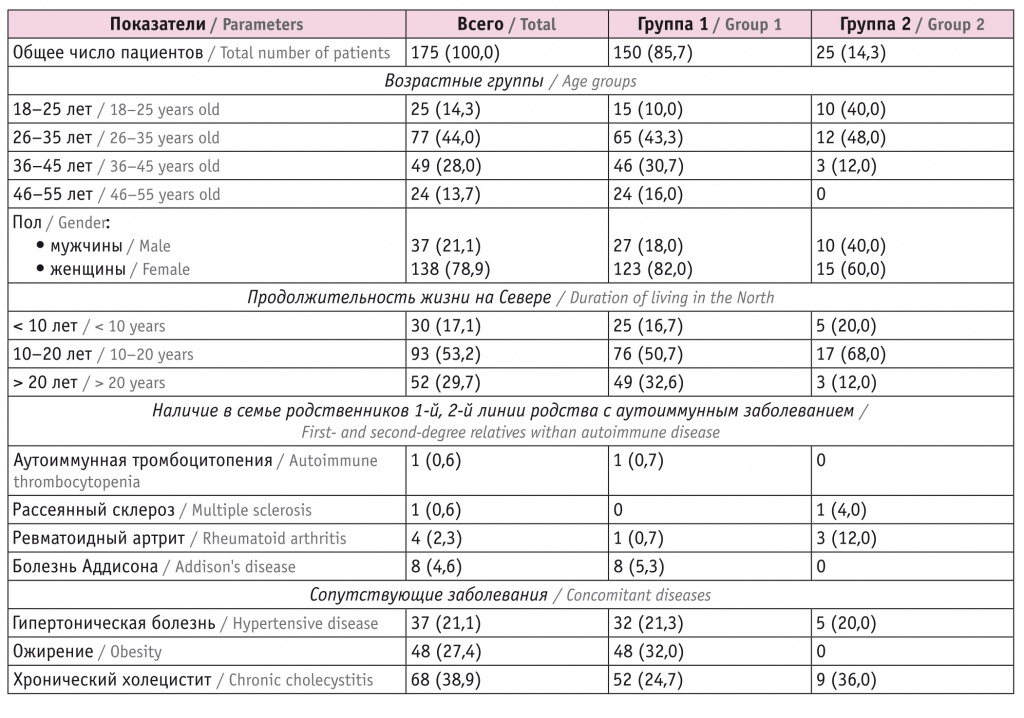
Участники были разделены на две группы в зависимости от наличия или отсутствия СД1: группа 1 — пациенты только с АИТ (n = 150), группа 2 — с АИТ и СД1 (n = 25). Больные АИТ и СД1 были моложе, чем лица только с АИТ (табл. 1).
Таблица 1
Общая характеристика пациентов исследуемых групп, n (%)
Группу контроля (n = 30) составили практически здоровые лица (доноры крови) без аутоиммунной патологии в анамнезе и на момент включения в исследование, с уровнями ТТГ, антител к ТПО, к ТГ в пределах референсных значений, без острых, хронических заболеваний в фазе обострения.
Для решения поставленных задач проведены клинические, лабораторные исследования. Всем пациентам проводился забор крови натощак из периферической вены для биохимического и гормонального исследований.
Гормональное исследование сыворотки крови осуществляли на иммунохимическом анализаторе Access 2 Immunoassay System (Beckman Сoulter, США). АутоАТ к ТГ, ТПО, инсулину, к рецептору ТТГ (рТТГ) определяли с помощью ИФА на стандартных плашках по методике «БиоХимМак» (Россия). Оптическую плотность оценивали на спектрофотометре Reader Pasteur LP 400 (Франция) с длиной волны 450 нм, по результатам которой строили калибровочную кривую.
Определение Ig классов А, М, G в сыворотке крови производили на стандартных плашках нефелометром NEPHELOstar Plus (BMG LABTECH, Германия) нефелометрическим методом c помощью стандартных антииммуноглобулиновых сывороток («МедБиоСпектр», Россия). Популяционный состав лимфоцитов, субпопуляционный состав Т-клеток исследован по стандартной методике на проточном цитометре Beckman Coulter Epics XL Flow Cytometer (Beckman Сoulter, США) с помощью моноклональных антител.
УЗИ щитовидной железы делали на ультразвуковом сканере ACUSON X300 (Siemens, Германия).
Статистический анализ полученных данных проводили при помощи пакетов статистических программ (Microsoft Access, Excel for Windows, SPSS Statistics 2.0). Количественные показатели представлены в виде Ме (L–H), где Ме — медиана, L и H — нижний и верхний квартиль соответственно. Статистическую значимость различий между двумя независимыми количественными переменными оценивали с использованием непараметрических критериев Манна — Уитни.
Для исследования наличия и силы связей между изучаемыми параметрами (гормонального профиля щитовидной железы, клеточного и гуморального звеньев иммунитета) применяли коэффициент ранговой корреляции Спирмена. Статистически значимыми считали различия при р < 0,05.
Все пациенты в рамках исследования добровольно подписали информированное согласие. Этическая экспертиза протокола исследования проведена в локальном этическом комитете БУ ВО «Сургутский государственный университет».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Большинство пациентов с АИТ, вошедших в исследование, вне зависимости от наличия/отсутствия СД1 составили лица, проживавшие в условиях северных территорий от 10 до 20 лет (см. табл. 1). В исследуемых группах превалировали женщины в возрасте 26–35 лет. У 8,1% участников групп 1 и 2 были родственники 1-й, 2-й линии с различными аутоиммунными заболеваниями.
В семьях больных с АИТ (у лиц первой степени родства: родитель — потомок) регистрировали случаи других аутоиммунных заболеваний, частота которых не различалась в группах.
Все 175 пациентов, включенных в исследование, получали заместительную терапию левотироксином натрия (50–75–100 мкг/сут). Критерием адекватности назначаемой заместительной терапии в группах 1 и 2 считали поддержание нормальной концентрации ТТГ в сыворотке крови, отсутствие жалоб и клинических проявлений. В группе пациентов с АИТ и СД1 в 100% случаев проводилась базис-болюсная инсулинотерапия: инсулин гларгин + инсулин аспарт в среднесуточной дозе 25 ± 7,8 ЕД/сут и 20 ± 5,6 ЕД/сут соответственно. Длительность течения СД1 на момент включения в исследование в группе 2 превышала 1 год и составила до 5 лет у 52% пациентов и более 5 лет — у 48%.
Пациенты с манифестным гипотиреозом предъявляли разнообразные жалобы, наиболее частые: общая утомляемость и слабость (n = 67, 38,3%), перепады настроения (n = 67, 38,3%), чувство комка в горле (n = 42, 24%). Частота жалоб различалась в исследуемых группах, они значимо чаще имели место у участников группы 1, чем у больных группы 2: общая утомляемость — у 31% и 7% соответственно, снижение работоспособности — у 26% и 4%, перепады настроения — у 32% и 6,3%, чувство комка в горле — у 17% и 7%, ухудшение памяти — у 16% и 2%, бессонница — у 25,7% и 3%; боли в области сердца (8,5%) и повышение веса (24%) были только в группе 1. В этой группе чаще встречались и другие клинические проявления и жалобы: отеки диагностированы у 9,7% пациентов, боли в суставах — у 8,5%, выпадение волос — у 17%. У 4,6% больных АИТ и СД1 регистрировали жалобы на гипогликемические состояния.
Таким образом, неспецифические жалобы и клинические проявления, характеризующие манифестный АИТ, были менее выражены в группе с сочетанной аутоиммунной патологией (АИТ + СД1).
Оценка функции щитовидной железы в исследуемых группах выявила ожидаемое повышение содержания ТТГ в сравнении с показателями в группе контроля. Уровни свободных фракций Т4 и ТГ соответствовали референсным значениям с тенденцией к показателям у нижней границы нормативного интервала (табл. 2).
Таблица 2
Показатели гормонального профиля щитовидной железы у пациентов исследуемых групп, Ме (L–H)
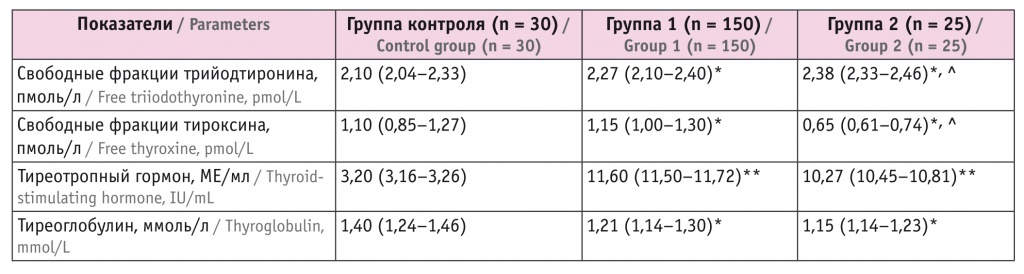
Примечания.
1. Отличия от группы контроля статистически значимы: (*) — p < 0,05, (**) — p < 0,01.
2. Отличия от группы 1 статистически значимы: (^) — p < 0,05.
Проведена оценка адаптивного иммунитета у пациентов. Изучены концентрации АутоАТ к ТГ, ТПО, к инсулину, собственным компонентам поджелудочной железы. АутоАТ указанных групп зафиксированы у пациентов обеих групп, однако лица с сочетанием АИТ и СД1 имели более высокие показатели (табл. 3). При этом АутоАТ к рТТГ в обеих группах отсутствовали. У больных группы 2 титр АутоАТ к собственным компонентам поджелудочной железы был значимо выше, чем у пациентов группы 1 (р < 0,01).
Таблица 3
Состояние гуморального звена иммунитета пациентов исследуемых групп, Ме (L–H)
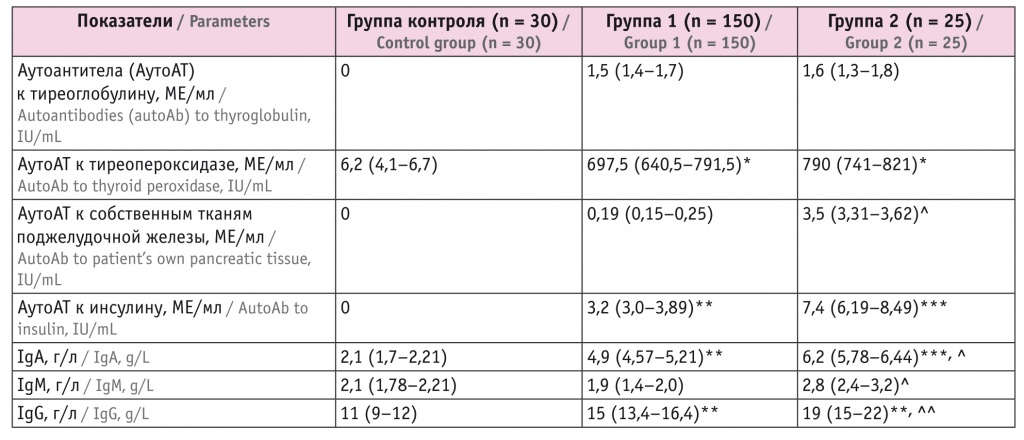
Примечания.
1. Отличия от группы контроля статистически значимы: (*) — p < 0,001, (**) — p < 0,05, (***) — p < 0,01.
2. Отличия от группы 1 статистически значимы: (^) — р < 0,01, (^^) — p < 0,001.
В обеих группах содержание IgA и IgG оказалось значимо выше в сравнении с показателями группы контроля (см. табл. 3), значимое отличие уровня IgМ у больных АИТ от контрольных значений не найдено. Концентрации IgА, IgМ и IgG были значимо выше в группе пациентов с АИТ и СД1, чем в группе только с АИТ.
В группах 1 и 2 определены взаимосвязи между концентрациями ТТГ и IgG (r = 0,47, p < 0,05 и r = 0,65, p < 0,001 соответственно), ТТГ и IgА (r = 0,49, p < 0,002 и r = 0,64, p < 0,001), АутоАТ к ТПО и IgА (r = 0,61, p < 0,001 и r = 0,81, p < 0,001).
Полученные данные свидетельствуют о том, что нарушение регуляции гормонов щитовидной железы с формированием гипотиреоидного состояния неизбежно приводит к активации аутоиммунитета с увеличением продукции АутоАТ к ряду белковых структур клеток и тканей организма. Однако данное увеличение является уже результатом активации процессов клеточного иммунитета, которые стартовали задолго до появления клинико-лабораторных изменений.
Значительные изменения наблюдались в иммунном статусе пациентов обеих групп. Абсолютное и относительное количество В-лимфоцитов (СD19/20+) было увеличено в обеих группах (табл. 4). Выявлено значимое снижение относительной и абсолютной концентрации СD3+/CD4+ и СD3+/CD8+ лимфоцитов на фоне повышения относительного и абсолютного количества СD3+/CD16/56+. Более выраженные отклонения характерны для больных АИТ и СД1 (см. табл. 4).
Таблица 4
Состояние клеточного звена иммунитета пациентов исследуемых групп, Ме (L–H)

Примечания.
1. Отличия от группы контроля статистически значимы: (*) — p < 0,01, (**) — p < 0,05.
2. Отличия от группы 1 статистически значимы: (^) — p < 0,05, (^^) — < 0,01.
Полученные результаты показывают вовлечение Т-клеток популяции лимфоцитов в процессы аутодеструкции щитовидной и поджелудочной желез. При протекающих аутоиммунных процессах в обеих железах данные нарушения более выражены у больных с СД1. Снижение содержания СD3+/CD4+ (Т-хелперов) и СD3+/CD8+ лимфоцитов (Т-цитотоксических) в периферической крови связано с перераспределением этих клеток в очаги аутоиммунного воспаления (щитовидную железу, поджелудочную железу).
Многократное увеличение относительного и абсолютного количества Т-клеточной субпопуляции — Т лимфоцитов-киллеров (СD3+/CD16/56+) — демонстрирует выраженность аутоиммунного процесса на этапе появления начальных клинических и лабораторных признаков, более сильную у пациентов с сочетанием аутоиммунной патологии. При наличии хронического аутоиммунного воспаления субпопуляция этих клеток будет инициировать дальнейшие аутоиммунные реакции не только по гуморальному, но и по клеточному типу, что согласуется с рядом литературных данных[4, 5].
Оценка взаимосвязей показателей гормонального профиля щитовидной железы и клеточного звена иммунитета в группе пациентов только с АИТ выявила отрицательные корреляционные связи показателей ТТГ и Т-хелперов и Т-цитотоксических компонентов: ТТГ и СD3+/CD4+ (r = –0,51, p < 0,001) и ТТГ и СD3+/CD8+ (r = –0,55, p < 0,001). В группе пациентов с АИТ и СД1 определены аналогичные связи: ТТГ и СD3+/CD4+ (r = –0,50, p < 0,02), ТТГ и СD3+/CD8+ (r = –0,48, p < 0,02). Так как у больных с АИТ и СД1 наблюдалось значительное повышение количества лимфоцитов СD3+/CD16/56+, в этой группе определена его сильная положительная корреляционная связь с уровнем ТТГ (r = 0,62, p < 0,001). Полученные данные могут свидетельствовать о вовлечении Т-клеток популяции лимфоцитов в процессы аутодеструкции щитовидной и поджелудочной желез.
ЗАКЛЮЧЕНИЕ
При непрерывно протекающем аутоиммунном процессе нарушения более выражены у пациентов с сочетанной аутоиммунной патологией — аутоиммунным тиреоидитом (АИТ) и СД 1 типа. Значительное возрастание относительного и абсолютного количества Т-клеточной субпопуляции — Т-киллеров (СD3+/CD16/56+) — характеризует выраженность аутоиммунного процесса у всех пациентов с АИТ, особенно у больных более молодого возраста с сочетанием аутоиммунных заболеваний, что согласуется с данными других исследований[13, 14].
Результаты корреляционного анализа позволяют предположить, что имеющаяся тиреоидная недостаточность определяет негативное действие на состояние клеточных и гуморальных факторов аутоиммунного воспаления, формируя многочисленные взаимосвязи, усугубляющие действие факторов воспаления.
В нашем исследовании у пациентов, имеющих родственников с аутоиммунными заболеваниями, были более значимые изменения тиреоидного профиля, а также титров аутоантител к ряду поверхностных и внутренних структур клеток органов эндокринной системы, сывороточных иммуноглобулинов, чем у участников без отягощенного семейного анамнеза[15]. Для хронического АИТ характерно длительное малосимптомное течение, в связи с этим выявление аутоиммунной патологии у члена семьи определяет необходимость повышенной настороженности для ранней диагностики аутоиммунных заболеваний.
По объективным причинам группа 2 исследования представлена ограниченным числом пациентов, что могло привести к некоторому смещению результатов.
Поступила: 14.02.2020
Принята к публикации: 10.03.2020








