Надпочечниковая недостаточность (НН) определяется неспособностью коры надпочечников продуцировать достаточное количество глюкокортикоидов и/или минералокортикоидов. Различают первичную НН (1-НН) и вторичную, или центральную, НН (2-НН). 1-НН возникает вследствие разрушения коры надпочечников и характеризуется дефицитом как глюкокортикоидов, так и минералокортикоидов. 2-НН (распространенность — 150–280 случаев на миллион населения) обусловлена нарушением секреции адренокортикотропного гормона (АКТГ), что приводит к нарушению продукции глюкокортикоидов[1, 2]. Как при 1-НН, так и при 2-НН может выпадать секреция надпочечниковых андрогенов.
В ряде случаев имеет место комбинация 1-НН и 2-НН, например у пациентов в критическом состоянии или при циррозе печени, когда отмечается нарушение стероидогенеза в надпочечниках и продукции АКТГ[1].
ЭТИОЛОГИЯ ВТОРИЧНОЙ НАДПОЧЕЧНИКОВОЙ НЕДОСТАТОЧНОСТИ
Причины 2-НН представлены в таблице 1.
Таблица 1
Этиология вторичной (центральной) надпочечниковой недостаточности[1–6]
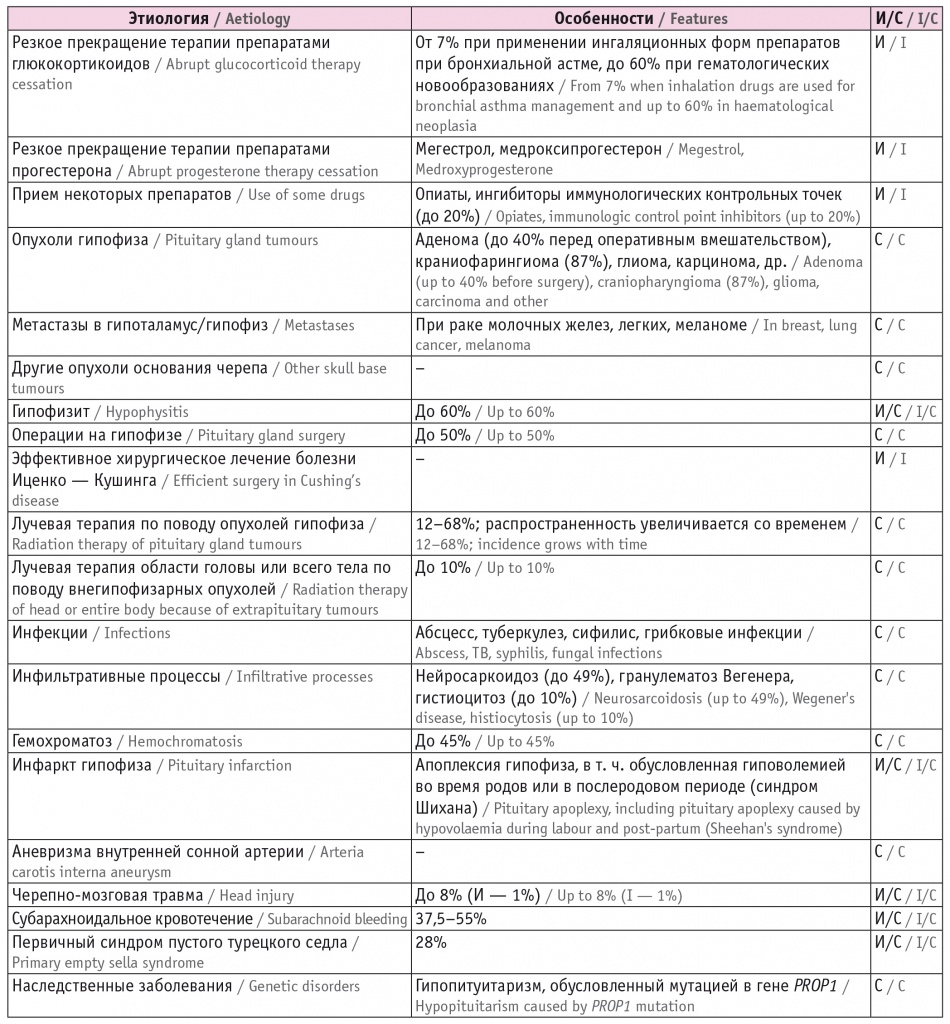
Примечание: И — изолированный дефицит адренокортикотропного гормона (АКТГ), С — дефицит АКТГ в сочетании с дефицитом других гормонов гипофиза.
Наиболее часто изолированная 2-НН развивается у пациентов, в течение длительного времени получающих препараты глюкокортикоидов в супрафизиологических дозах, при резком прекращении терапии[2]. Данная причина является основной в этиологической структуре 2-НН, так как глюкокортикоиды часто назначаются в клинической практике (лекарственные средства данной группы принимают до 2% населения)[1].
Развитие 2-НН в подобном случае обусловлено ингибированием по принципу обратной отрицательной связи секреции АКТГ гипофизом с последующей атрофией коры надпочечников[2, 7].
Риск 2-НН определяется множеством факторов, в т. ч. продолжительностью действия лекарственного препарата. Различают три группы кортикостероидов:
- короткодействующие (гидрокортизон, кортизон, дефлазакорт), вызывающие супрессию АКТГ в течение менее 36 ч;
- средней длительности действия (триамцинолон, преднизолон, метилпреднизолон), вызывающие супрессию АКТГ в течение примерно 48 ч;
- длительного действия (дексаметазон, бетаметазон), вызывающие супрессию АКТГ в течение более 48 ч.
Важно учитывать, что вариабельность длительности супрессии АКТГ не напрямую коррелирует с периодом полужизни гормона в плазме. Так, кортизол и дексаметазон со схожим периодом полужизни в плазме (90 и 100 минут соответственно) имеют различный период полужизни в тканях (8–12 ч и 36–54 ч соответственно)[7].
Необходимо отметить, что топические[8], ингаляционные[9, 10] и даже назальные (до 4% пациентов[1]) кортикостероиды и препараты для внутрисуставного введения[11], как и пероральные, могут вызвать супрессию гипоталамо-гипофизарно-надпочечниковой оси (ГГНО) при длительном применении. К супрессии ГГНО при использовании топических кортикостероидов более предрасположены молодые пациенты, а также те, у кого препарат наносится на кожу головы и складок, обрабатываются большие участки кожи и применяются окклюзионные повязки[2].
Риск супрессии ГГНО увеличивается при сопутствующей терапии препаратами, ингибирующими фермент CYP3A4 (например, ритонавиром при ВИЧ-инфекции), что приводит к увеличению концентрации экзогенных глюкокортикоидов[12]. Кроме того, 2-НН чаще развивается при ежедневной терапии.
В исследовании S. Jespersen и соавт., несмотря на лечение высокими дозами метилпреднизолона (включены 12 пациентов с эндокринной офтальмопатией), нарушение кортикотрофной функции гипофиза не зарегистрировано ни в одном случае. Наиболее вероятно, это обусловлено режимом пульс-терапии (1 раз в неделю)[13].
Другие факторы, определяющие риск супрессии кортикотрофов гипофиза, представлены в таблицах 2 и 3.
Таблица 2
Факторы, определяющие риск супрессии гипоталамо-гипофизарно-надпочечниковой оси при приеме препаратов глюкокортикоидов
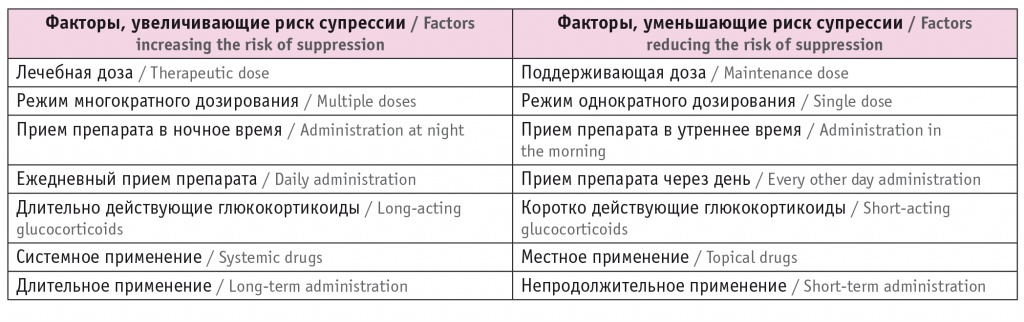
Таблица 3
Стратификация риска супрессии гипоталамо-гипофизарно-надпочечниковой оси (ГГНО) при терапии глюкокортикоидами (адаптировано из[2])
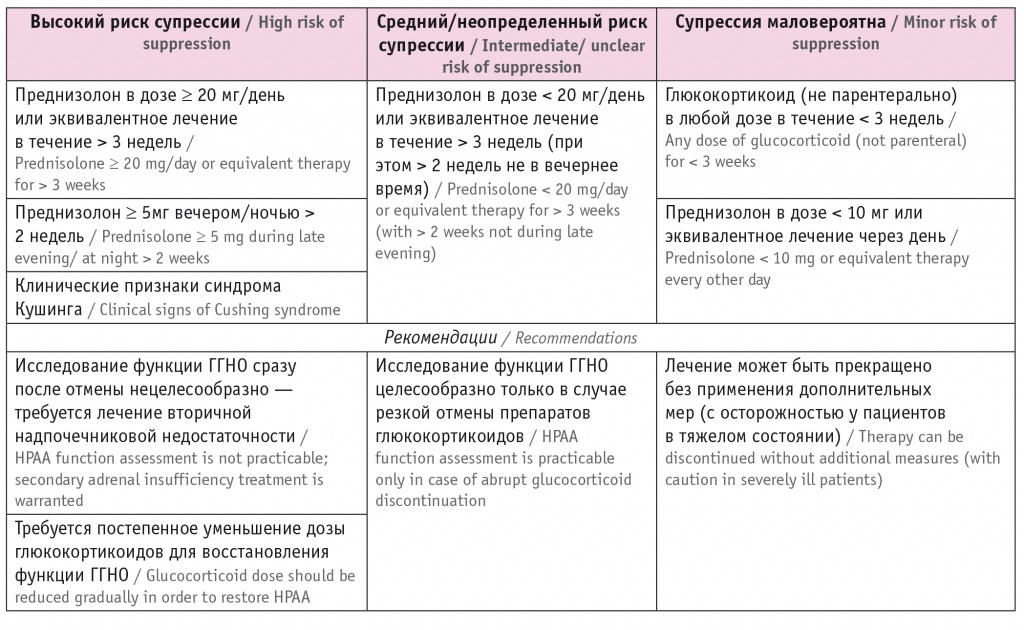
Необходимо отметить, что признаки 2-НН могут проявляться и на фоне продолжающейся терапии глюкокортикоидами, но при нарушении их абсорбции при пероральном приеме (например, при гастроэнтерите) или повышенной потребности (например, при травме), если доза препарата не достаточна для компенсации 2-НН[14]. Пациенты с 2-НН на фоне терапии глюкокортикоидами, как правило, имеют кушингоидные черты внешности[7].
Развитие 2-НН описано и при резкой отмене некоторых препаратов прогестеронов, например мегестрола, медроксипрогестерона, которые обладают выраженной глюкокортикоидной активностью (связываясь с рецепторами данных гормонов) и могут вызвать длительную супрессию ГГНО при продолжительном применении[2].
Опиоид-индуцированная 2-НН обусловлена супрессией ГГНО и встречается у 10–15% пациентов (по результатам стимулирующих тестов), в течение длительного времени получающих анальгетики данной фармакологической группы. Принципы диагностики и лечения не отличаются от таковых при 2-НН другой этиологии.
Согласно некоторым данным, прекращение терапии опиоидными анальгетиками может привести к восстановлению функции ГГНО. Однако минимальная доза опиоидов и длительность восстановления требуют уточнения[15]. В частности, A.S. Lee и S.M. Twigg сообщали о полном восстановлении функции ГГНО через 3 месяца после отмены опиоидов. Примечательно, что в данном случае причиной для диагностического поиска была выраженная гиперкальциемия, купированная после инициации заместительной терапии НН[16].
Изолированная 2-НН часто встречается при гипофизите[2] — гетерогенной группе заболеваний, включающей лимфоцитарный, IgG4-ассоциированный гипофизит; гипофизит, вторичный по отношению к инфильтративным инфекционным заболеваниям и терапии ингибиторами иммунологических контрольных точек, и др.[17]. Наибольший интерес представляет аутоиммунная форма заболевания, к которой относятся лимфоцитарный, IgG4-ассоциированный гипофизит, индуцированный терапией ингибиторами иммунологических контрольных точек, анти-PIT-1-гипофизит (не проявляется 2-НН), изолированный дефицит АКТГ[18]. Описан также случай паранеопластического синдрома, проявляющегося изолированным дефицитом АКТГ, у пациента с нейроэндокринной карциномой легких, экспрессирующей проопиомеланокортин (ПОМК). Развитие 2-НН в данном случае обусловлено антителами к ПОМК.
Не исключено, что бо’льшая распространенность изолированного дефицита АКТГ, чем других гормонов аденогипофиза, объясняется более частым формированием антител к этому гормону[18].
Необходимо отметить, что заболеваемость аутоиммунной формой 2-НН (как проявление гипофизита) в настоящее время увеличивается в связи с широким применением препаратов моноклональных антител-ингибиторов иммунологических контрольных точек: CTLA-4, PD-1 и PD-L1. Лекарственные средства данной группы устраняют «блок» иммунной системы, не позволяющий ей воздействовать на опухолевые клетки. У ряда пациентов это приводит к нарушению иммунной толерантности и возникновению нежелательных явлений (irAEs — immune-related adverse events[19]) с аутоиммунным поражением, в том числе и органов эндокринной системы.
Развитие гипофизита наиболее часто отмечается при комбинированной терапии препаратами, ингибирующими разные иммунологические контрольные точки, реже — при терапии анти-CTLA-4-антителами[20]. Клиническая картина и данные визуализации сходны с таковыми при первичном лимфоцитарном гипофизите (описаны ниже)[21].
Примечательно, что при лабораторном обследовании в ряде случаев может определяться повышение уровней АКТГ и кортизола в дебюте заболевания. Предположительно, этот феномен отражает деструкцию ткани гипофиза Т-клетками[22].
Ранее считалось, что эндокринные осложнения терапии моноклональными антителами являются необратимыми[23], однако S. Thapi и соавт. описали в 2019 г. пациента с раком почки, у которого на фоне комбинированной терапии ипилимумабом (ингибитором CTLA-4) и ниволумабом (ингибитором PD-1) развились 2-НН и гипогонадотропный гипогонадизм с последующим восстановлением функции гипофиза через несколько месяцев после отмены моноклональных антител[24].
Причиной 2-НН в ряде случаев также является синдром пустого турецкого седла. Первичный синдром пустого турецкого седла возникает при внутричерепной гипертензии (на фоне ожирения, апноэ во сне, АГ, беременности, родов, опухолей, венозных тромбозов, инфекций, мальформаций, идиопатической) и/или недостаточности диафрагмы седла. Вторичный синдром пустого турецкого седла обусловлен различными патологическим процессами в области турецкого седла, например уменьшением в размерах опухоли гипофиза после медикаментозного лечения, оперативного вмешательства, лучевой терапии; апоплексией аденомы гипофиза, некрозом гипофиза после родов, инфекций гипофиза, гипофизитом, черепно-мозговой травмой, врожденным гипопитуитаризмом[5].
Предполагается, что некоторые вирусы, в частности коронавирусы и вирусы гриппа, могут экспрессировать аминокислотные последовательности АКТГ хозяина (молекулярная мимикрия). Хозяин вырабатывает антитела против этих вирусных антигенов, которые также связываются с его собственным АКТГ, что ограничивает реакцию на стресс, препятствуя адекватной секреции кортикостероидов[25]. Таким образом, не исключается возникновение 2-НН после перенесенной вирусной инфекции.
В последнее время средства массовой информации и многие медицинские работники описывают так называемую «усталость надпочечников», возникающую вследствие длительных стрессовых ситуаций и предшествующую манифестации тяжелого гипокортицизма. Для диагностики данного состояния рекомендуется использовать разработанные J.L. Wilson и соавт. опросники, а также определять уровни базального кортизола крови, кортизола крови через 30 минут после пробуждения, кортизола суточной мочи, исследовать ритм кортизола слюны и даже проводить подавляющий тест с дексаметазоном. При подтверждении «диагноза» пациенту назначаются глюкокортикоиды.
Важно отметить, что все перечисленные методы не позволяют адекватно оценить функцию ГГНО, и ни в одном из исследований, изучающих так называемую «усталость надпочечников», не применяется «золотой стандарт» диагностики 2-НН — инсулинотолерантный тест. Кроме того, большинство исследований не выявили разницу в уровнях кортизола крови (в момент пробуждения и через 30 минут), слюны, АКТГ, дегидроэпиандростерона сульфата у пациентов с «усталыми надпочечниками» и условно здоровых лиц групп контроля.
Подчеркиваем, что большинство исследований «усталости надпочечников» носят описательный характер и опубликованы в журналах с низким импакт-фактором[26], а авторитетными сообществами эндокринологов, в т. ч. Endocrine Society[26]1, данный синдром не признается.
КЛИНИЧЕСКАЯ КАРТИНА ВТОРИЧНОЙ НАДПОЧЕЧНИКОВОЙ НЕДОСТАТОЧНОСТИ
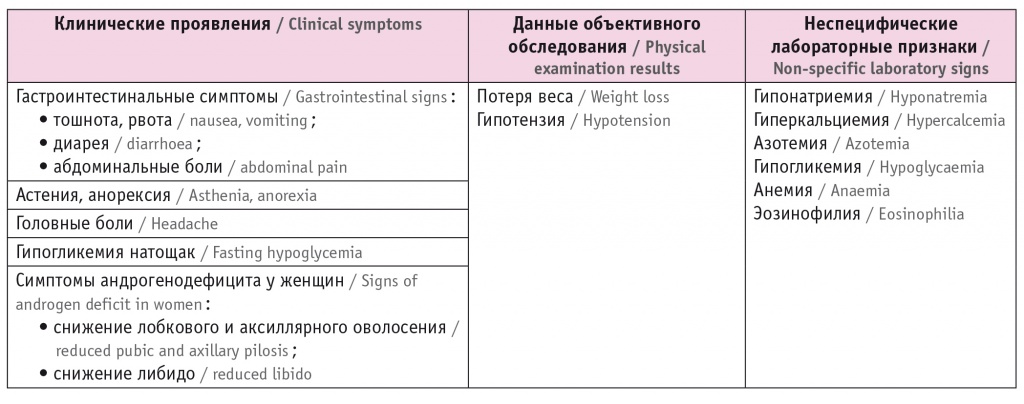
Клинические проявления и неспецифические лабораторные признаки 2-НН представлены в таблице 4.
Таблица 4
Клинические проявления и неспецифические лабораторные признаки вторичной надпочечниковой недостаточности[1]
СИНДРОМАЛЬНАЯ ДИАГНОСТИКА ВТОРИЧНОЙ НАДПОЧЕЧНИКОВОЙ НЕДОСТАТОЧНОСТИ
При подозрении на НН необходимо исследовать базальный кортизол крови утром[1, 2]. Уровень более 500 нмоль/л исключает диагноз НН, тогда как концентрация менее 100 нмоль/л (по данным некоторых авторов, менее 140 нмоль/л) предполагает наличие заболевания. При сомнительных значениях требуется проведение подтверждающих тестов, например пробы с инсулиновой гипогликемией (инсулинотолерантного теста) или с синтетическим аналогом АКТГ. Алгоритм проведения тестов описан в литературе[1, 2].
Инсулинотолерантный тест является «золотым стандартом» диагностики 2-НН[1]. Преимущества данного теста:
- высокие чувствительность и специфичность;
- возможность оценить функцию всей ГГНО, в том числе при небольшой длительности 2-НН (в отличие от пробы с синтетическим аналогом АКТГ);
- возможность одновременно исследовать соматотропную функцию гипофиза.
Недостатками пробы являются необходимость наблюдения медицинского персонала с целью предупреждения выраженной гипогликемии и наличие противопоказаний: сердечно-сосудистые и цереброваскулярные заболевания, беременность, эпилепсия; некоторые специалисты не рекомендуют выполнять тест лицам старше 60 лет[2].
В отличие от инсулинотолерантного теста, проба с синтетическим аналогом АКТГ не несет каких-либо рисков, и противопоказаний к ее проведению нет[2]. Согласно данным систематического обзора и метаанализа, тест обладает высокой специфичностью (93%), но низкой чувствительностью (64%)[27]. Недостаток данной пробы — возможность получения ложноотрицательных результатов при небольшой длительности заболевания[2].
Таким образом, с учетом высокого отношения правдоподобия для положительного результата теста (9,1) и низкого для отрицательного результата (0,39) применение этой пробы позволяет подтвердить диагноз 2-НН, но не исключить его [27]. Кроме того, для уменьшения риска получения ложноотрицательных результатов некоторые авторы предлагают вводить не стандартную дозу синтетического аналога АКТГ (250 мкг), а меньшую — 1 мкг[1]. Действительно, в таком случае чувствительность теста увеличивается (83%), но в то же время снижается его специфичность (86%)[27].
Необходимо отметить, что в настоящее время проведение теста с синтетическим аналогом АКТГ на территории Российской Федерации невозможно в связи с недоступностью препарата на фармакологическом рынке. В качестве альтернативы, особенно для пациентов, которым противопоказан инсулинотолерантный тест, предлагается проведение пробы с глюкагоном. Тест основан на способности глюкагона стимулировать секрецию АКТГ и позволяет оценить функцию всей ГГНО, а также продукцию гипофизом соматотропного гормона.
Во время пробы внутримышечно вводится глюкагон в дозе 1 мг с забором венозной крови для оценки содержания кортизола исходно и через 90, 120, 150, 180, 210, 240 минут. Уровень кортизола > 599 нмоль/л исключает НН, тогда как более низкие показатели не позволяют подтвердить диагноз (у 10–20% здоровых лиц кортизол на фоне пробы не достигает 599 нмоль/л)[2]. В связи с этим некоторые авторы предлагают другой диагностический уровень — 460 нмоль/л (167 нг/мл), при котором тест обладает чувствительностью 89% и специфичностью 79%[28].
Ключевым показателем, позволяющим дифференцировать 1-НН и 2-НН, является уровень АКТГ, который при 2-НН ниже или в пределах референсных значений (на уровне нижней границы)[2, 29]. При 1-НН концентрация АКТГ, напротив, выше референсных значений, дополнительно определяются низкий или низконормальный уровень альдостерона, повышение содержания ренина или активности ренина плазмы[29]. В ряде случаев уровень АКТГ при 2-НН может быть ложно завышенным вследствие связывания с гетерофильными антителами[30].
ЭТИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ВТОРИЧНОЙ НАДПОЧЕЧНИКОВОЙ НЕДОСТАТОЧНОСТИ
При 2-НН этиологическая диагностика зачастую предшествует синдромальной, поскольку обследование для оценки функции ГГНО, как правило, инициируется в связи с повреждением гипофиза. Необходимо отметить, что в раннем послеоперационном периоде (после хирургических вмешательств на гипофизе) проведение стимуляционного теста с АКТГ не рекомендуется в связи с возможным получением ложноотрицательных результатов из-за отсутствия атрофии коры надпочечников. С другой стороны, после операции может иметь место незначительное транзиторное снижение функции кортикотрофов с последующим ее восстановлением через несколько месяцев, поэтому проведение инсулинотолерантного теста также не рекомендуется. Таким образом, при уровне базального кортизола в пределах значений, не позволяющих исключить НН, требуется назначить гидрокортизон в физиологических дозах с повторной оценкой функции ГГНО через 2 месяца[2].
При отсутствии анамнестических данных, указывающих на повреждение гипофиза, следует исключить другие причины гипопитуитаризма. В случае изолированной 2-НН нужно в первую очередь исключить прием препаратов, оказывающих влияние на ГГНО[2]. Необходим тщательный опрос о приеме различных биологически активных добавок, которые могут содержать глюкокортикоиды[31].
При исключении приема препаратов, вызывающих супрессию ГГНО, требуется провести визуализирующие исследования гипоталамо-гипофизарной области (методом выбора является МРТ). Как отмечалось ранее, изолированная 2-НН часто встречается при лимфоцитарном гипофизите. В то же время изолированное нарушение функции кортикотрофов при отсутствии поражения других клеток гипофиза у пациентов с аденомой наблюдается в исключительных случаях (критерии дифференциальной диагностики приведены ниже)[2]. Необходимо отметить, что при аутоиммунном поражении гипофиза данные визуализирующих исследований могут меняться со временем (на ранних стадиях — увеличение размеров железы, однако по мере ее деструкции — частично или полностью пустое турецкое седло)[32].
При отсутствии изменений гипофиза, по данным МРТ, диагностируется так называемая идиопатическая изолированная 2-НН[2]. Предполагается, что развитие заболевания в подобном случае обусловлено аутоиммунной деструкцией кортикотрофов.
Это предположение основано на данных о высокой частоте аутоиммунных патологий в указанной когорте больных. А.А. Kasperlik-Załuska и соавт.[32], обследовавшие 151 пациента с изолированной 2-НН, у 73% из них выявили сопутствующие аутоиммунные заболевания: наиболее часто — тиреопатии (первичный гипотиреоз и гипертиреоз), реже — витилиго и преждевременное истощение яичников. Другой группой исследователей (L. Manetti и соавт.) антитела к ткани гипофиза обнаружены у 11,4% пациентов с аутоиммунными тиреопатиями[33].
Необходимо отметить, что, поскольку случаи манифестации наследственных вариантов изолированной 2-НН (обусловленных мутациями в генах POMC и TPIT) во взрослом возрасте не описаны, генетическое тестирование взрослым пациентам с заболеванием неясного генеза не рекомендуется[2].
При сочетании 2-НН с другими видами недостаточности гипофиза в первую очередь показано проведение визуализирующих исследований для исключения опухолевого поражения в гипоталамо-гипофизарной области, особенно макроаденомы гипофиза. Важно дифференцировать аденомы гипофиза и другие причины 2-НН — лимфоцитарный или аутоиммунный гипофизит, так как тактика ведения пациентов при данных патологиях различается. Точный диагноз может быть установлен только по данным гистологического исследования.
Однако зачастую клиническая картина, результаты лабораторного и инструментального обследования позволяют установить правильный диагноз, и необходимость в биопсии, как правило, не возникает. Так, лимфоцитарный гипофизит чаще возникает у женщин, особенно во время беременности и после родоразрешения, он также ассоциирован с другими аутоиммунными эндокринными заболеваниями. Аденомы гипофиза одинаково часто встречаются у пациентов обоих полов, не связаны с беременностью и родами и не ассоциированы с другими аутоиммунными заболеваниями.
При гипофизите наиболее частыми и ранними гормональными изменениями являются дефицит АКТГ и ТТГ, тогда как нарушение синтеза соматотропного гормона и гонадотропинов происходит реже и позже.
При макроаденомах последовательность нарушений обратная: вначале нарушается секреция соматотропного гормона и гонадотропинов, а затем ТТГ и АКТГ.
Несахарный диабет встречается относительно часто при гипофизите и в исключительных случаях — при аденомах гипофиза.
Существуют и отличия по данным визуализирующих исследований. Так, для гипофизита характерно диффузное симметричное увеличение гипофиза без отклонения его стебля и разрушения турецкого седла. При аденомах часто отмечается асимметричное увеличение гипофиза, иногда — отклонение стебля, разрушение турецкого седла. При контрастном усилении наблюдается диффузное и гомогенное накопление радиофармпрепарата при гипофизите и гетерогенное при аденомах. Воспалительный процесс в воронке и/или нейрогипофизе (инфундибулонейрогипофизит) ассоциирован с утолщением стебля гипофиза и потерей типичного сигнала от нейрогипофиза[2].
Остается открытым вопрос о необходимости определения антител к гипофизу для дифференциальной диагностики гипофизита и аденомы. Антитела к аденогипофизу обнаруживаются у 30–70% пациентов с лимфоцитарным гипофизитом, но их диагностическое значение остается неясным, так как с помощью разных методов получены противоречивые результаты. Более того, чувствительность и специфичность определения антител к гипофизу при измерении стандартным иммунофлуоресцентным методом ограничена. Эти антитела могут не обнаруживаться у пациентов с гистологически подтвержденным гипофизитом и выявляться у более чем 20% больных с макроаденомами гипофиза.
Некоторые авторы предполагают, что высокий уровень антител характерен для гипофизита, тогда как низкий свидетельствует о наличии макроаденомы. Необходимо также учитывать, что уровень антител снижается со временем[2].
При сочетании 2-НН с дефицитом других гормонов гипофиза и без изменений на МРТ примерно в 10% случаев имеет место так называемый «идиопатический гипопитуитарзим»[2].
ЛЕЧЕНИЕ ВТОРИЧНОЙ НАДПОЧЕЧНИКОВОЙ НЕДОСТАТОЧНОСТИ
Вне зависимости от этиологии 2-НН целью заместительной терапии глюкокортикоидами является максимально возможная имитация физиологического ритма эндогенной секреции кортизола. Суточная секреция эндогенного кортизола составляет 5–7,4 мг/м2, что эквивалентно 15–20 мг гидрокортизона при пероральном приеме, который рекомендован как препарат выбора при лечении пациентов с НН.
Для имитации циркадного ритма секреции кортизола суточная доза должна быть разделена на два или три приема. При длительных периодах голодания, например во время месяца Рамадан, предпочтителен прием длительно действующих глюкокортикоидов (преднизолона или дексаметазона). Возможна также комбинация: преднизолон утром, а гидрокортизон вечером. Желателен перевод на новую схему терапии за несколько недель до наступления месяца Рамадан под наблюдением лечащего врача[2].
В ряде стран для лечения пациентов с НН доступны препараты глюкокортикоидов с двойным и медленным высвобождением, которые в некоторой степени имитируют циркадный ритм секреции эндогенного кортизола. В сравнительном исследовании М. Quinckler и соавт., включавшем 50 пациентов с 1-НН и 2-НН, у больных, переведенных на гидрокортизон модифицированного высвобождения, показатели ИМТ и гликированного гемоглобина снизились, в то время как у больных, продолживших терапию гидрокортизоном стандартного высвобождения, не изменились[34].
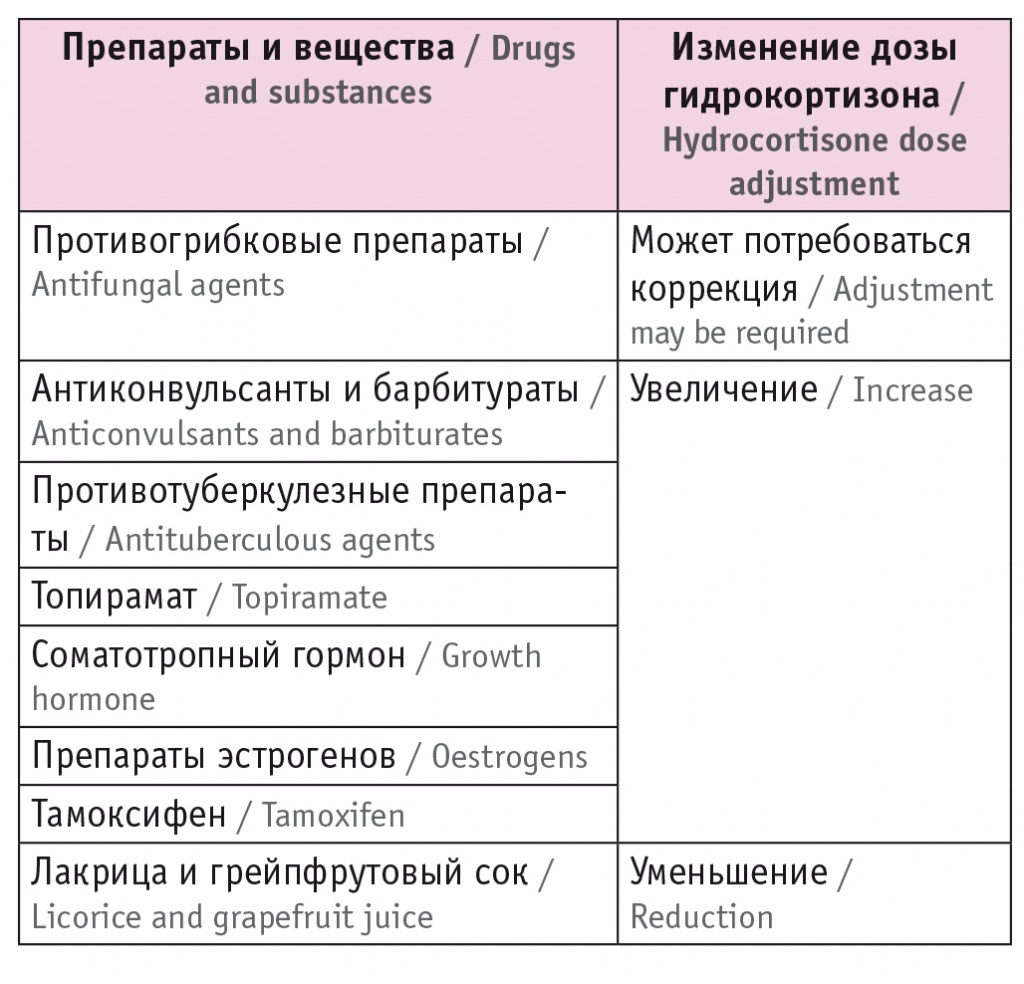
При назначении лечения необходимо учитывать прием различных препаратов, в частности оказывающих влияние на транспорт или инактивацию гидрокортизона посредством индукции фермента CYP3A4 (табл. 5). Контроль эффективности заместительной терапии глюкокортикоидами основан на клинических признаках, при этом исследование АКТГ и кортизола нецелесообразно. Определение концентрации кортизола сыворотки может быть рекомендовано исключительно при подозрении на некомплаентность или синдром мальабсорбции[2], а также после оперативного вмешательства на желудке[35].
Таблица 5
Препараты и вещества, оказывающие влияние на терапию гидрокортизоном (адаптировано из[2])
НАДПОЧЕЧНИКОВАЯ НЕДОСТАТОЧНОСТЬ И РИСК ИНФЕКЦИЙ, В ТОМ ЧИСЛЕ В ПЕРИОД ПАНДЕМИИ COVID-19
Некоторые авторы сообщали о повышенном риске развития инфекций у пациентов с НН, возможно, в связи с нарушением функционирования иммунной системы[36]. Однако, согласно результатам ретроспективного исследования M. Martino и соавт., в когорте из 121 пациента с НН COVID-19 диагностирован только у одного больного (распространенность — 0,8%)[37]. По предварительным данным, симптомы, подозрительные в отношении новой коронавирусной инфекции, одинаково часто встречаются у пациентов с 1-НН и 2-НН и у лиц группы контроля[36].
С учетом риска развития аддисонического криза заместительная терапия на фоне инфекционного заболевания (так же, как и при других условиях повышенной потребности в глюкокортикоидах[2]) должна быть скорректирована. Специфические рекомендации о вакцинации у пациентов с НН не разработаны[2]. Однако, согласно заявлению Society for Endocrinology, пациенты с НН не имеют повышенной вероятности побочных реакций при вакцинации2. С учетом рисков, ассоциированных с инфекциями у данной группы больных, им желательно предложить вакцинацию против вирусов гриппа и пневмококка, а также специфические вакцинации при выезде в некоторые страны[2].
ТАКТИКА ВЕДЕНИЯ ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ В ТЕЧЕНИЕ ДЛИТЕЛЬНОГО ВРЕМЕНИ ПРЕПАРАТЫ ГЛЮКОКОРТИКОИДОВ
Клиницистам следует тщательно мониторировать состояние пациента, получающего глюкокортикоиды, и разъяснить ему симптомы НН. Как отмечалось ранее, 2-НН может развиваться на фоне терапии глюкокортикоидами в условиях повышенной потребности в них. Таким пациентам может понадобится дополнительное введение гидрокортизона для профилактики аддисонического криза[14].
Кроме того, дополнительная постоянная терапия гидрокортизоном может потребоваться в тех случаях 2-НН, когда применяемый препарат глюкокортикоида не способен обеспечить необходимый системный эффект, например при ингаляционном введении. Важно отметить, что для оценки функции ГГНО на фоне продолжающегося приема глюкокортикоидов следует применять системы определения уровня кортизола методом иммуноанализа, не обладающие перекрестной реактивностью с лекарственными препаратами[10].
В настоящее время отсутствуют клинические рекомендации, основанные на принципах доказательной медицины, с разработанным алгоритмом снижения дозы глюкокортикоидов после длительной ежедневной терапии. Тактика ведения пациента определяется лечащим врачом[14]. В первую очередь требуется оценить риск супрессии ГГНО (см. табл. 3).
Постепенная отмена глюкокортикоидов включает в себя два шага: 1) уменьшение фармакологической дозы до физиологической; 2) снижение физиологической дозы до полной отмены. На первом этапе необходимо уменьшение дозы глюкокортикоида на 20–25% (в случае приема преднизолона) каждые 2 недели (или в течение большего промежутка времени) до достижения околофизиологических доз (3 мг/м2/сут). Далее требуется замена преднизолона на гидрокортизон в дозе 12 мг/м2/сут, разделенной на два приема (2/3 суточной дозы следует назначать на утро). При этом нужно тщательно мониторировать симптомы НН, особенно в стрессовых ситуациях, и разъяснять пациенту принципы коррекции дозы глюкокортикоидов в условиях повышенной потребности.
Далее доза гидрокортизона должна быть снижена на 20–25% каждые 1–2 недели. Но при появлении симптомов НН требуется вернуться к предыдущей дозе на 1 неделю или дольше. После достижения дозы гидрокортизона 5–6 мг/м2/сут или менее необходимо измерять ежемесячно уровень утреннего кортизола для оценки возможности отмены препарата.
Алгоритм дальнейшего обследования соответствует приведенному ранее по диагностике 2-НН[14]. В качестве диагностической пробы может применяться как тест с синтетическим аналогом АКТГ, так и инсулинотолерантный тест[7, 14]. В случае оценки функции ГГНО на фоне приема преднизолона в небольших дозах (например, 5 мг) возможно использование диагностического набора для определения уровня кортизола крови, обладающего низкой перекрестной реактивностью к данному препарату (Roche Elecsys Cortisol II assay)[38].
Необходимо отметить, что восстановление функции ГГНО иногда требует длительного времени — до 12–20 месяцев, соответственно заместительная терапия в физиологических дозах с коррекцией при интеркуррентных заболеваниях и в других стрессовых ситуациях нужна в течение всего этого периода. По мере восстановления функции ГГНО в первую очередь отмечается нормализация уровня АКТГ (через 2–5 месяцев), далее — утреннего кортизола (через 6–9 месяцев) и затем кортизола на фоне стимулирующего теста с АКТГ (через 9 месяцев)[14].
ЗАКЛЮЧЕНИЕ
Вторичная надпочечниковая недостаточность (2-НН) является тяжелым заболеванием с высоким риском развития аддисонического криза и летального исхода при несвоевременном и неправильном лечении[39]. Более того, 2-НН может быть первым клиническим проявлением новообразований, в т. ч. злокачественных[40]. Так как диагностика заболевания нередко затруднена (в связи с неспецифичностью симптомов[1]), требуется повышенная настороженность, особенно в отношении пациентов групп риска (в первую очередь длительно получающих препараты глюкокортикоидов). Вместе с тем следует избегать необоснованного назначения лечения при отсутствии верифицированного в соответствии с клиническими рекомендациями диагноза.
Поступила: 16.02.2021
Принята к публикации: 26.02.2021








