Кишечная микрофлора — высокоорганизованная система, реагирующая качественными и количественными изменениями на состояние организма в различных условиях жизнедеятельности, здоровья и болезни. В настоящее время отмечается повсеместное возрождение интереса к кишечной микрофлоре, ее влиянию на здоровье и болезни человека. Развитие новых молекулярно-генетических технологий, позволяющих идентифицировать многочисленные виды бактерий, которые не поддаются культивированию, послужило стимулом для углубленного изучения микрофлоры человека. Внешние факторы могут в значительной степени изменять таксономический и функциональный состав микрофлоры, способствуя развитию различных заболеваний, в том числе сахарного диабета, неалкогольной болезни печени, ожирения. К таким факторам в полной мере можно отнести этанол [8].
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ЭТАНОЛА
Избыточный бактериальный рост и дисбиоз кишечника
Алкоголь приводит к избыточному бактериальному росту в тонком кишечнике. Это неоднократно было продемонстрировано в различных исследованиях. Например, почти у половины больных алкоголизмом в аспирате тощей кишки обнаружено увеличение общего числа бактерий с преобладанием анаэробных микроорганизмов [10]. Сходная картина выявлена у пациентов с алкогольным циррозом печени. В более поздних работах J. C. Bode и соавт. выявляли синдром избыточного бактериального роста (СИБР) у лиц, злоупотребляющих алкоголем, при помощи дыхательного водородного теста [8]. Аналогичные результаты получены T. Hauge и соавт., обнаружившими избыточный рост бактерий в двенадцатиперстной кишке больных алкоголизмом [18]. Наличие СИБР описано также в экспериментальных моделях алкогольной болезни печени (АБП) [34].
Предполагается, что в основе избыточного роста микроорганизмов лежат нарушение оттока желчи, дисмоторика кишечника, снижение кислотности в желудке и изменения иммунного статуса под влиянием этанола. CИБР может привести к повреждению слизистой оболочки тонкой кишки и нарушению всасывания витаминов (В1, В6, В12, А, Е, К, фолиевой кислоты), цинка и других нутриентов, что обусловливает истощение пациентов. Как у здоровых лиц, так и у больных алкоголизмом наблюдается нарушение всасывания воды и натрия после приема алкоголя [21].
В условиях интенсивного роста бактерии начинают усиленно метаболизировать этанол. В результате как в просвете кишечника, так и в портальном кровотоке повышается концентрация ацетальдегида — одного из решающих факторов в патогенезе АБП [6].
Помимо избыточного роста бактерий, алкоголь приводит к изменению таксономического состава микрофлоры — дисбиозу, который представляет собой дисбаланс в бактериальной композиции кишечника, нарушающий нормальное функционирование ЖКТ.
Клинические исследования показали, что у пациентов с алкогольным циррозом печени доля бактероидов (Bacteroidetes) в толстой кишке уменьшается, а число протеобактерий (Proteobacteria) увеличивается по сравнению с этими показателями у больных алкоголизмом без цирроза печени [24]. В другом исследовании у больных с продвинутой стадией АБП выявлялось более высокое содержание Prevotellaceae в кале, чем у пациентов с циррозом печени в исходе гепатита В или у здоровых лиц контрольной группы [13]. В исследованиях A. W. Yan и соавт. обнаружен обильный рост Bacteroidetes и Verrucomicrobia в слепой кишке мышей после внутрижелудочной подачи алкоголя в течение 3 недель, в то время как Firmicutes (в том числе Lactobacillus, Pediococcus, Leuconostoc и Lactococcus) преобладали в контрольной группе [34]. В исследовании L. Bull-Otterson и соавт. изучалось влияние алкоголя на кишечную микрофлору путем метагеномного анализа фекалий мышей [12]. Изначально доминировавшими штаммами были бактероиды и фирмикуты. Под влиянием алкоголя равновесие сместилось в сторону грамотрицательных протеобактерий (с 1% до 19%) и актинобактерий (с 0% до 18%).
Алкоголь меняет (увеличивает) pH в просвете толстого кишечника. Изменения среды могут изменить конкурентное преимущество различных бактериальных сообществ. Например, содержание в кишечной микробиоте Alcaligenes faecalis (тип протеобактерий), выживающих в условиях повышенного pH, увеличивается [9].
Изменения проницаемости кишечной стенки
Бактериальная транслокация — это миграция жизнеспособных бактерий из просвета кишечника в мезентериальные лимфатические узлы и портальный кровоток в результате нарушения барьерной функции кишечника. Прием алкоголя может увеличить проницаемость кишечной стенки как у здоровых людей, так и у пациентов с АБП [23].
Долгое время изучался вопрос, непосредственно ли этанол нарушает целостность кишечной стенки. Исследования in vitro продемонстрировали, что для нарушения кишечного барьера необходима концентрация этанола более 1% (по данным некоторых исследований, вплоть до 5%). Такая высокая концентрация этанола не может быть достигнута в дистальной части кишечника [14].
Исследования показывают, что решающую роль в нарушении барьерной функции кишечника играет продукт метаболизма этанола — ацетальдегид. Влияние последнего на кишечную проницаемость дозозависимо. В достижении необходимой концентрации ацетальдегида в просвете кишечника принимают участие и представители микробиоты. Кишечные бактерии наряду с эпителиоцитами расщепляют этанол до ацетальдегида (при этом доминирует роль бактерий), дальнейшее расщепление до ацетата протекает гораздо менее интенсивно. Это приводит к повышению уровня ацетальдегида в просвете кишечника [13].
Ацетальдегид воздействует на белки плотного и адгезионного контакта, которые сохраняют целостность кишечной стенки и препятствуют проникновению макромолекул через эпителиальный слой. К белкам плотного контакта (ПК) относятся окклюдины и клаудины. Под белками ПК располагаются белки адгезионного контакта. В их число входят кадгерины, внеклеточная часть которых в присутствии ионов кальция взаимодействует с подобной молекулой на соседней клетке, обеспечивая слипание клеток; белки-адаптеры, налаживающие связь между трансмембранными молекулами клеточной адгезии и элементами цитоскелета; пучки актиновых филаментов. Белки адгезионного контакта не составляют физического барьера для макромолекулярной диффузии, но регулируют целостность ПК [28] (рис.).
Рис. Схема взаимодействия белков в плотном и адгезионном контакте [2]
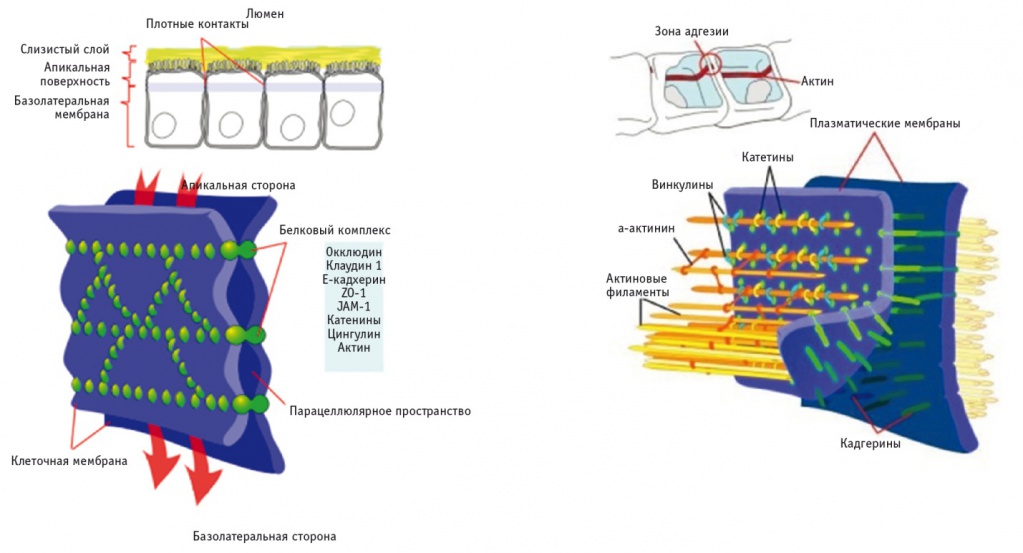
Разрушение плотного и адгезионного контакта ацетальдегидом продемонстрировано на модели Caco-2-клеток (клетки карциномы кишечника Caco-2 морфологически и функционально похожи на барьерный эпителий кишечника и успешно применяются для оценки проницаемости и абсорбции в ЖКТ, а также для изучения активного транспорта веществ) с использованием иммунофлюоресцентной микроскопии. Ацетальдегид вызывает перераспределение окклюдина и zonula occludens 1 (ZO-1) из межклеточных соединений и диссоциацию этих белков с актином цитоскелета, а также выводит E-кадгерин и β-катенин из межклеточных контактов, тем самым нарушая адгезионный контакт. Ацетальдегидиндуцированное перераспределение белков плотного и адгезионного контакта и отделение их от цитоскелета были выявлены в биоптате толстой кишки человека на фоне приема алкоголя [7].
Проведена оценка мРНК ключевых маркеров целостности ПК, а также белков-адаптеров ПК. Показано, что экспрессия мРНК ZO-1 и клаудина 1 (белки ПК) снижается в ответ на хронический прием этанола [7].
Роль оксида азота в нарушении барьерной функции кишечника
Признание роли NO в нарушении барьерной функции кишечника последовало за выявлением повышенной экспрессии синтетазы окиси азота (iNOS) в эпителии воспаленной слизистой оболочки кишечника, ассоциированной с повышенной проницаемостью кишечной стенки. В двух различных исследованиях A. Banan и соавт. продемонстрировали повышение экспрессии iNOS и увеличение продукции NO и О2- в человеческих Сасо-2-клетках под влиянием этанола (от 2,5% до 15%). Роль NO и О2- заключается в нитровании и окислении тубулина и в повреждении микротрубочек цитоскелета. При этом нарушение эпителиального барьера определяется путем измерения апикально-базолатерального потока флюоресцентного маркера [4]. Эпидермальный фактор роста может защитить и восстановить функцию кишечника путем стабилизации цитоскелета с помощью подавления активности iNOS [5].
Роль эндотоксемии в развитии алкогольной болезни печени
Нарушение проницаемости кишечной стенки приводит к «утечке» бактериальных эндотоксинов. В норме эндотоксины выводятся с калом и только незначительное количество их может проникать через кишечную стенку и попадать в кровоток. По различным данным, уровень эндотоксемии у больных АБП в 5-20 раз выше, чем у здоровых индивидов. Эндотоксины и эндотоксининдуцированные макрофаги, в свою очередь, повышают проницаемость кишечной стенки, тем самым замыкая порочный круг.
Клинические и экспериментальные исследования показали, что эндотоксины, поступившие в кровоток из кишечника, играют важную роль в развитии АБП [8, 10, 11]. Уровень эндотоксемии коррелирует с уровнем противовоспалительных цитокинов и степенью поражения печени [24]. Эндотоксины, наряду с этанолом, приводят к активации как печеночных (клетки Купфера), так и внепеченочных макрофагов и продукции провоспалительных цитокинов, таких как ФНО-α, ИЛ-6, ИЛ-1.
Активация клеток Купфера эндотоксинами происходит посредством двух типов рецепторов — CD14 и TLR4. CD14 — это поверхностный рецептор без цитоплазматического домена, TLR4 — трансмембранный белок с цитоплазматическим доменом, который нековалентно связан с белком MD2. CD14 связывает липополисахариды (ЛПС), далее этот комплекс распознается TLR4. CD14 имеет растворимую форму, которая облегчает трансфер ЛПС в комплекс TLR4/MD2. Связь между CD14 и ЛПС осуществляется посредством ЛПС-связывающего белка [24].
Распознание ЛПС TLR4-рецепторами на поверхности макрофагов и других клеток печени ведет к включению нисходящих сигнальных путей, отвечающих за активацию транскрипционных факторов, таких как NF-kB и активирующий протеин 1. Этот процесс приводит к увеличению продукции провоспалительных цитокинов: ИФН-γ, ФНО-α, ИЛ-6, ИЛ-1, — хемокинов и активных форм кислорода [24]. Кроме того, активация TLR4 способствует фиброгенезу путем сенсибилизации звездчатых клеток печени.
Наряду с эндотоксинами, бактериальная ДНК, пептидо-гликаны и флагелины также попадают в кровоток и играют роль в прогрессировании АБП. Бактериальную ДНК выявляют в плазме крови больных алкогольным циррозом печени [15]. ДНК бактерий распознается TLR9-рецепторами и повышает чувствительность печени к эндотоксининдуцированному поражению.
ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ
Изучение этанолиндуцированных изменений микрофлоры кишечника приобретает значимость, так это может открыть новые пути лечения АБП. Например, антибактериальная терапия подавляет избыточный бактериальный рост и улучшает прогноз АБП. Оптимальными лекарственными средствами в этом случае могут быть рифаксимин, пенициллины, метронидазол, пероральные фторхинолоны. По поводу метронидазола данные противоречивы, так как его применение может привести к росту уровня ацетальдегида в просвете толстой кишки за счет подавления анаэробной флоры и увеличения содержания аэробных бактерий с избыточной экспрессией алкогольдегидрогеназы [32]. Под влиянием ципрофлоксацина, напротив, не только подавляется рост кишечной микрофлоры, но и происходит снижение уровня ацетальдегида и активности кишечной алкогольдегидрогеназы [33].
В эксперименте после приема пероральных антибактериальных препаратов широкого спектра действия (полимиксин B и неомицин) и пробиотиков (лактобактерий) не только резко снижался уровень эндотоксинов, но и уменьшалась тяжесть алкогольного поражения печени у крыс [6].
Данные об эффектах про-, пре- и симбиотиков при АБП получены в основном в экспериментальных исследованиях. L. rhamnosus Gorbach — Golding (LGG) является наиболее часто используемым пробиотиком. Одним из первых исследований, продемонстрировавших благоприятные эффекты приема пробиотиков, была работа A. A. Nanji и соавт., которые показали значительное снижение уровня эндотоксинов и тяжести алкогольного поражения печени у крыс на фоне приема лактобактерий [27]. В другом исследовании с использованием лактобактерий отмечено, что применение LGG значительно уменьшает повреждение ткани печени у крыс с алкогольным стеатогепатитом. Улучшение достигается за счет подавления миграции бактерий из кишечника и подавления окислительного стресса и воспаления как в кишечнике, так и в печени [17]. В работах E. Mutlu и соавт. показано, что ежедневное потребление алкоголя в течение 10 недель значительно меняет состав кишечной микрофлоры у крыс. Процесс удается предотвратить при одновременном приеме лактобактерий [26].
Пилотное исследование C. Loguercio и соавт., где лактобактерии применялись у пациентов с алкогольным циррозом печени, выявило статистически значимое улучшение печеночных проб в виде снижения уровня АЛТ, а также уменьшения содержания ФНО-α [23].
Escherichia coli (Nissle) восстанавливает баланс кишечной микрофлоры, уменьшает эндотоксемию и улучшает функцию печени [20]. Пробиотики содержащие Bifidobacterii и Lactobacterii, способствуют снижению уровня провоспалительных цитокинов при алкогольном циррозе печени [23]. Похожий положительный эффект показан в другом крупном исследовании, в котором применялись пробиотические препараты, содержащие Bifidobacterium bifidum и L. Plantarum [19]. Показано, что L. casei Shirota оказывают благотворное влияние на восстановление фагоцитарной способности нейтрофилов — маркера, низкий уровень которого ассоциирован с повышенным риском инфицирования и смерти при АБП [31] (табл.).
Таблица
Влияние пробиотиков на течение алкогольного заболевания печени
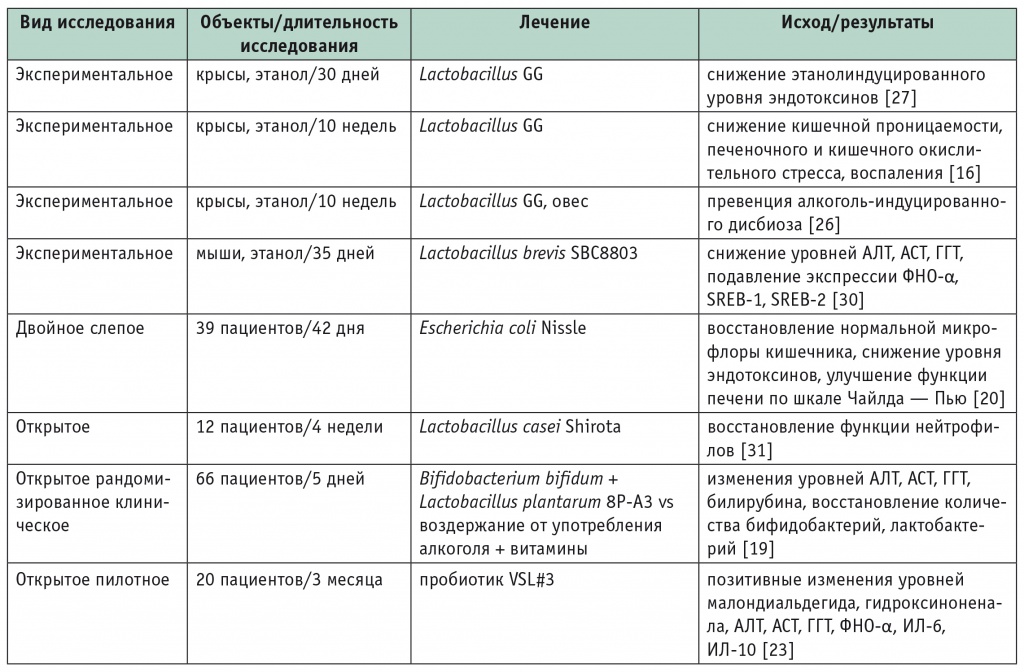
Примечание. АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ГГТ — гамма-глутамилтранспептидаза; ИЛ — интерлейкин; ЛДГ — лактатдегидрогеназа; ФНО — фактор некроза опухоли; SREB — sterol regulatory element-binding protein (белок, связывающий стеролрегулирующие элементы).
J. S. Bajaj и соавт. в рандомизированном контролируемом исследовании показали, что прием кисломолочного продукта с пробиотиками Streptococcus thermophilus, L. bulgaricus, L. acidophilus, Bifidobacteria и L. casei свыше 60 дней может привести к регрессу минимальный печеночной энцефалопатии у пациентов с неалкогольным циррозом печени [3].
При приеме пробиотиков может произойти не только регресс энцефалопатии, но и снижение уровней билирубина, аминотрансфераз и функционального класса цирроза печени по Чайлду — Пью [24]. Таким образом, клинико-экспериментальные данные о применении пре- и пробиотиков позволяют говорить о положительных клинических эффектах использования указанных групп препаратов при АБП, в том числе для регресса алкоголь-индуцированных изменений кишечной микрофлоры.
Учитывая изложенное выше, препаратом выбора для коррекции дисбиотических нарушений при АБП можно считать пробиотик Линекс — комплексный препарат со сбалансированным составом полезных живых лиофилизированных бактерий B. infantis, L. acidophilus и Enterococcus faecium. Применение пробиотика Линекс в комплексной терапии у пациентов с хроническими заболеваниями печени приводит к улучшению клинико-лабораторных показателей, иммунологического статуса, качества жизни [1].
Полагаем, что среди пробиотиков еще больший интерес может представлять новый препарат Линекс форте, в состав которого входят молочнокислые бактерии L. acidophilus (LA-5) и B. animalis subsp. lactis (BB-12) [25]. Известны механизмы, посредством которых LA-5 и BB-12 подавляют рост патогенных бактерий:
-
снижение рH в кишечнике (LA-5 продуцируют молочную кислоту, а ВВ-12 синтезируют молочную, уксусную и янтарную кислоты);
- выработка метаболитов, токсичных для патогенных бактерий (Н2О2);
-
синтез антибактериальных веществ и бактериоцина (LA-5 за счет продукции ацидоцина и бактериоцина ингибируют рост бактерий и грибов);
-
конкуренция с патогенными бактериями за продукты питания;
-
заполнение рецепторов адгезии.
Продемонстрировано благоприятное влияние BB-12 и LА-5 на микрофлору кишечника и местный иммунитет у здоровых лиц и пациентов с заболеваниями ЖКТ разноговозраста [1].
ЗАКЛЮЧЕНИЕ
Алкоголь может быть одним из основных факторов, влияющих на состав и функции микрофлоры кишечника. В число биологических эффектов этанола входят развитие синдрома избыточного бактериального роста в тонкой кишке, нарушение барьерной функции кишечника, а также таксономические изменения микрофлоры кишечника, которые заключаются в повышении роста грамотрицательных протеобактерий. Избыточный бактериальный рост в тонкой кишке, в свою очередь, может быть причиной нарушенного всасывания и дефицита нутриентов, а протеобактерии могут стать источником эндотоксинов, которые активируют клетки Купфера, способствуют синтезу провоспалительных цитокинов и воспалению печени, а также стимуляции фиброгенеза.
Экспериментальные и клинические исследования показали, что уменьшение этанолиндуцированной проницаемости кишечника, эндотоксемии и, как следствие, воспаления в печени может быть достигнуто с помощью антибиотиков и пре- и пробиотиков, что открывает возможность использования препаратов, направленных на восстановление кишечного микробиома, для эффективного лечения алкогольной болезни печени.








