Альвеококкоз — заболевание, развивающееся в результате попадания в организм и развития в нем личиночной стадии ленточного червя Echinococcus multilocularis. Впервые альвеококкоз печени описал немецкий ученый Franz Buhl в 1852 г., а паразитарный характер заболевания в 1855 г. доказал Rudolf Virchow, обнаружив протосколексы при микроскопическом исследовании [27]. По своим клинико-морфологическим особенностям альвеококкоз очень схож с раком печени. Паразитарная «опухоль» прорастает в окружающие органы и трубчатые структуры печени, обладает способностью к рецидивами, дает метастазы в головной мозг и легкие. При этом метастазирование осуществляется как по кровеносным, так и по лимфатическим путям. В конечном счете заболевание приводит к смерти больного. Отличие от злокачественных поражений печени заключается лишь в скорости развития процесса. Альвеококковая «опухоль» растет значительно медленнее раковой [8]. ВОЗ предложена классификация альвеококкоза, напоминающая онкологическую классификацию TNM, которая позволяет объективно оценить распространенность паразитарной ткани в печени (Р), учитывает вовлечение рядом расположенных органов (N) и наличие метастазов (M) [28]. Эта классификационная система дает возможность фиксировать стадии заболевания и, соответственно, сравнивать результаты лечения в различных медицинских учреждениях.
Бессимптомная стадия альвеококкоза, от момента инвазии паразита до появления развернутых жалоб и клинической симптоматики, может продолжаться 10 и более лет. Причем, в отличие от случаев злокачественной опухоли, больные могут долгое время не предъявлять жалоб на снижение аппетита и работоспособности, изменение веса; у пациентов с альвеококкозом отсутствуют признаки интоксикации [13, 25]. Резекция печени остается основным методом лечения альвеококкоза. Однако по приведенным выше причинам альвеококкоз чаще диагностируют на поздних стадиях — на момент первичной диагностики у 61,3-70% больных уже невозможно полностью удалить паразитарные массы [11, 14, 19, 20], вследствие чего исключена возможность выполнения радикальной резекции печени [17, 18, 26].
В связи с очень низкой резектабельностью при альвеококкозе представляется весьма перспективным использование криохирургических методов лечения этого заболевания. Возможность паллиативной резекции печени с оставлением в опасных зонах ворот печени и на нижней полой вене тонких пластин паразитарной ткани и последующим воздействием на нее криодеструктором делает такое оперативное вмешательство приближенным по непосредственным и отдаленным результатам к радикальной резекции.
Криохирургия — метод лечения, основной принцип которого заключается в локальном воздействии холода (в первую очередь с целью разрушения) на патологически измененные участки органов и тканей. Родоначальником применения криодеструкции печени следует считать K. Stucke [23], который начиная с 1966 г. в эксперименте в ряде клинических работ защищал метод и прогнозировал для него большое будущее в гепатологии. На XXIV Международном конгрессе хирургов в Москве (1971) он продемонстрировал видеофильм, в котором с помощью оригинального устройства (криодеструктора) разрушал в печени узлы альвеококка. В нашей стране впервые в клинической практике криохирургические методы при патологии печени, в том числе паразитарной, в 80-х годах прошлого века применили О. Б. Милонов с коллегами (Москва) [9] и Б. И. Альперович с коллегами (Томск) [3, 5].
К настоящему времени установлено, что основными факторами, повреждающими биологические структуры при воздействии низких температур, являются [6]:
-
внутри- и внеклеточная кристаллизация воды, сопровождающаяся дегидратацией внутриклеточных структур и биологических мембран в процессе замораживания и размораживания;
-
повышение концентрации электролитов, вызывающее денатурацию субклеточных структур;
-
кристаллизация внутримембранной воды и мембранных структур клетки, в первую очередь ядра, митохондрий и лизосом;
-
механическое повреждение структурных компонентов клетки за счет внутри- и внеклеточных кристаллизационных процессов.
Криотехнику целесообразно использовать для оперативных вмешательств в следующих случаях [2]:
1) при необходимости разрушения патологического очага в печени, особенно в труднодоступных зонах органа (область глиссоновых и кавальных ворот), где механическое воздействие исключается или представляет особую опасность; Э. И. Кандель [7] и I. S. Cooper [16] в экспериментах убедительно доказали, что криовоздействие в зоне крупных сосудов, даже ведущее к прекращению кровотока по этим сосудам, не прекращает циркуляцию крови по ним после оттаивания (в случае гибели участка ткани сосудистой стенки после криовоздействия остается соединительнотканный каркас стенки сосуда, на котором происходят процессы регенерации с восстановлением интимы, поэтому криовоздействие в зоне ворот печени не представляет опасности для больного);
2) чтобы предотвратить диссеминацию паразитарных элементов во время операции, т. е. для повышения абластичности операции и предупреждения рецидивов.
Российскими исследователями выделены следующие варианты криохирургических воздействий при альвеококкозе [4]:
-
криорезекция печени: криорезекция посредством криоскальпеля и/или криоультразвукового скальпеля, резекция печени посредством собственно криодеструкции;
- паллиативная резекция печени с криодеструкцией остающейся ткани паразита;
-
дренирующие операции альвеококкозных каверн с криодеструкцией их стенок;
-
криодеструкция патологической ткани альвеококка в нерезектабельных случаях.
В клинике кафедры хирургических болезней Сибирского государственного медицинского университета (г. Томск), имеющей наиболее значительный в нашей стране опыт хирургического лечения больных альвеококкозом печени, было осуществлено 64 повторных операции при альвеококкозе с криодеструкцией. Их проводили как после пробных вмешательств, сделанных в других лечебных учреждениях (две трети пациентов), так и после паллиативных операций, выполненных ранее в клинике. Б. И. Альперович и соавт. пришли к выводу о целесообразности использования повторных вмешательств при альвеококкозе и необходимости многократного криовоздействия во время операций на паразитарную ткань сверхнизкими температурами, что значительно улучшает их исходы. Паллиативные резекции печени с криодеструкцией приводят к длительной ремиссии и позволяют продлить жизнь пациентов на 10-12 лет [1].
В Институте хирургии им. А. В. Вишневского (г. Москва) методика криодеструкции применяется с 2012 г. и к настоящему времени накоплен опыт применения криохирургии при лечении больных альвеококкозом.
Цель исследования: определить возможности комбинированного оперативного лечения альвеококкового поражения печени и роль УЗИ на разных его этапах.
МАТЕРИАЛЫ И МЕТОДЫ
Изучены результаты предоперационного обследования и лечения 17 пациентов, наблюдавшихся с 2012 по 2015 г.: 10 (58,8%) мужчин и 7 (41,2%) женщин в возрасте от 19 до 76 лет со значительным распространением альвеококкового поражения печени. Всем пациентам выполняли УЗИ на разных этапах лечения: дооперационно, интраоперационно (для контроля/уточнения объема резекции и криодеструкции), послеоперационно. УЗИ делали в В-режиме, режимах дуплексного сканирования (цветового допплеровского картирования, энергии отраженного допплеровского сигнала и импульсной допплерографии), при необходимости выполняли трехмерную реконструкцию ультразвукового изображения.
Всем больным проведено комбинированное хирургическое лечение с применением криодеструкции. При оперативном вмешательстве использовали криохирургические аппараты для абдоминальной хирургии: КриоМТ («ИК Биомедстандарт», Москва), КРИО-01 (Елатомский приборный завод) и пористо-проницаемые аппликаторы из никелида титана (НИИ медицинских материалов, Томск). Данные аппараты предназначены для воздействия на различные новообразования в любых органах человека. Они обеспечивают стабильную температуру на поверхности инструмента в пределах от 0 до -190 °С в течение всего времени, необходимого для воздействия, и быстрый его отогрев. Использовали криоаппликаторы диаметром от 2 до 5 см. Целевая температура составляла -186 °С.
В послеоперационном периоде все пациенты получали терапию антигельминтными препаратами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В исследование вошли 11 (64,7%) пациентов с первичным альвеококковым поражением и 6 (35,3%) с рецидивами заболевания после ранее выполненных резекций печени различного объема (преимущественно гемигепатэктомии).
При анализе данных предоперационного обследования пациентов были получены результаты, представленные в таблице.
Таблица
Объем альвеококкового поражения и оперативного лечения у обследованных больных
Примечание. Серым цветом выделены графы пациентов с рецидивным поражением.
Критериями определения тактики лечения считали:
-
локализацию;
- вовлечение магистральных сосудов печени в патологический процесс;
-
вовлечение желчных протоков в патологический процесс;
-
объем поражения.
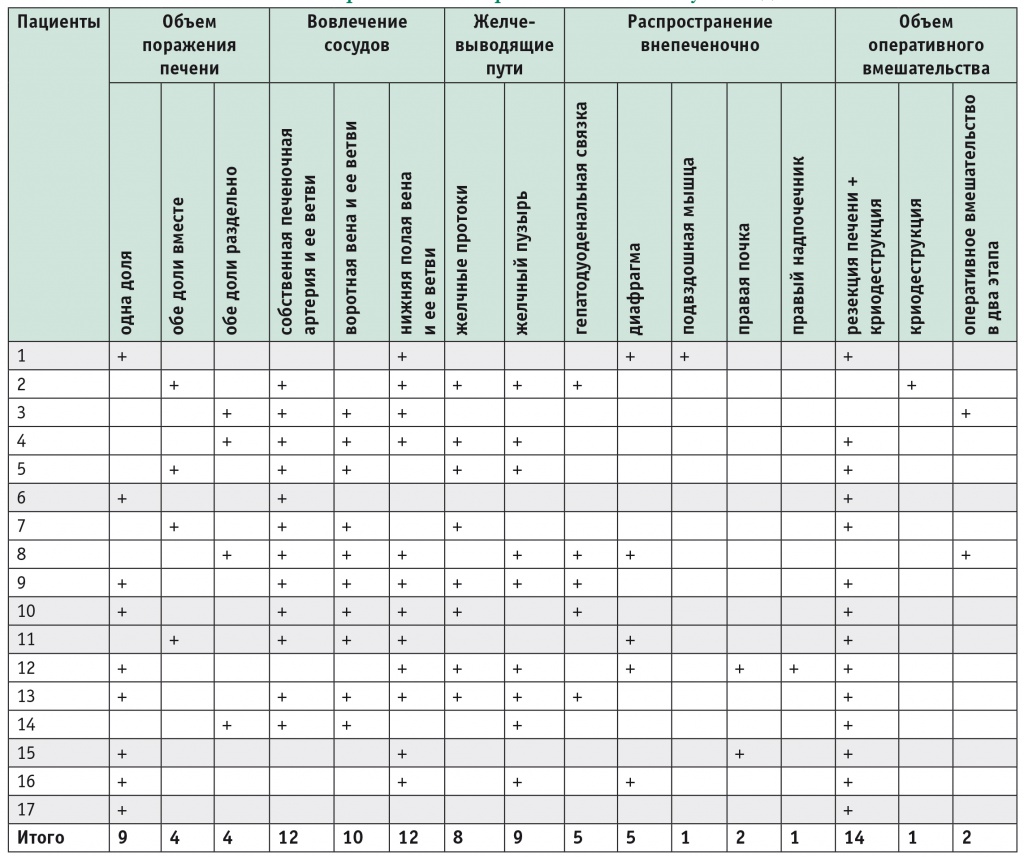
Одна доля печени была поражена у 9 пациентов, при этом у 5 из них — после ранее перенесенной резекции печени; поражение распространялось одновременно на обе доли печени у 4 больных; раздельное поражение обеих долей печени также было выявлено у 4 больных (рис. 1).
Рис. 1. Ультразвуковое изображение альвеококкового поражения печени, раздельное поражение обеих долей печени. Фото авторов.
Примечание. A — альвеококковый узел; AHD — правая ветвь собственной печеночной артерии; VPD — правая ветвь воротной вены; VPS — левая ветвь воротной вены
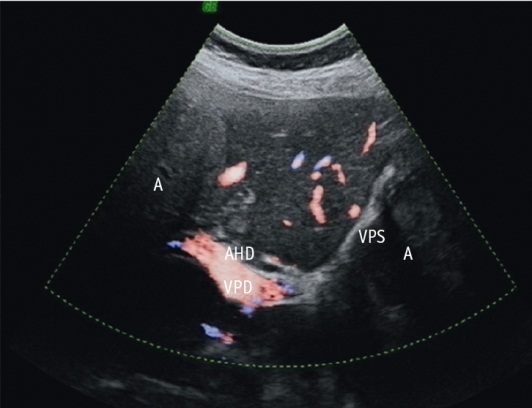
При оценке вовлечения магистральных сосудов печени обнаружилось, что вены были поражены чаще: нижняя полая вена и ее ветви — у 12 (рис. 2А, Б); воротная вена и ее ветви — у 10 (рис. 2В, Г); печеночная артерия и ее ветви — у 12 больных. Одновременно вены системы воротной и нижней полой вен были вовлечены в ткань паразита у 7 пациентов; одновременно вены системы воротной и/или нижней полой вены и печеночные артерии — у 11 человек.
Рис. 2. Ультразвуковое изображение вовлечения магистральных сосудов печени в патологический процесс при альвеококкозе печени. Фото авторов.
Примечание. А — вовлечение нижней полой вены (A — альвеококк, IVC — нижняя полая вена, VP — воротная вена), В-режим; Б — вовлечение нижней полой вены, прорастание правой и срединной печеночных вен и устья левой печеночной вены (AL — альвеококк, HEPAR — печень, VHS — левая печеночная вена), В-режим; В — поражение стенки ствола воротной вены (T — альвеококк, VP — воротная вена, метки 1 и 2), режим цветового допплеровского картирования; Г — поражение правой ветви воротной вены (VPD, поражение показано стрелками), В-режим
Критериями инвазии в сосудистую стенку следует считать:
-
неровный контур сосуда;
- турбулентный поток в зоне прилегания паразита к сосуду;
-
непосредственную инвазию в просвет.
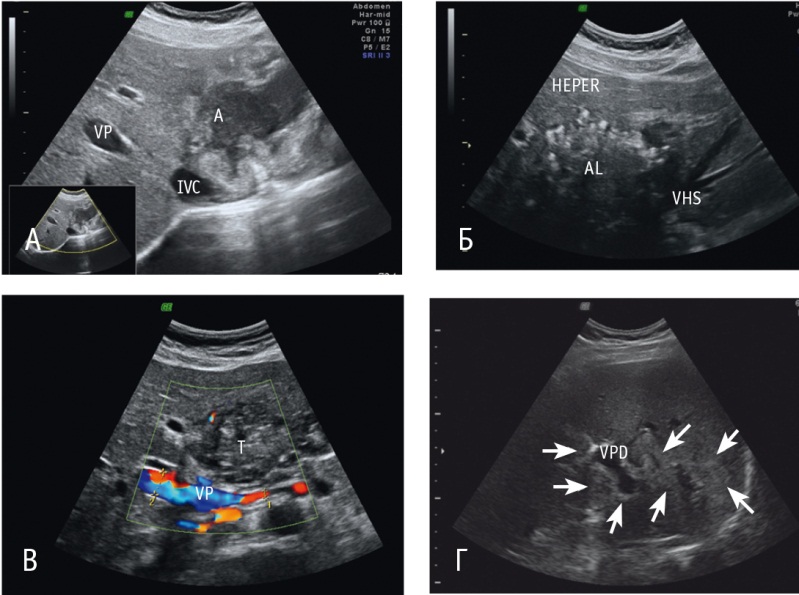
При оценке состояния желчевыводящей системы печени выявили вовлечение: желчных протоков на различных уровнях — у 8 больных (рис. 3), желчного пузыря — у 9 пациентов. Одновременное поражение желчных протоков и желчного пузыря диагностировали у 6 человек. В случае если возникали затруднения в определении состояния желчного дерева, выполняли МРТ в режиме магнитно-резонансной холангиопанкреатографии (рис. 4).
Рис. 3. Ультразвуковое изображение альвеококкового узла, вовлекающего сосудисто-секреторную ножку левой доли печени, расширение сегментарного долевого протока, В-режим. Фото авторов
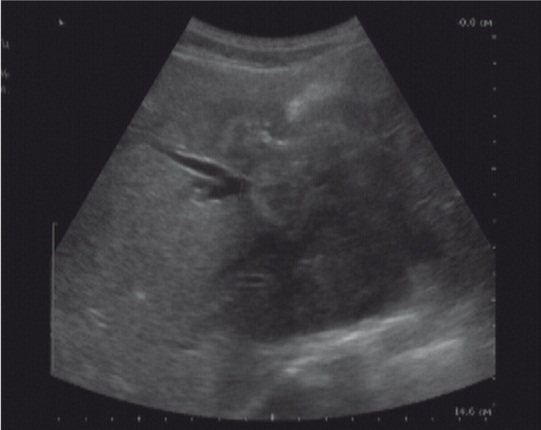
Рис. 4. Магнитно-резонансная холангиопанкреатограмма, билиарная гипертензия с разобщением протоков правой и левой долей печени альвеококковым узлом. Фото авторов
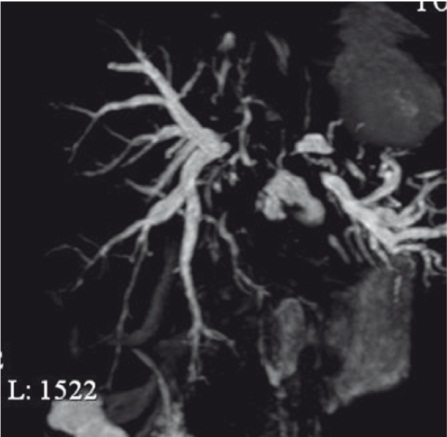
Кроме состояния сосудисто-секреторной системы печени, для определения тактики лечения пациентов необходимо оценить распространение альвеококкового поражения за ее пределы. Было выявлено распространение патологического процесса на диафрагму у 5 больных, на гепатодуоденальную связку — у 5 (рис. 5), на подвздошную мышцу справа — у 1 (рис. 6), на правую почку — у 2, на правый надпочечник — у 1 больного. УЗИ позволяет достаточно точно определить распространение альвеококка за пределы печени. Эффективным является исследование с форсированным вдохом и выдохом, которое дает возможность оценить смещение органов и структур относительно печени и находящегося в ней патологического образования.
Рис. 5. Ультразвуковое изображение альвеококкового поражения по ходу гепатодуоденальной связки с распространением на чревный ствол и его ветви. Фото авторов.
Примечание. AHP — общая печеночная артерия; AL — селезеночная артерия; C — кисты; IVC — нижняя полая вена; TC — чревный ствол
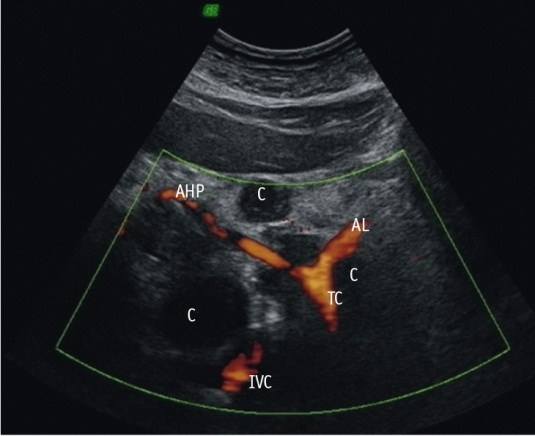
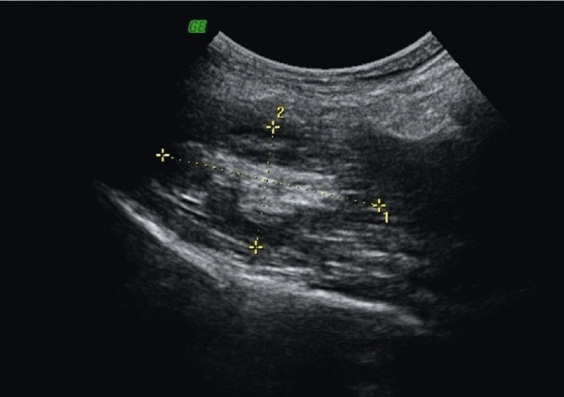
Рис. 6. Ультразвуковое изображение альвеококкового узла в подвздошной мышце в В-режиме (указано метками). Фото авторов
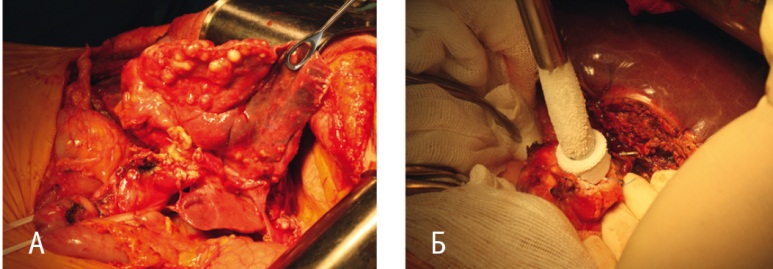
Выявленный объем поражения вследствие его значительности и вовлечения магистральных сосудов и протоков печени не позволял проведение радикального оперативного вмешательства. Были выполнены паллиативные комбинированные циторедуктивные операции с криодеструкцией остающейся ткани паразита (рис. 7). Объем хирургических вмешательств: резекция печени с криодеструкцией — у 14 пациентов, только криодеструкция — у 1 больного после ранее перенесенной гемигепатэктомии; у 2 пациентов с раздельным поражением обеих долей печени оперативное вмешательство с криодеструкцией производили в два этапа.
Рис. 7. Этапы оперативного вмешательства. Фото авторов.
Примечание. А — ревизия органов брюшной полости, внешний вид паразитарного поражения гепатодуоденальной связки; Б — криодеструкция альвеококкового узла
Считают, что процессы деструкции тканей более значительны при их быстром замораживании и медленном оттаивании. Повторное криовоздействие, выполненное сразу же после размораживания тканей, усиливает степень криодеструкции, увеличивая период нахождения их в зоне критических температур, а следовательно, увеличивается интенсивность процессов кристализации и рекристаллизации. Необходимость применения такой методики связана и с тем, что опухолевые клетки могут обладать высокой резистентностью к замораживанию. Кроме того, замороженная, а затем оттаявшая ткань способна увеличить свою теплопроводность на 20%. При проведении дальнейших циклов теплопроводность еще более увеличивается. Это дает возможность в более полном объеме проморозить труднодоступные участки опухолевой ткани, особенно если они находятся вблизи крупных кровеносных сосудов [12].
Эффективность криовоздействия зависит от [4]:
- скорости охлаждения;
-
величины и глубины заморозки ткани;
-
длительности экспозиции заморозки;
-
особенностей кровоснабжения органа и индивидуальной устойчивости ткани к холоду;
-
наличия крупных магистральных сосудов и важных для жизнедеятельности близлежащих органов и тканей.
Криодеструкцию выполняли под контролем УЗИ. Задачи интраоперационного УЗИ при криодекструкции:
-
достижение наиболее полной ревизии;
контроль за установкой криозондов, криоаппликатора и термоиндикаторов;
-
мониторирование распространения фронта замерзания и характера кровотока в прилежащих сосудах.
Определены этапы ультразвукового контроля и диагностические характеристики изменений, происходящих в тканях при криовоздействии: 1) навигация; 2) формирование iceball; 3) оттаивание; 4) этап после удаления аппликатора.
В ближайшем послеоперационном периоде были выявлены следующие осложнения: абсцесс печени — у 1; желчеистечение в брюшную полость — у 1 (оперативное лечение); гидроторакс — у 4 (проводили пункционное лечение под контролем УЗИ); жидкостные скопления различной локализации и объема — у 12 больных (в 8 случаях потребовалось пункционное лечение под контролем УЗИ). Был один летальный исход на 4-е сутки от острой почечной недостаточности.
В отдаленном послеоперационном периоде возникли другие осложнения: желчные свищи — у 2 (потребовали хирургического лечения); стриктуры желчных протоков — также у 2 пациентов (выполнено стентирование). Обнаружение этих осложнений потребовало подтверждения данных по результатам магнитно-резонансной холангио-панкреатографии.
В проведенном нами исследовании при динамическом наблюдении в сроки от 2 месяцев до 3,5 года на фоне приема антигельминтных препаратов прогрессирование процесса не наблюдалось. Следует отметить, что рубцовые изменения в зоне оперативного вмешательства могут имитировать рецидив заболевания. Сложность при дифференциальной диагностике представляют схожесть ультразвуковой картины паразита и фиброзных изменений в В-режиме и отсутствие кровотока, характерное для обоих состояний. При трудности дифференциальной диагностики целесообразно дополнять обследования КТ или МРТ.
Таким образом, альвеококкоз печени остается хирургически зависимым заболеванием. Радикальная резекция печени при альвеококкозе способна полностью излечить большинство больных и дает хорошие результаты в отдаленном периоде. При использовании современных методов исследования проблемы постановки правильного диагноза не существует, однако длительная бессимптомная стадия развития паразита и отсутствие скрининговой системы приводят к обнаружению заболевания на поздних стадиях. Как следствие, на момент постановки диагноза в большинстве наблюдений исключается возможность выполнения радикальной операции. Результаты проведенного нами исследования подтверждают данные литературы [8, 10], согласно которымвозможность паллиативной резекции печени с оставлением в опасных зонах ворот печени и на нижней полой вене тонких пластин паразитарной ткани с последующим воздействием на нее криодеструктором делает такое оперативное вмешательство весьма приближенным по непосредственным и отдаленным результатам к радикальной резекции печени. Целесообразно более активное распространение методов локальной деструкции в хирургических клиниках.
УЗИ благодаря своей широкой распространенности, отсутствию лучевой нагрузки и низкой стоимости является методом выбора при проведении массовых скринингов и динамического наблюдения за послеоперационными и получающими консервативное лечение пациентами с альвеококкозом печени [15, 21, 24]. В клиниках, где было обследовано и пролечено значительное число больных альвеококкозом печени [22], специалисты ультразвуковой диагностики имеют большой опыт выявления данной патологии, что позволяет проводить всестороннюю дооперационную оценку патологического процесса с применением всех возможных методик. Однако в случаях затруднения в верификации патологического процесса, чаще всего имеющих место при вовлечении желчевыводящих путей или выявлении рецидива паразита, исследование следует дополнять КТ, которая более распространена, или, что предпочтительнее, МРТ.
ЗАКЛЮЧЕНИЕ
Использование комбинации резекции печени с криодеструкцией остающейся ткани паразита, особенно в ходе повторных хирургических вмешательств, можно считать радикальным методом лечения альвеококкоза печени. Риск развития печеночной недостаточности в ближайшем послеоперационном периоде не является поводом для отказа от радикального лечения. Отсутствие признаков рецидива паразитарного поражения может быть показанием к выполнению оперативного лечения в данном объеме при альвеококкозе, в частности при повторных вмешательствах. Ультразвуковое исследование в клиниках, где накоплен значительный опыт диагностики и лечения альвеококкоза, — эффективный метод диагностики этой патологии, особенно при оценке поражения магистральных сосудов печени, он позволяет уточнить интраоперационную ситуацию и мониторировать криовоздействие, а также дает возможность динамического наблюдения за послеоперационными осложнениями.








