Железодефицитная анемия (ЖДА) — хроническое полиэтиологичное заболевание, развитие которого обусловлено дефицитом железа в организме вследствие нарушения поступления, усвоения или повышенных потерь этого микроэлемента. По данным Всемирной организации здравоохранения, ЖДА имеется более чем у 2 млрд человек по всему миру, большинство из которых — женщины и дети. Согласно опубликованному масштабному исследованию глобального бремени болезней за период с 1990 по 2016 г., ЖДА является одной из пяти основных причин сокращения продолжительности активной жизни, а у женщин — первой причиной[1].
По данным Росстата, в Российской Федерации наблюдается высокая распространенность анемии: в 2020 г. заболевание было зарегистрировано у 1406,8 тыс. человек, впервые диагноз анемии установлен у 438,9 тыс. человек[2]. Среди регионов Российской Федерации наибольшая распространенность анемии на 100 тыс. населения в 2020 г. зафиксирована в Приволжском (1207,3), Сибирском (1089,1) и Уральском (1057,4) федеральных округах[2].
Наиболее часто с проблемой ЖДА в амбулаторной практике сталкиваются терапевты, врачи общей практики, гематологи и акушеры-гинекологи женских консультаций. Среди женщин с завершившейся беременностью анемией, по данным 2020 г., страдали 35,5%[2]. Нередко ЖДА встречается и в практике врачей-гастроэнтерологов, поскольку практически любое эрозивно-язвенное поражение желудочно-кишечного тракта (ЖКТ) может стать причиной хронической кровопотери и привести к развитию анемического синдрома[3].
Верификация этиологии хронических анемий нередко представляет значительную сложность, а значит, трудности возникают и при постановке верного диагноза и выборе эффективной терапии. В первую очередь это относится к пациентам, имеющим одно или несколько заболеваний, объясняющих наличие анемии[4]. В таких ситуациях можно упустить еще одну, более редкую причину ЖДА, например острую или хроническую кровопотерю из ангиоэктазий слизистой оболочки желудка.
Эктазия вен антрального отдела желудка (Gastric Antral Vascular Ectasia), или GAVE-синдром, впервые описана J.A. Rider и соавт. в 1953 г. как «эрозивный тип гастрита с выраженной вено-капиллярной эктазией»[5]. Заболевание также часто называют «арбузным» желудком (“watermelon” stomach) из-за характерной эндоскопической картины. Современное описание «арбузного» желудка сделано M. Jabbari и соавт. в 1984 г. на примере трех пациентов с тяжелой, резистентной к терапии ЖДА, у которых при эндоскопическом исследовании выявили в антральном отделе желудка продольно расположенные «колонны» сосудов в слизистой оболочке[6]. Типичной локализацией ангиоэктазий считается антральный отдел желудка, однако в настоящее время описаны аналогичные изменения и в других отделах ЖКТ — в кардиальном отделе желудка, двенадцатиперстной, тощей и прямой кишке[7].
GAVE-синдром считается редким заболеванием, этиология и патогенез которого не до конца ясны. Обращает на себя внимание частая ассоциация GAVE-синдрома с системными заболеваниями соединительной ткани (системной склеродермией, синдромом Рейно), циррозом печени, хроническими болезнями почек, семейной средиземноморской лихорадкой[8]. В настоящее время основными механизмами формировании GAVE считают нарушения двигательной активности антрального отдела желудка, которые приводят к хронической травматизации слизистой и индуцируют последующую фибромышечную гиперплазию подслизистого слоя и дилатацию капилляров слизистой оболочки[9].
Основные клинические проявления GAVE-синдрома — хроническая ЖДА или манифестное желудочно-кишечное кровотечение (ЖКК). Считается, что GAVE становится причиной примерно 4% неварикозных кровотечений из верхних отделов ЖКТ[10]. Некоторые авторы отмечают, что GAVE является значимой причиной тяжелых кровопотерь у пожилых пациентов (преимущественно у женщин — до 71%)[11]. В то же время истинная частота ЖКК, обусловленных GAVE, может быть выше. Недиагностированный GAVE-синдром как причину ЖКК можно найти в разделах «другие причины» (2–7%), «неустановленные причины» (до 25%) или среди сочетанных причин острых кровотечений (16–20% от всех случаев)[12].
Диагностика GAVE основана на данных эндоскопии, подтвержденных результатами гистологического исследования. Эндоскопическая картина характеризуется патогномоничным рисунком, представленным красными пятнами, которые организованы в полосы, радиально распространяющиеся от пилорического жома, — «арбузный» желудок, реже встречается диффузное поражение («сотовый» желудок, “honeycomb” stomach)[13].
Гистологическая картина GAVE характеризуется эктазией капиллярных сосудов слизистой оболочки, фокальным тромбозом, пролиферацией веретенообразных клеток (гиперплазией гладкомышечных клеток и миофибробластов) и фиброгиалинозом. Еще в 1989 г. J.H. Gilliam и соавт. предложили балльную систему гистологической диагностики GAVE, включающую два критерия: сосудистую эктазию и/или фибриновые тромбы в сочетании с пролиферацией веретенообразных клеток (Gilliam's score). Дополненная впоследствии третьим параметром — фиброгиалинозом, — она получила название GAVE score[7, 8, 13, 14].
Шкала GAVE с точностью до 80% позволяет решать одну из наиболее важных диагностических задач — дифференцировать GAVE и портальную гастропатию, что особенно актуально для пациентов с циррозом печени. По данным некоторых авторов, частота ассоциации GAVE с циррозом печени может достигать 30%. Вместе с тем необходимость четкой идентификации этих состояний обусловлена различиями в терапевтических подходах[8, 10, 15].
Лечение GAVE-синдрома включает медикаментозную терапию, различные виды эндоскопического воздействия и хирургические вмешательства. Лекарственная терапия основана на применении октреотида, талидомида, транексамовой кислоты, эстроген-прогестероновых препаратов. Работы по изучению различных медикаментозных подходов продемонстрировали определенный эффект у отдельных категорий пациентов, но проводились на небольших выборках и не показали достаточную надежность и безопасность[16, 17].
Хирургическое лечение в виде резекции антрального отдела желудка в настоящее время не находит широкого применения в клинической практике. Хирургические методы используют только в случаях рефрактерности к другим способам лечения, так как они сопряжены с высокими показателями осложнений и летальности[18].
Основа современного подхода к лечению GAVE — методы эндоскопического воздействия. Обсуждаются возможности и преимущества и недостатки лазерной коагуляции, криотерапии, аргоноплазменной коагуляции (АПК), радиочастотной аблации, склеротерапии, лигирования резиновыми кольцами, баллонной остановки кровотечений[19–22]. Показаны высокие эффективность и безопасность эндоскопического лечения с помощью АПК, что позволяет использовать ее в качестве терапии первой линии у пациентов с GAVE-синдромом, осложненным кровотечением. Однако, по данным ряда авторов, повторные ЖКК после процедуры наблюдаются в 35–78,9% случаев[19, 20, 23].
В качестве иллюстрации вышеизложенного представляем описание клинического случая.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациентка К., 55 лет, поступила в отделение гастроэнтерологии клиники им. Петра Великого ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России в июне 2019 г. с диагнозом хронической ЖДА для проведения углубленного обследования и уточнения этиологии анемического синдрома.
Из анамнеза известно, что снижение уровня гемоглобина до 80 г/л у нее впервые зафиксировано в 2012 г. При обследовании в 2013 г. выявлена язва луковицы двенадцатиперстной кишки и предположена связь анемии с рецидивирующими субклиническими кровотечениями язвенного генеза. После проведенного лечения язва зажила с исходом в рубцевание. На фоне терапии препаратами железа уровень гемоглобина был скорректирован до 100–110 г/л.
В последующие 1,5 года при эзофагогастродуоденоскопии (ЭГДС) неоднократно находили эрозии желудка, которые расценивались как поражение, индуцированное приемом нестероидных противовоспалительных препаратов (НПВП) по поводу болевого синдрома, обусловленного двусторонним коксартрозом. В этот же период у пациентки обнаруживали положительную реакцию в кале на скрытую кровь (вне приема препаратов железа), однако клинически выраженные признаки кровотечения ни разу не зарегистрированы.
Уровень гемоглобина варьировал в пределах 80–100 г/л. Для уточнения причины рецидивирующей анемии в 2014 г. в плановом порядке выполнена видеоколоноскопия — патологических изменений не было.
У пациентки в 2014 г. также впервые обнаружено повышение концентрации креатинина сыворотки крови до 159 мкмоль/л, снизилась эффективность терапии препаратами железа — уровень гемоглобина не повышался более 90 г/л, сохранялся дефицит сывороточного железа. В 2015 г. пациентку обследовали в нефрологическом отделении, по результатам обследования установлен диагноз: Интерстициальный нефрит, НПВП-индуцированный. После подтверждения низкой концентрации эритропоэтина пациентка в течение нескольких лет получала препараты эритропоэтина с положительным эффектом (уровень гемоглобина повышался до 115 г/л).
В течение 2016 г. пациентка дважды была госпитализирована в стационар с прогрессирующей слабостью, ограничением физической активности, снижением работоспособности. Диагностирована анемия тяжелой степени с уровнем гемоглобина до 64–67 г/л, выполнялись гемотрансфузии, парентерально вводились препараты железа. В последующие 3 года продолжались плановая терапия эритропоэтином, курсовой прием препаратов железа, ингибиторов протонной помпы.
В 2019 г. из-за прогрессирующего снижения толерантности к физической нагрузке больная обратилась в приемное отделение стационара и после осмотра была госпитализирована в отделение гастроэнтерологии.
На момент поступления предъявляла жалобы на одышку при бытовой физической нагрузке, общую слабость, быструю утомляемость, головокружение при резком изменении положения тела. При объективном обследовании состояние средней тяжести, сознание ясное, положение активное. Кожные покровы бледные, обычной влажности, тургор снижен. Периферических отеков нет. Границы относительной и абсолютной сердечной тупости не расширены. Тоны сердца ритмичные, приглушенные, на верхушке сердца выслушивался функциональный систолический шум. Частота сердечных сокращений — 84 удара в минуту, артериальное давление — 105/65 мм рт. ст. Дыхание везикулярное, побочные дыхательные шумы не выслушивались.
Живот симметрично участвовал в акте дыхания, мягкий, безболезненный, патологические образования не пальпировались. Печень перкуторно не увеличена, край расположен на уровне реберной дуги. Селезенка не пальпировалась.
При лабораторном обследовании получены следующие результаты: снижение уровня гемоглобина до 70 г/л (цветовой показатель — 0,63, гематокрит — 0,23 л/л), концентрация креатинина — 234 мкмоль/л, скорость клубочковой фильтрации (СКФ) — 20 мл/мин/1,73 м2, содержание железа — 3,7 мкмоль/л. В анализе кала — положительная реакция на скрытую кровь (иммунохроматографическое исследование).
При ЭГДС слизистая в антральном отделе желудка ярко очагово гиперемирована, отечна, контактно ранима, в данной зоне определялись эктазированные сосуды, организованные в радиальные полосы, распространявшиеся от привратника в антральный отдел (рис. 1). Пациентку перевели в хирургическое отделение стационара, где выполнена АПК ангиодисплазий антрального отдела желудка. На рисунке 2 представлена эндоскопическая картина антрального отдела желудка после выполнения процедуры.
Рис. 1. Эндоскопическая картина антрального отдела желудка пациентки К. при первичном обследовании. Здесь и далее в статье иллюстрации авторов
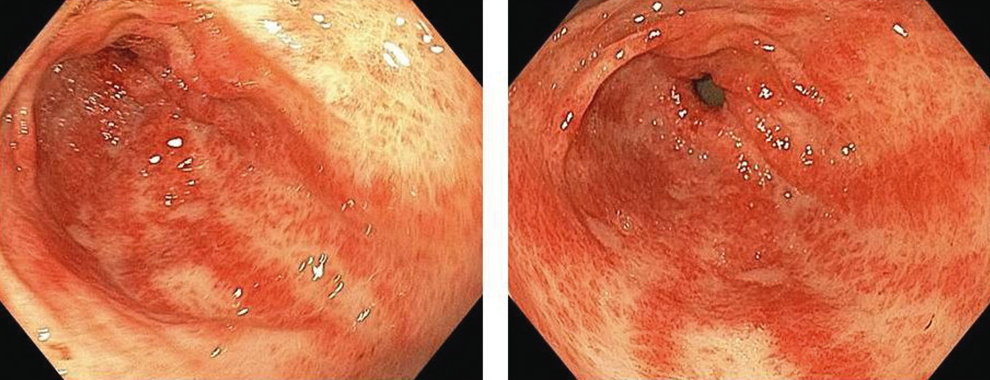
Рис. 2. Эндоскопическая картина у пациентки К. после аргоноплазменной коагуляции
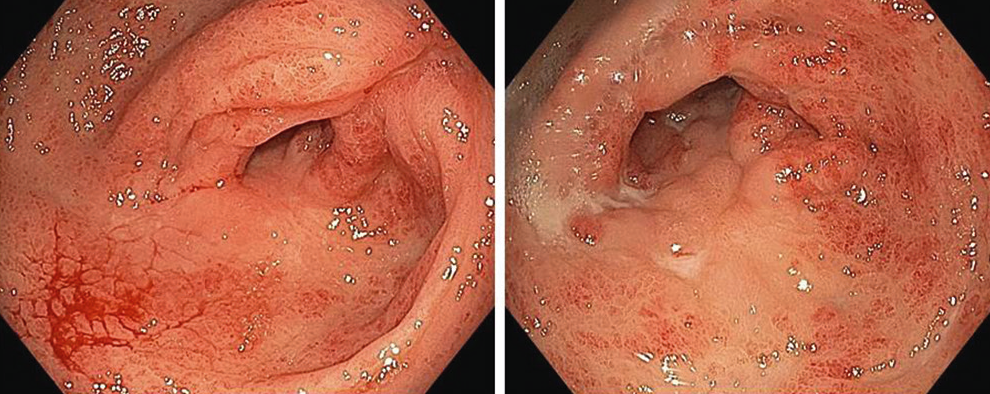
В течение последующих 3 лет пациентка трижды госпитализировалась в клинику им. Петра Великого с анемическим синдромом тяжелой степени, рецидивами ЖКК (январь 2020 г., июль 2022 г., февраль 2023 г.), выполнялись АПК и эндоскопическая остановка кровотечения, проводились консервативная терапия GAVE транексамовой кислотой, повторные гемотрансфузии.
В марте 2023 г. больная госпитализирована с нарастающими клиническими проявлениями анемического синдрома (одышкой, слабостью, головокружением). В анализах крови анемия тяжелой степени без признаков микроцитоза: уровень гемоглобина — 44 г/л, эритроциты — 1,36 × 109, гематокрит — 0,13 л/л, MCV — 95,2 фл, MCH — 32,8 пг.
В период с 14 по 28 марта 2023 г., несмотря на проводимую терапию, в т. ч. гемотрансфузии, сохранялась анемия тяжелой степени. Было принято решение о проведении оперативного вмешательства, и 29.03.2023 г. выполнена операция — дистальная резекция 2/3 желудка по Бильрот II в модификации Гофмейстера — Финстерера. В операционном материале в середине резецированного фрагмента — язвенный дефект 1,5 × 0,9 см с неровными краями, со свертками крови, глубиной до подслизистой основы, в 3 см от язвы слизистая с точечными кровоизлияниями на площади 4,0 × 2,5 см. Гистологическое исследование показало фиброзно-мышечную гипертрофию, полнокровные сосуды капиллярного типа с гиалинозом, хроническую язву желудка.
В послеоперационном периоде состояние пациентки оставалось тяжелым, возникли рецидивы ЖКК, в том числе кишечное кровотечение (стул со сгустками крови). При видеоколоноскопии сосудистый рисунок левой половины толстой кишки изменен, местами с расширенными сосудами, с множественными внутрислизистыми геморрагиями, слизистая ранима, отечна, с единичными белыми рубцами (рис. 3), согласно гистологическому исследованию, фиброз стромы, умеренная лимфоплазмоцитарная инфильтрация.
Рис. 3. Видеоколоноскопия пациентки К. Ангиоэктазии слизистой сигмовидной кишки
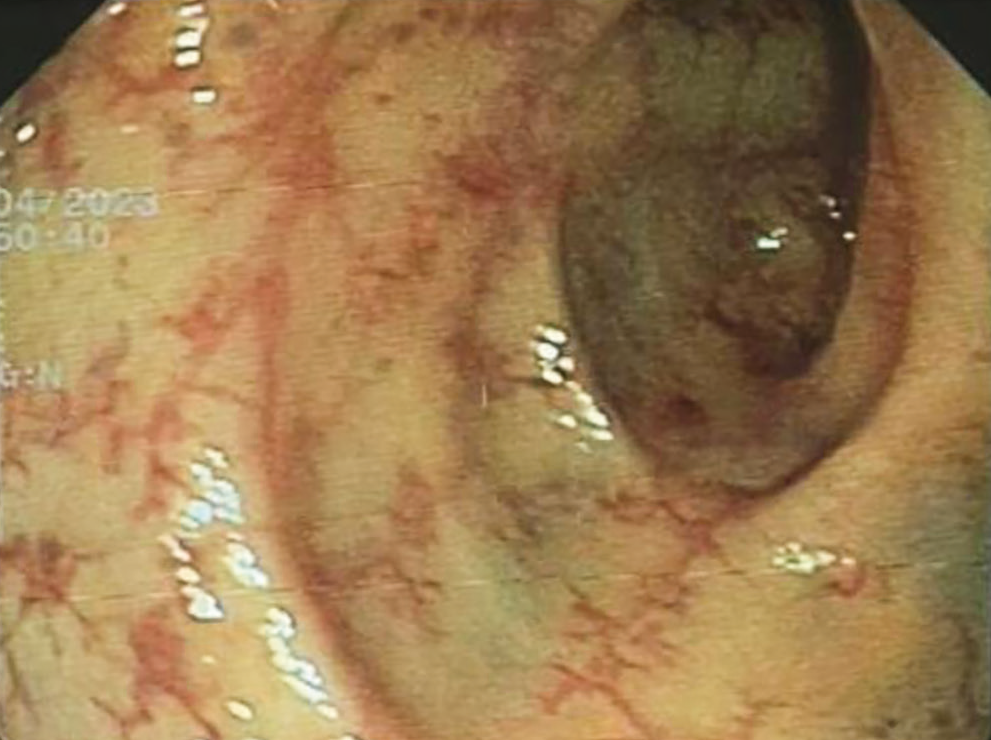
В дальнейшем на фоне общего тяжелого состояния появились и стали нарастать признаки системного воспаления, синдрома диссеминированного сосудистого свертывания, почечного поражения (снижение СКФ до 18 мл/мин), дыхательной недостаточности (на фоне двусторонней гиповентиляционной пневмонии), что привело к летальному исходу, несмотря на проводимую терапию.
ЗАКЛЮЧЕНИЕ
Эктазия вен антрального отдела желудка (GAVE-синдром) — редкая, но клинически значимая причина ЖКК из верхних отделов ЖКТ. GAVE-синдром может протекать бессимптомно или сопровождаться клинической картиной анемии или явного кровотечения.
В отношении ЖДА в реальной клинической практике в силу разных причин не учитываются возможные «подводные камни, рифы и мели», недооценка которых может привнести определенные сложности в процесс дифференциальной диагностики и лечения.
Приведенный клинический случай наглядно демонстрирует сложный путь к диагнозу GAVE-синдрома, который был окончательно верифицирован спустя 7 лет наблюдения за пациенткой с тяжелой, рефрактерной к терапии ЖДА, только когда сформировалась типичная эндоскопическая картина ангиоэктазий в антральном отделе желудка, организованных в радиальные полосы, — «арбузный» желудок.
Итак, процесс установления правильного диагноза длителен, а выбор оптимальной тактики лечения остается сложной задачей. Эндоскопическое лечение с использованием АПК считается терапией первой линии у пациентов с GAVE-синдромом, однако большинство авторов подтверждают высокую частоту рецидивов ЖКК после выполнения процедуры. У нашей пациентки мы наблюдали рецидивирующие ЖКК, несмотря на повторные эндоскопические вмешательства. Вероятно, подобная рефрактерность может быть обусловлена выраженной фиброзно-мышечной гипертрофией и гиалинозом сосудов слизистой оболочки.
Поступила: 05.12.2023
Принята к публикации: 05.02.2024








