В последние годы среди пациентов растет популярность различных немедицинских процедур и программ с загадочным названием «детокс». Медицинская эффективность данных манипуляций не доказана, и они способствуют искаженной интерпретации терминов «интоксикация» и «токсическое воздействие» на печень и организм в целом. С научной и практической точки зрения представляется крайне важным правильное понимание патофизиологии основных эндогенных токсических реакций в организме и их места в развитии болезней печени.
Цель обзора: обобщение современных данных в области патогенеза болезней печени, в том числе сведений о влиянии гипераммониемии на жировую болезнь печени, а также результатов клинических исследований в этом направлении и выработка практического алгоритма коррекции гипераммониемии при болезнях печени.
ЭНДОГЕННАЯ ИНТОКСИКАЦИЯ И ДЕТОКСИКАЦИЯ В ГЕПАТОЦИТАХ
Одним из основных эндогенных токсических метаболитов в организме является аммиак, образующийся главным образом в результате дезаминирования аминокислот в печени. Существуют и другие, менее значимые, пути образования аммиака: его синтез уреазоположительной микрофлорой кишечника, образование в мышечной ткани при физической нагрузке, распад глутамина в тонкой кишке и абсорбция аммония в почках при гипокалиемии.
Детоксикация соединений аммиака происходит преимущественно путем его связывания в орнитиновом цикле в митохондриях перипортальных гепатоцитов. Поскольку основное количество аммиака обезвреживается в печени, то при болезнях печени в первую очередь нарушаются именно процессы детоксикации, снижается активность орнитинового цикла. В свою очередь, это приводит к повышению концентрации аммония в крови и его дальнейшему накоплению. При легкой выраженности нарушения детоксикации развивается минимальная энцефалопатия, при дальнейшем его нарастании — последовательно выраженная энцефалопатия, дезориентация, атаксия и печеночная кома.
ОБЩНОСТЬ ПАТОГЕНЕЗА ЗАБОЛЕВАНИЙ ПЕЧЕНИ
Сегодня известно множество заболеваний печени с общим патогенезом. Вне зависимости от этиологического фактора после первичного поражения печени развивается каскад последовательных изменений, объединенных понятием «печеночного континуума» и приводящих к активации звездчатых клеток, выделению провоспалительных веществ, формированию фиброза и цирроза печени. При этом фиброз признан главным этиологически независимым путем прогрессирования хронических болезней печени. Безусловно, наша задача состоит в определении основной причины и механизма повреждения данного органа.
В реальной практике невозможно отрицать комплексное действие на печень одновременно нескольких этиологических факторов, например сочетания жирового и алкогольного повреждения печени, жирового и лекарственного поражения печени у коморбидных больных. Именно поэтому в клинической практике мы встречаемся с жировой болезнью печени смешанного генеза. В такой ситуации на первое место выходят понимание патогенеза заболевания и выбор патогенетической терапии.
При детальном рассмотрении патогенеза хронических заболеваний печени основным звеном в развитии воспаления и фиброза оказывается активация звездчатых клеток. Следует подчеркнуть независимость патогенетической роли этого процесса от способа и механизма активации (влияние алкоголя, вируса или лекарственного средства, наличие холестаза или жировой болезни).
Активация звездчатых клеток приводит к их дифференцировке в миофибробластоподобные клетки с провоспалительными и фиброгенными свойствами, нарушению архитектуры пространства Диссе, выделению регулирующих веществ, что способствует стенозированию синусоидов и развитию внутрипротоковой гипертензии с переходом в конечном счете в портальную гипертензию. Повреждение гепатоцитов запускает процессы образования коллагена, вызывая его избыточное внеклеточное отложение, нарушение кровотока, ишемию и некроз гепатоцитов. Клинически на этой стадии определяется цитолиз, при УЗИ обнаруживаются диффузные изменения структуры печени.
НОВОЕ В ПАТОГЕНЕЗЕ: ЗВЕЗДЧАТЫЕ КЛЕТКИ И АММОНИЙ
Звездчатые клетки жизненно важны для реализации функций печени и реакций ее ткани на повреждение. Исследования подтверждают центральную роль звездчатых клеток в патогенезе фиброза, цитолиза, печеночной энцефалопатии и портальной гипертензии [1]. Сообщают о принципиально новом значении аммиака в патогенезе фиброза и хронического воспаления в печени.
В журнале European Association for the Study of the Liver впервые опубликованы результаты исследования, показавшие, что аммиак вызывает негативные морфологические и функциональные изменения в звездчатых клетках печени. Аммиак дозозависимо снижает клеточную пролиферацию и метаболизм в звездчатых клетках; увеличение концентрации аммиака и времени его воздействия напрямую влияет на экспрессию маркеров клеточного стресса. По данным авторов, аммиак в повышенной концентрации приобретает выраженный профиброгенный и провоспалительный потенциал, вызывая значительные морфологические изменения. Уменьшение концентрации аммиака напрямую коррелировало со снижением портального давления [2].
Таким образом, все многообразие повреждений, вызванных действием аммиака в печени, связано с активацией, снижением метаболизма и пролиферации звездчатых клеток, активацией их профиброгенного и провоспалительного профиля, а также с нарушением внутрипеченочной гемодинамики, нарастанием внутрипеченочного портального давления, стимуляцией эндоретикулярного стресса и образования активных форм кислорода. Наряду с процессами цитолиза и холестаза, в патогенезе поражения печени, приводящего к прогрессированию заболевания, необходимо отметить гипераммониемию.
Медикаментозное снижение уровня аммиака орнитином дезактивирует звездчатые клетки печени и снижает портальное давление. Ряд ранних исследований доказали эффективность орнитин-аспартата в уменьшении концентрации аммиака у пациентов с печеночной энцефалопатией [3, 4].
Однако сегодня речь идет о повышении содержания аммиака, не приводящем к энцефалопатии, но активирующем звездчатые клетки печени, то есть запускающем каскад патогенетических процессов фиброза и цитолиза. Следовательно, необходимо рассматривать энцефалопатию как крайний вариант выраженности эндогенной интоксикации аммиаком, при котором первичное поражение печени уже имеет место. Пациентов с фиброзом любой степени и цитолизом следует считать кандидатами на терапию орнитин-аспартатом для уменьшения эндогенной интоксикации аммиаком. При этом первичная цель снижения содержания аммония состоит в уменьшении повреждения печени, в то время как коррекция астенического синдрома является вторичной задачей [2, 5].
АСТЕНИЧЕСКИЙ СИНДРОМ И МИНИМАЛЬНАЯ ЭНЦЕФАЛОПАТИЯ
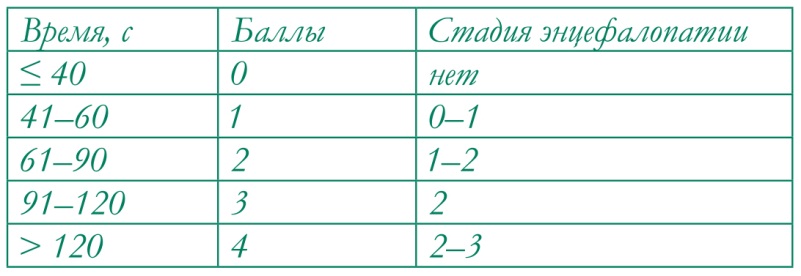
Классическим проявлением болезней печени служит астенический синдром. По определению, это состояние хронической усталости, повышенной утомляемости с неустойчивым настроением, ухудшением самоконтроля, нетерпеливостью и сложностью концентрации внимания. Очевидно не прямое, а опосредованное воздействие воспалительного процесса в печеночной ткани на состояние нервной системы, связанное с эндогенной интоксикацией и действием аммиака как основного эндотоксина и нейротоксина [6]. Развитие диагностических методов за последние годы позволило определять концентрацию аммония в сыворотке крови в корреляции с клиническими проявлениями печеночной энцефалопатии. Это привело к выделению самостоятельных форм латентной энцефалопатии и минимальной энцефалопатии. В клинической практике для выявления печеночной энцефалопатии применимы опросники и метод вызванных потенциалов головного мозга. Для диагностики энцефалопатии валидирован и несложный тест связи чисел, когда пациент на листе бумаги последовательно соединяет линией числа от 1 до 25. Для интерпретации результата оценивают время выполнения теста (рис. 1).
Рис. 1. Тест связи чисел.
Примечание. Интерпретация результата
|
|
Основные симптомы латентной печеночной энцефалопатии включают слабость, усталость, повышенную утомляемость, снижение работоспособности и концентрации внимания, раздражительность, замедление реакции, увеличение времени выполнения обычных рабочих задач, рассеянность, замедление счета чисел. При этом у пациентов с минимальной печеночной энцефалопатией риск развития тяжелой энцефалопатии, требующей госпитализации, выше, чем у больных циррозом без минимальной печеночной энцефалопатии [7].
Таким образом, астенический синдром как клиническая форма проявления латентной или минимальной печеночной энцефалопатии может стать целью терапии у многих пациентов с патологией печени [5].
ПЕЧЕНОЧНАЯ ЭНЦЕФАЛОПАТИЯ
Развитие энцефалопатии, этиологически связанной с заболеванием печени, реализуется вследствие гипераммониемии и токсического действия аммиака. Аммоний играет роль в ингибировании нейротрансмиссии, опосредованной ГАМК-рецепторами, в ЦНС и изменении центральной нервной трансмиссии за счет концентраций циркулирующих аминокислот. Это наиболее изученный из всех нейротоксинов [8]. В основе коррекции гипераммониемии лежит терапия L-орнитин-L-аспартатом, эффективность которой доказана множеством исследований.
Гипераммониемия стимулирует захват нейтральных аминокислот клетками мозга, активируя транспортер аминокислот в гематоэнцефалическом барьере. Избыток гиперосмолярного аммония в тканях мозга приводит к задержке жидкости с риском развития отека. Кроме того, обладая прямой нейроэлектрической активностью, аммоний ингибирует возбуждающие и тормозные постсинаптические потенциалы. Повышение концентрации аммония нарушает энергетический метаболизм клеток мозга и может приводить к снижению содержания АТФ [9, 10].
Орнитин-аспартат снижает концентрацию аммония в плазме крови посредством усиления метаболизма аммония в глутамин. Аммоний трансформируется в мочевину в перипортальных гепатоцитах и/или нейтрализуется при синтезе глутамина из глутамата в перивенозных гепатоцитах. У пациентов с патологией печени снижена активность ферментов, участвующих в детоксикации аммония (карбамилфосфатсинтетазы и глутаминсинтетазы), что и приводит к гипераммониемии. Орнитин служит активатором обеих ферментных систем, а орнитин-аспартат усиливает утилизацию аммония гепатоцитами [6, 11–13].
ВЛИЯНИЕ L-ОРНИТИН-L-АСПАРТАТА НА АММОНИЙ
Поскольку центральную роль в метаболизме аммиака играет печень, то на ранних стадиях заболеваний печени у пациентов отмечают гипераммониемию без клинических проявлений энцефалопатии. Данные исследований подтверждают стимулирующее влияние роста концентрации аммония в сыворотке крови на астроциты и прогрессирование заболевания. Таким образом, формируется порочный круг изменений: повреждение печени приводит к увеличению содержания аммония, а повышение уровня аммония ведет к повреждению печени. При этом первоначальный этиологический фактор уходит на второй план, а наиболее важным становится устранение порочного круга самоподдерживающихся нарушений.
Исследование с участием пациентов с повышенным содержанием аммония в сыворотке крови позволило подтвердить необходимость применения гипоаммониемических средств в терапии хронических заболеваний печени [14]. По полученным данным, для снижения уровня аммония с 56,1 мкмоль/л до 34,7 мкмоль/л эффективен первичный 4-недельный курс орнитин-аспартата в дозе 3 г 3 раза в день. В ходе контроля процесса у 32,4% пациентов при отсутствии этиотропной терапии наблюдали повторное повышение содержания аммония до 46,2 мкмоль/л к 6-му месяцу после окончания первичного курса. У этих больных был предпринят вариант базисной поддерживающей терапии короткими курсами орнитин-аспартата (Гепа-Мерц): в дозе 3 г 3 раза в день по 10 дней каждого месяца. Большинству оказалось достаточно 3-месячного курсового лечения по такой схеме для нормализации уровня аммония (25,4 мкмоль/л) (рис. 2).
Рис. 2. Снижение концентрации аммония у пациентов с хроническими заболеваниями печени [14]
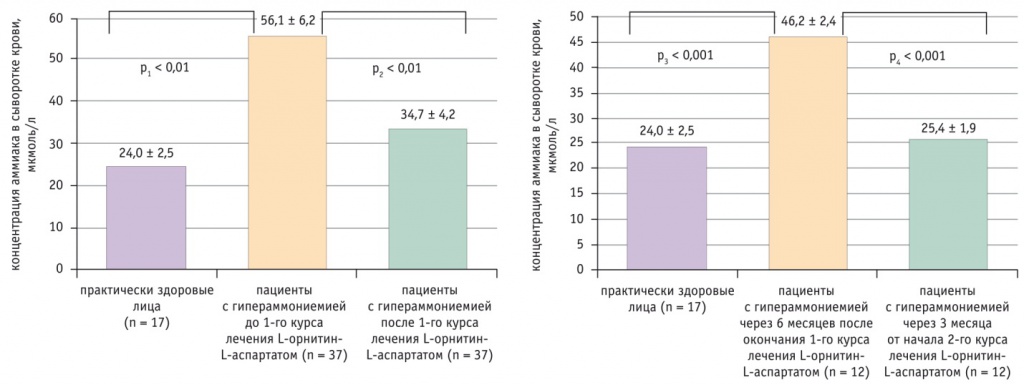
Таким образом, различные варианты терапии орнитин-аспартатом эффективно снижают уровень аммиака в крови, что может служить основанием для рекомендации курсового лечения пациентам с хроническими заболеваниями печени независимо от этиологии заболевания, а также больным с астеническим синдромом или минимальной энцефалопатией [14, 15].
ВЛИЯНИЕ L-ОРНИТИН-L-АСПАРТАТА НА ТРАНСАМИНАЗЫ ПРИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Гепатопротективные свойства L-орнитин-L-аспартата (Гепа-Мерц) продемонстрированы в крупном многоцентровом исследовании в Германии, г. Магдебург, у большого количества пациентов с хроническими заболеваниями печени разной этиологии [16]. В исследование были включены 1167 пациентов, в том числе 648 человек со стеатогепатитом и 378 с циррозом печени. Изучены различные режимы дозирования препарата (по 12, 9 и 6 г в сутки) и курсы лечения разной продолжительности (30, 60 и 90 дней). При приеме L-орнитин-L-аспартата курсом любой длительности наблюдали выраженную положительную динамику всех показателей, снижение активности трансаминаз на 52–64% от исходного уровня. Терапевтический эффект, хорошо заметный на протяжении первых 30 дней лечения, можно повысить, продлив курс терапии. Степень снижения исходной активности трансаминаз зависит от продолжительности лечения, дозы препарата, приверженности пациента диете и отказа от алкоголя. L-орнитин-L-аспартат более эффективен при жировой болезни печени, чем при хроническом гепатите и циррозе печени (рис. 3) [17–19].
Рис. 3. Динамика активности трансаминаз на фоне терапии L-орнитин-L-аспартатом в группах исследования: А — жировая болезнь печени; Б — цирроз печени; В — хронический гепатит [17].
Примечание. АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ГГТ — гамма-глутамилтрансфераза

ПИЩЕВОЙ ГЛУТАМИН, ЖИРНЫЕ КИСЛОТЫ И АММОНИЙ
С учетом нововведений пищевой промышленности и добавления в продукты больших количеств глутамата натрия и других производных глутаминовой кислоты как стабилизаторов и усилителей вкуса важен правильный взгляд на процессы метаболизма этой аминокислоты. Свойство глутамина усиливать вкусовые ощущения пищи зачастую вынуждает людей с избыточной массой тела употреблять в пищу продукты, содержащие именно глутамин. Кроме того, пациентам с избыточной массой тела, метаболическим синдромом или жировой болезнью печени необходима коррекция рациона питания, содержащего большое количество насыщенных жирных кислот. Метаболизируясь до короткоцепочечных жирных кислот и меркаптана, они усиливают токсическое действие аммония [20].
Аммоний продуцируется энтероцитами из глутамина и микрофлорой тонкой кишки из азотсодержащих продуктов, откуда через портальную вену поступает напрямую в печень. Другим источником аммония считают Helicobacter pylori, метаболизирующую азот мочевины, однако ее роль до конца не ясна. Неповрежденная печень способна нейтрализовать практически весь поступающий аммоний, превращая его снова в глутамин и не допуская поступления в системный кровоток. Однако избыток глутамата, глутамин-связанного аммония и свободного аммония может нарушать функцию митохондрий звездчатых клеток.
При жировой болезни печени у многих пациентов наблюдают высокий фоновый уровень аммония в крови, что становится одним из звеньев патогенеза жировой болезни. Затем избыточный бактериальный рост в кишке, высокое потребление глутамина и жирных кислот, а также нарушение процессов детоксикации аммония при жировой болезни печени приводят к дальнейшему повышению содержания аммония, активации звездчатых клеток и прогрессированию жировой болезни печени до фиброза [21–24].
НАЦИОНАЛЬНЫЕ РЕКОМЕНДАЦИИ[13, 24–27]
Работая в современном мире в соответствии с инструкцией по медицинскому применению лекарственного средства, стандартами и рекомендациями, важно понимать доказанность схем и эффективности средств лечения. Согласно инструкции, показания к применению препарата L-орнитин-L-аспартата Гепа-Мерц включают хронические заболевания печени, сопровождающиеся печеночной энцефалопатией, а также стеатозы и стеатогепатиты различного генеза. Следует помнить о том, что морфологическая картина алкогольной и жировой болезни печени, ее лекарственных и токсических поражений сопровождается развитием стеатоза, а при повышении активности трансаминаз — стеатогепатита. Кроме того, L-орнитин-L-аспартат внесен в национальные рекомендации Научного общества гастроэнтерологов России и Российского научного медицинского общества терапевтов по диагностике и лечению неалкогольной жировой болезни печени, а в рекомендациях European Association for the Study of the Liver и American Gastroenterological Association по фиброзу и циррозу печени, печеночной энцефалопатии и портальной гипертензии он признан обязательным компонентом терапии.
ПРАКТИЧЕСКИЙ ВАРИАНТ ПОДХОДА К ТЕРАПИИ
Понимая важность гипераммониемии как одного из ведущих и универсальных звеньев патогенеза жировой и алкогольной болезней печени, лекарственных и токсических гепатитов на стадии до развития цирроза, необходимо формировать план ведения больного с учетом содержания аммония в сыворотке крови или косвенных признаков астении либо минимальной энцефалопатии.
Из-за высокой лекарственной нагрузки у пациентов с жировой болезнью печени или метаболическим синдромом, а также у коморбидных пациентов предпочтительно курсовое лечение L-орнитин-L-аспартатом. На основании результатов клинических исследований можно рекомендовать начальный 4-недельный курс терапии, затем в течение последующих 6 месяцев в зависимости от динамики клинической картины и лабораторных показателей выбирать кратность и длительность курсов [15].
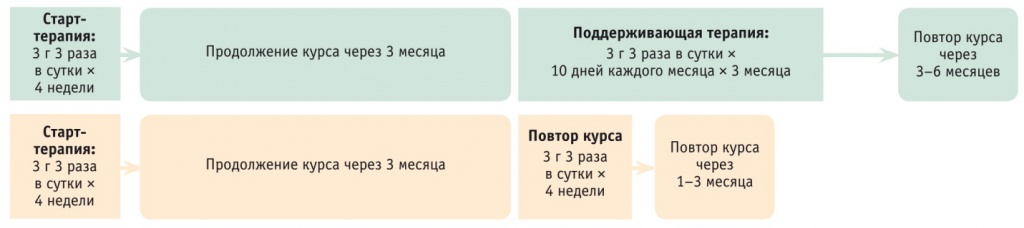
Исходя из результатов исследований, показан следующий режим приема: 10 дней подряд в течение каждого месяца на протяжении 3–6 месяцев или 10 дней подряд каждого второго месяца в течение полугода. Возможно использование L-орнитин-L-аспартата в комплексной терапии до нормализации уровня цитолиза с последующим переходом на курсовой прием (рис. 4).
Рис. 4. Схема курсового лечения L-орнитин-L-аспартатом
ЗАКЛЮЧЕНИЕ
Аммоний (аммиак) признан наиболее значимым эндотоксином, влияющим на патогенез заболеваний печени вследствие активации звездчатых клеток, независимо от этиологии заболевания. L-орнитин-L-аспартат эффективно уменьшает гипераммониемию.
Всем пациентам с хроническими заболеваниями печени необходимы рутинный скрининг астенического синдрома и минимальной (латентной) энцефалопатии, а также коррекция выявленных нарушений.








