Перитонеальное распространение является наиболее часто встречающейся формой генерализации при раке желудка, даже после потенциально радикальной резекции [1, 2]. Эта характеристика может быть связана с возможным внутрибрюшинным распространением злокачественных клеток, которое уже имеет место во время операции или хирургических манипуляций [3]. Современная интерпретация классической теории «семена и почва» предполагает, что двунаправленные контакты между раковыми клетками и тканями хозяина состоят из нескольких процессов, а именно инвазии, адгезии раковых клеток к нормальным клеткам, миграции к хемотаксическому градиенту и пролиферации в ответ на аутокринные и паракринные стимулы роста. Они также включают некоторые дополнительные и поддерживающие важные явления, например модуляцию системного иммунного ответа и ткани органа-мишени, эпителиально-мезенхимальный и мезенхимально-эпителиальный переход, ангиогенез [4, 5].
Некоторые из вышеупомянутых процессов, лежащих в основе формирования метастатической ниши, регулируются компонентами внеклеточного матрикса, периостином и другими факторами, которые активируют пути Wnt и Notch в раковых клетках, обеспечивая как физическую, так и сигнальную поддержку для клеток, которые инициируют метастаз (mts) [6, 7]. Теперь эту сложную функциональную сеть, сформированную и в значительной степени регулируемую нормальными клетками, соседствующими со злокачественными новообразованиями, называют реактивной стромой. Термин подчеркивает, что принимающая рак ткань не является пассивным реципиентом раковых клеток, а активно участвует в наиболее важных этапах заболевания.
Вторжение злокачественных клеток в нормальную ткань становится ключевым процессом в развитии и прогрессировании рака, включая метастатическое распространение [8-10]. Система регуляции плазминогена, в частности активатора плазминогена урокиназного типа (uPA), имеет решающее значение в запуске противоопухолевого протеолиза для расщепления экстрацеллюлярного матрикса (ECM) и базальной мембраны [11-13]. Система «uPA — uPAR» (uPAR — специфический рецептор uPA клеточной поверхности) играет определенную роль в деградации ECM, внесосудистом фибринолизе и отвечает за образование плазмина, связанного с инвазией и метастазированием [11-15].
Белок uPA секретируется как зимоген и активируется с высоким сродством к uPAR. uPA катализирует образование плазмина из колокализованного плазминогена, а плазмин, в свою очередь, непосредственно деградирует компоненты ECM и способствует дальнейшим деградации и ремоделированию тканей путем стимуляции металлопротеиназ, тем самым освобождая факторы роста из латентных форм [16].
uPAR прикрепляется к плазматической мембране, локализуя систему uPA на клеточной поверхности [17]. Высокий уровень uPAR облегчает инвазию опухолей и другие процессы клеточной миграции и ангиогенеза [12, 18]. Повышенное содержание uPAR может быть маркером начала инвазии рака ЖКТ, т. к. он экспрессируется только при инвазивных карциномах, а не при предраковых состояниях [2, 19].
Несмотря на то что экспрессия системы uPA наблюдается как на раковых клетках, так и на поддерживающей строме, на опухолевых клетках она выше, что и объясняет их биологическую агрессивность, эти показатели весьма актуальны для прогностических результатов [20-22]. Система uPA является важным прогностическим маркером при различных онкологических заболеваниях, ее определение уже рекомендуют к включению в рутинную клиническую практику [11], однако этот вопрос не исследовался при перитонеальном распространении рака желудка.
Целью настоящего исследования стало изучение содержания антигенной формы (uPA-АГ), активной формы (uPA-акт) урокиназы и uPAR в тканях аденокарциномы желудка, ее перифокальной зоны, большого сальника и брюшины у больных с mts в брюшину и большой сальник и без них.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены данные обследования 62 больных, находившихся на лечении в ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России (г. Ростов-на-Дону) в 2017-2018 гг. Работа выполнена по решению этического комитета ФГБУ РНИОИ МЗ РФ, протокол № 19/1, от 6 октября 2017 г. Больные были распределены на три группы.
В первую группу вошли 22 больных (11 мужчин и 11 женщин) с диагнозом рака желудка T3-4аN0-3M1 с метастатическим поражением брюшины и большого сальника. Их средний возраст — 59,51 ± 4,5 года. Содержание хирургического пособия: 11 пациентам выполнена диагностическая операция (биопсия метастатических очагов брюшины и сальника), 9 — циторедуктивная гастрэктомия, 2 — циторедуктивная дистальная резекция желудка. Гистологически у 13 (59,1%) больных были верифицированы G2-аденокарциномы, у 6 (27,3%) — G3-аденокарциномы, у 3 (13,6%) — G4-аденокарциномы. При выполнении операции отбирали для исследований по 100 мг ткани брюшины и большого сальника.
Вторую группу составили 24 пациента (15 мужчин и 9 женщин) с диагнозом рака желудка T3-4аN0-3M0 без метастатического поражения брюшины и большого сальника. Возраст участников — 64,08 ± 5,1 года. Содержание хирургического пособия: 20 больным выполнена гастрэктомия, 4 — дистальная субтотальная резекция желудка. Гистологически у 14 (58,3%) больных определены G2-аденокарциномы, у 10 (41,7%) — G3-аденокарциномы. При выполнении оперативного вмешательства для исследований отбирали по 100 мг ткани брюшины и большого сальника.
Контрольная группа — 17 пациентов (6 мужчин и 11 женщин) с неонкологическими заболеваниями (возраст — 39,1 ± 3,2 года). 14 (82,3%) больным контрольной группы выполнена холецистэктомия по поводу холецистита, 3 (17,7%) — грыжесечение с пластикой по поводу грыжи. Интраоперационно отбирали для исследований по 100 мг ткани брюшины и большого сальника.
Исследовали ткань аденокарциномы желудка, ее перифокальную зону, ткани большого сальника и брюшины, взятые интраоперационно, получив предварительно информированное согласие каждого больного. Из тканей получали 10% цитозольные фракции, приготовленные на 0,1 М калий-фосфатном буфере с рН 7,4, содержащем 0,1% Твин-20 и 1% БСА. Методами иммуноферментного анализа на стандартных тест-системах определяли уровни uPA-АГ, uPA-акт, uPAR.
Статистическая обработка данных выполнена с применением пакета программ SPSS 11.5 for Windows. Для оценки значимости различия показателей в группах предварительно устанавливали соответствие полученных выборок нормальному закону распределения, использован непараметрический критерий Манна — Уитни.
РЕЗУЛЬТАТЫ
Намеченные для исследований две формы uPA и uPAR обнаружены во всех полученных образцах тканей онкологических больных. В образцах тканей желудка, большого сальника и брюшины не было гендерных различий, поэтому группы рассматривались единым составом. Результаты сравнивали с таковыми в аналогичных тканях больных контрольной группы.
Установлено, что в ткани аденокарциномы желудка с mts в большой сальник или брюшину содержание uPAR оказалось выше, чем при отсутствии mts, при сравнимом уровне uPA-акт в опухоли с и без mts (табл. 1). Сравнивая метастазирующую аденокарциному желудка и опухоль без mts, мы отмечали, что в первой уровень uPA-АГ был ниже, чем во второй, что объяснимо с точки зрения усиленной активации uPA и расхода ее антигенной формы в ткани опухоли, уже имеющей mts.
Таблица 1
Содержание антигенной формы (uPA-АГ), активной формы (uPA-акт) урокиназного активатора плазминогена и его рецептора (uPAR) в аденокарциноме желудка и патологически измененных тканях
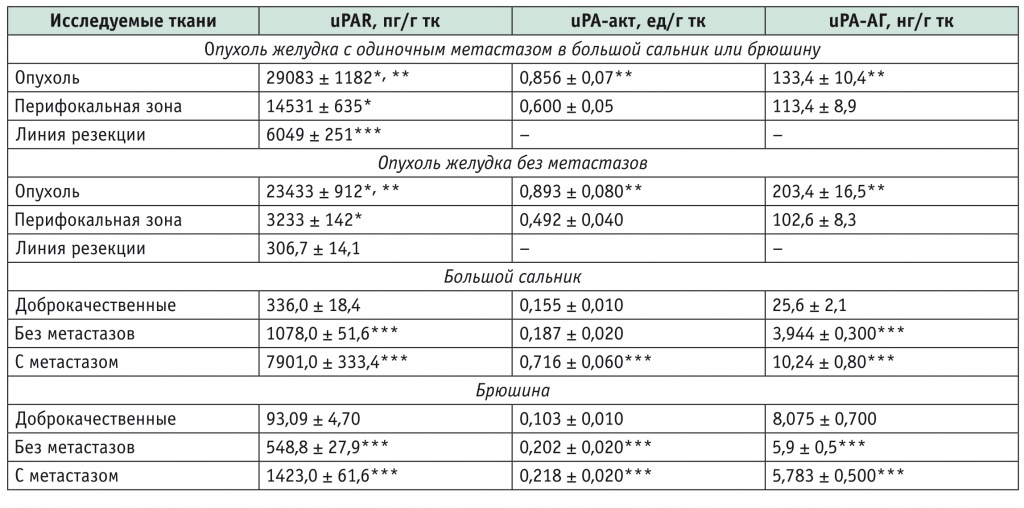
* Отличия от показателей по линии резекции статистически значимы (р < 0,05).
** Отличия от показателей ткани перифокальной зоны опухоли статистически значимы (р < 0,05).
*** Отличия от контрольной группы статистически значимы (р < 0,05).
В перифокальной зоне аденокарциномы как с mts, так и без них, количество uPAR и uPA-акт было статистически значимо ниже, чем в опухоли, при этом в первом случае уровень uPAR был в 4,5 раза выше.
Результаты исследования тканей большого сальника и брюшины при раке желудка показали, что в них содержание uPAR, uPA-акт и uPA-АГ статистически значимо отличалось от показателей лиц с доброкачественными заболеваниями (р < 0,05). В большом сальнике при наличии в нем mts рака желудка уровень uPAR был повышен в 23,5 раза, а в их отсутствие — в 3,2 раза. Содержание uPA-акт значимо повышалось только при наличии mts (в 4,6 раза). Количество uPA-АГ оказалось сниженным на порядок в обоих случаях, но при mts оно было больше, чем у больных без mts, в 2,6 раза.
В брюшине при раке желудка с mts в нее и без mts уровни uPAR оказались в 15,3 и в 5,9 раза выше показателя больных контрольной группы. Содержание uPA-акт у больных с mts и без них практически не различалось и было повышено в 2 и 2,1 раза относительно данных по брюшине пациентов с доброкачественными заболеваниями. Количество uPA-АГ снижено в 1,4 раза в обоих случаях по сравнению с таковым у больных контрольной группы.
Значения расчетного коэффициента соотношения uPAR/uPA-акт (табл. 2) подтверждают высокое содержание uPAR в опухоли и ее перифокальной зоне, а также в перитонеальных тканях с mts.
Таблица 2
Коэффициенты соотношения антигенной формы (uPA-АГ), активной формы (uPA-акт) урокиназы и ее рецептора (uPAR) в аденокарциноме желудка и перитонеальных тканях
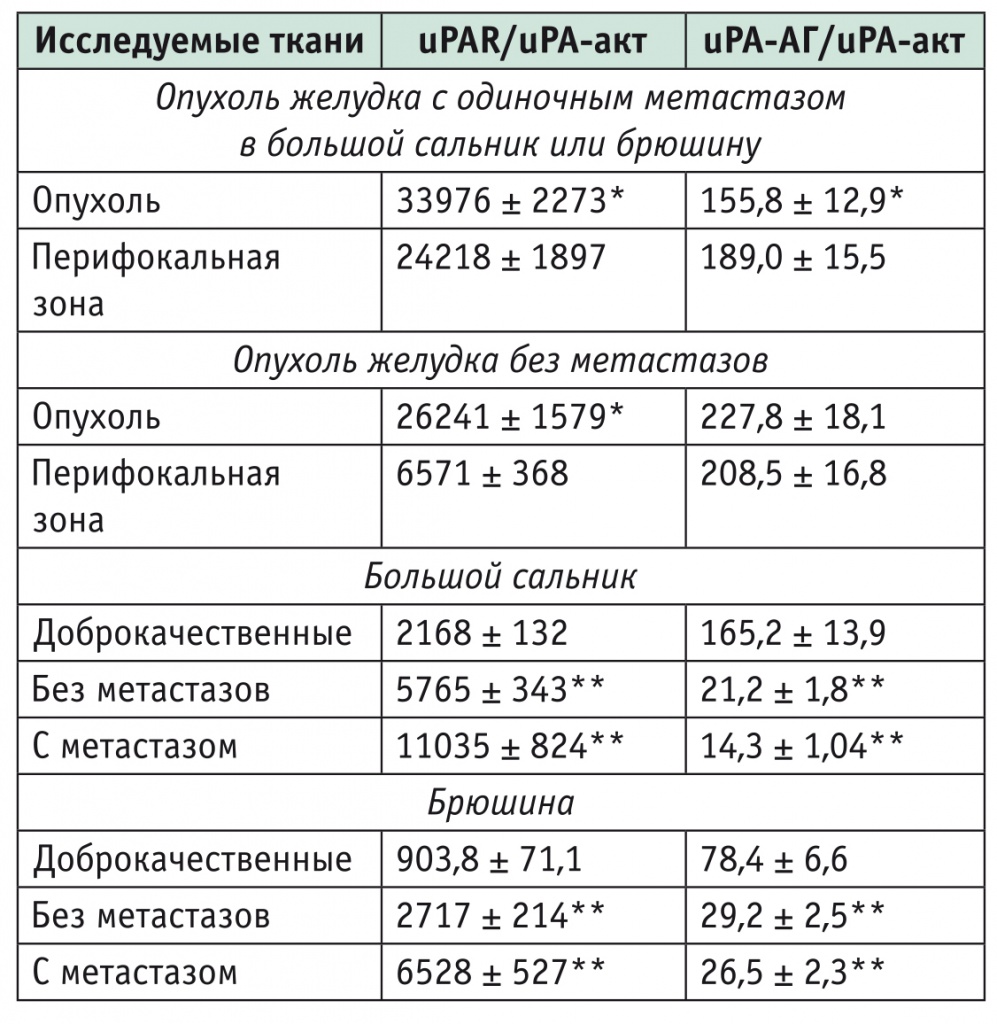
* Отличия от показателей ткани перифокальной зоны опухоли статистически значимы (р < 0,05).
** Отличия от контрольной группы статистически значимы (р < 0,05).
Однако следует обратить внимание на ткани большого сальника и брюшины, взятые при аденокарциноме желудка без метастазов: коэффициент uPAR/uPA-акт в них также статистически значимо повышен (в 2,7-3 раза) по сравнению с таковым в аналогичных тканях, полученных при отсутствии онкологического заболевания. Это означает, что в большом сальнике и брюшине уже начались процессы перестройки метаболизма, свойственные злокачественному заболеванию.
ОБСУЖДЕНИЕ
Перитонеальное распространение остается наиболее частым вариантом метастазирования рака желудка [10, 23]. Молекулярные механизмы, связанные с инвазией опухоли, ее генерализацией и лекарственной устойчивостью, остаются во многом невыясненными [8, 24]. Для определения того, являются ли спящие одиночные клетки или микрометастазы действительными мишенями для терапии, необходимо исследовать биологию опухолевого покоя и реактивации на молекулярном уровне в потенциальных метастатических нишах.
Увеличение активности uPAR, uPA-акт в исследованных нами тканях по сравнительно с образцами контрольной группы подтверждает сложившееся мнение о том, что uPA и ее рецептор — это ключевые ферменты в протеолитических процессах, способствующих инвазии и метастазированию. Примечательно, что, по нашим данным, в метастазирующей аденокарциноме содержится количество uPAR, большее такового не только в перифокальной зоне опухоли, но и во всех исследованных тканях, и его содержание в 1,2 раза (р = 0,0417) превышает таковое в аденокарциноме без mts.
Аденокарцинома, еще не метастазирующая, также содержит большое количество uPAR и uPA-акт, мало того, в ней повышен уровень uPA-АГ относительно ее перифокальной зоны, что прямо свидетельствует о возможной секреции опухолью антигенной формы фермента и косвенно указывает на потенциальную опасность генерализации злокачественного процесса.
Состояние злокачественных клеток, находящихся в метастатическом покое, регулируется метаболическими процессами в нишах внеклеточного матрикса, которые индуцируют положительные сигналы, такие как Wnt и Notch, и ослабляют отрицательные сигналы, например морфогенетического белка [6, 7].
Ключевые процессы в морфогенезе тканей (миграция и пролиферация клеток) стимулируются плазмином. Помимо этого, активация плазмин-зависимого протеолиза обеспечивает стимуляцию ангиогенеза и неоваскуляризацию новообразований [9, 15, 25-29]. Наши данные согласуются с приведенными сведениями и позволяют предположить, что аденокарцинома желудка через активацию uPA и uPAR стимулирует постоянную выработку плазмина c приоритетом в опухоли.
Согласно полученным нами результатам, распределение uPA и uPAR в аденокарциноме желудка с mts и без таковых, а также в большом сальнике и брюшине, свидетельствует о том, что содержание этих белков увеличивается сначала в опухоли, затем в ее перифокальной зоне и далее в перитонеальных тканях, причем в них уровни снижаются, оставаясь, однако, выше, чем при доброкачественных заболеваниях.
Известно, что локальная активация протеолиза является необходимым сопутствующим условием при попадании злокачественно трансформированной клетки в метастатическую нишу [23, 24, 30]. Судя по распределению uPAR и uPA в исследованных тканях, можно полагать, что они выделяются в большем количестве метастазирующей опухолью и проявляют высокую активность. Коэффициент соотношения uPAR/uPA-акт подтверждает наше наблюдение, т. к. его числовые значения практически сохранили эту зависимость. Обобщая литературные и собственные данные, мы полагаем, что при раке желудка речь может идти не только и не столько о покоящихся злокачественных клетках, сколько об уже имеющейся «подготовке» ткани на молекулярном уровне к формированию метастатического поля.
По нашим данным, повышенный более чем в 3 раза уровень uPAR в большом сальнике и почти в 6 раз в брюшине без mts способствует созданию условий для метастазирования в эти ниши. Злокачественные клетки способны прикрепляться непосредственно к перитонеальной поверхности, однако мезотелий (самый глубокий монослой брюшины) имеет примитивный защитный механизм против адгезии экзогенных клеток [10]. Сериновые протеиназы, к которым относятся и обе формы uPA, и uPAR, контролируют основные биологические процессы, такие как репликация ДНК, прогрессирование клеточного цикла, пролиферация, дифференцировка и миграция клеток, морфогенез, иммунитет, ангиогенез и апоптоз [31, 32]. Усиление миграции и инвазии опухолевых клеток осуществляется путем реализации сигнальных путей uPAR независимо от степени активности uPA [9].
Полученные нами результаты не противоречат имеющимся сведениям, и поэтому мы не исключаем, что при раке желудка к повреждающим функциям uPA может присоединяться активность растворимого рецептора uPAR, тем более что его содержание в аденокарциноме, ее перифокальной зоне и вторичных перитонеальных новообразованиях статистически значимо возрастает и остается на высоком уровне в сравнении с показателями при доброкачественных заболеваниях.
Известно, что uPAR экспрессируется только при инвазивных карциномах, но не при предраковых состояниях, поэтому его считают маркером инвазии рака ЖКТ [19]. Мы получили результаты, подтверждающие это положение. По нашим данным, при имеющихся метастазах экспрессия uPAR достаточно велика не только в аденокарциноме желудка, но и во вторичных злокачественных образованиях перитонеальной области.
Уровень uPAR в здоровом организме вполне стабилен, но при раке повышается, т. к. uPAR конкурирует с uPA за участие во многих непротеолитических биологических процессах, таких как миграция, адгезия и пролиферация клеток, ангиогенез [22].
Мембранный uPAR, регулируя превращение плазминогена в плазмин, активирует клеточные сигнальные пути, опосредующие миграцию, адгезию, пролиферацию и дифференцировку клеток [33]. Учитывая литературные и собственные данные, мы вправе предположить, что при раке желудка повреждающие функции uPA существенно дополняются активностью растворимого рецептора uPAR, т. к. прирост его содержания в тканях аденокарциномы как с mts, так и без них, много выше, чем прирост uPA-акт.
Необходимо обратить внимание и на то, что в ткани по линии резекции аденокарциномы с mts уровень uPAR превышает таковой в аналогичной ткани аденокарциномы без mts и в ткани при доброкачественных заболеваниях. M. A. Pavón и соавт. [24] в эксперименте показали, что ингибирование uPAR замедляет рост опухоли и снижает экспрессию генов, ассоциированных с mts, таких как MMP-2, MMP-9, VEGF-C, VEGF-D и VEGFR-3, а сам uPAR, накапливаясь, усиливает преобразование плазминогена в плазмин. Принимая вочвнимание эти и наши данные, считаем очевидным, что вокруг аденокарциномы, имеющей метастазы, фактически уже нет ткани, соответствующей физиологической норме по содержанию uPAR.
Имеется множество убедительных доказательств того, что высокая экспрессия uPA и uPAR при раке связана с клинико-патологическими особенностями и неблагоприятным прогнозом, включая наличие mts в перитонеальной области. Есть данные о том, что сигнальные пути, активируемые uPAR, способствуют уходу раковых клеток от опухоли в неповрежденную ткань [9], что повышает возможности метастазирования. Результаты проведенного нами исследования согласуются с литературными сведениями и уточняют некоторые детали в массиве существующих данных. D. Brungs и соавт. [8] продемонстрировали, что экспрессия uPA и uPAR связана с плохим прогнозом при раке желудка. Их результаты, как и наши, подчеркивают, что потенциально было бы полезно сделать систему «uPA — uPAR» терапевтической целью.
Понимание биологии «спящих» раковых клеток поможет разработке стратегий борьбы с бессимптомным остаточным злокачественным заболеванием, т. к. mts может развиваться без клинических симптомов после хирургического лечения в течение длительного послеоперационного периода. В это время циркулирующие и/или диссеминированные опухолевые клетки могут оставаться в состоянии покоя в связи с ингибированием клеточной пролиферации и активации путей выживания [6, 7, 10, 23, 34, 35].
ЗАКЛЮЧЕНИЕ
Процесс выяснения молекулярных механизмов, ответственных за генерализацию злокачественного процесса при перитонеальном распространении, чрезвычайно сложен, т. к. идентификация одного пути не всегда указывает на то, что именно он определяет прогноз заболевания. Мы надеемся, что нам удалось определить путь агрессивного поведения опухоли, реализующийся посредством системы «урокиназа — ее рецептор» (uPA — uPAR), в огромном перечне гидролитических процессов, способствующих перитонеальному распространению рака желудка.
Содержание uPAR в перитонеальных тканях при раке желудка может служить маркером формирования преметастатических ниш.








