Больные с гастродуоденальными злокачественными опухолями, обтурирующими просвет желудка и (или) двенадцатиперстной кишки, как правило, имеют неблагоприятный прогноз с низким качеством жизни. Качество жизни у таких больных значительно снижается, в частности, из-за способности усваивать только жидкую пищу, и то не всегда.
Одним из наиболее распространенных методов паллиативного лечения в этом случае являются наложение стомы ниже уровня сужения и проведение в последующем энтерального питания. Хирургическое лечение предпочтительно при проведении долгосрочной программы поддержания больных но, к сожалению, оно неэффективно у пациентов с плохим клиническим статусом и запущенным злокачественным процессом из-за повышенной заболеваемости и смертности. Данный метод не оказывает существенного положительного влияния на качество жизни, а порой даже еще более его усугубляет. Кроме того, наложение стомы ниже уровня обструкции не позволяет эвакуировать содержимое из вышележащих отделов пищеварительного тракта (слюна, пищеварительные соки), что также ухудшает физическое и эмоциональное состояние пациентов. По данным некоторых авторов, лишь менее 40% больных, нуждающихся в паллиативной помощи, имеют такие показания, при которых выполнение хирургической операции может привести к повышению качества жизни. Таким образом, для того чтобы повысить качество жизни, необходимы другие, менее инвазивные и более безопасные и эффективные, методы [1, 3, 20, 21, 25].
Применение стентов для лечения стенозов в ЖКТ способно разрешить эту проблему и обладает некоторыми преимуществами перед хирургическим лечением, хотя, по полученным данным, эффект при использовании указанного метода менее продолжителен, чем при проведении радикальных операций [14, 15, 22]. Эти выводы отличаются от результатов других исследований, показавших более быстрое начало принятия твердой пищи после процедуры с возвратом к твердой пище в тот же день, в который выполнялась процедура, в большом числе (до 52%) случаев [20].
Для принятия решения о выборе того или иного метода лечения больных со стенозирующим процессом злокачественной природы очень важно оценить качество жизни каждого конкретного пациента, его функциональный статус. Для этого существует несколько опросников. К ним относятся, например, шкала оценки статуса ВОЗ (англ. World Health Organization performance status — WHO status), стандартный опросник Short Form 36, шкала Европейской организации исследования и лечения рака (англ. European Organization for Research and Treatment of Cancer scale). При стенозах выходного отдела желудка (англ. gastric outlet obstruction), вызванных злокачественными новообразованиями, способность принимать пищу представляется наиболее важным фактором. Поэтому у таких пациентов для оценки качества жизни с этой точки зрения чаще всего проводится анализ по шкале степени обструкции выходного отдела желудка (англ. gastric outlet obstruction score — GOOS) [28]. В ретроспективном многоцентровом исследовании у 62 пациентов с помощью шкалы GOOS оценивали клиническую эффективность энтерального стентирования. Исследование показало, что все пациенты возобновили пероральный прием пищи, хотя в 14,5% наблюдений (n = 9) не было никаких улучшений в счете. Некоторые обследованные имели максимальный балл перед стентированием, и у всех них наблюдалось облегчение симптомов [27].
В недавнем проспективном исследовании, включавшем 101 пациента со злокачественными опухолями выходного отверстия желудка, были определены три независимых предиктора выживания: способность поддерживать самообслуживание (по WHO status), выраженность болей и использование морфомиметиков. Выживаемость менее 30 дней обнаружена у 10% больных, у которых все три прогностических показателя были негативными (WHO status — 3–4; болевой балл > 83; необходимость в использовании морфомиметиков сильнее, чем трамадол). Для такой группы пациентов однозначно рекомендуется проведение паллиативных мероприятий с наименьшим инвазивным вмешательством [21, 27].
Анализ клинического состояния каждого пациента с определением наличия сопутствующих заболеваний и оценкой независимых прогностических индикаторов выживаемости может выявить объективные данные, помогающие сделать выбор между паллиативным стентированием и хирургической операцией при решении вопроса об объеме возможной медицинской помощи таким больным. Больные с лучшим прогнозом и большей ожидаемой продолжительностью жизни должны получить более радикальную хирургическую помощь, обеспечивающую долгосрочную гарантию восстановления проходимости, а у пациентов с более короткой продолжительностью жизни больше пользы может принести эндоскопическое стентирование с восстановлением определенного уровня качества жизни и быстрым возвращением к оральной диете [4, 8, 26].
Правильный выбор стента также очень важен для сокращения числа осложнений и обеспечения хорошей проходимости в области стеноза, что ведет к улучшению качества жизни. Пластиковые стенты ассоциируются с более высокой вероятностью миграции (саморасширяющиеся пластиковые стенты) и перфорации (нерасширяющиеся пластиковые стенты), чем саморасправляющиеся металлические стенты (англ. self-expandable metallic stent — SEMS), которые используются чаще [5, 17, 23]. Металлические стенты могут быть покрыты мембраной, выполненной из различных пластиковых материалов, которая обеспечивает высокую устойчивость к прорастанию опухоли. Но эти стенты чаще утрачивают функциональность из-за более высокой частоты миграции в двенадцатиперстную кишку. Непокрытые SEMS имеют более низкие показатели миграции, поскольку они закрепляются самой опухолью, однако такие стенты связаны с более частой повторяемостью симптомов, вызванных врастанием опухоли. Тем не менее они используются чаще, чем покрытые металлические стенты, в кишке и при гастродуоденальной злокачественной обструкции, потому что в целом приносят лучшие результаты [5, 7, 10, 13, 24, 26].
В недавнем рандомизированном проспективном исследовании проведено сравнение эффективности применения покрытых и непокрытых SEMS у пациентов с раком желудка (по 40 человек в каждой группе). Продемонстрирована более высокая частота миграции покрытых стентов в течение 8 недель после установки (25,8%), чем непокрытых (2,8%). В то же время частота рестеноза, связанного с врастанием опухоли, была выше в группе с непокрытыми стентами (25,0%), чем с покрытыми (0,0%) [13].
Все саморасправляющиеся стенты поставляются в сжатом виде. Это позволяет использовать систему доставки меньшего диаметра по сравнению с окончательным диаметром стента после развертывания. Как правило, стенты имеют предустановленную систему доставки и при выполнении стентирования задачи врача сводятся к правильному позиционированию такой системы с последующим раскрытием стента, однако некоторые модели требуют сборки стента и доставочного устройства непосредственно перед выполнением процедуры. Размеры систем доставки варьируются в пределах от 6 до 14 мм. Все системы доставки имеют рентгенонегативные маркеры, указывающие границы сжатого стента, а также метки расположения стента после раскрытия.
В частности, саморасправляющиеся стенты Ultraflex (Boston Scientific, США) представляют собой цельноплетеную конструкцию из одной неразрывной нитиноловой нити, покрытую полиуретаном в центральной части. Исходно стент зафиксирован в сжатом состоянии на пластиковом стержне — системе доставки. После позиционирования стента, которое контролируется с помощью рентгенонегативных меток или по визуальным маркерам, удерживающая нить снимается и стент расправляется самостоятельно. Из-за чрезвычайной гибкости этого стента и незначительной силы раскрытия сетчатого каркаса (снижающих вероятность травматизации опухоли) для полного раскрытия иногда приходится использовать баллонную дилатацию, ее проводят под визуальным контролем эндоскопа после частичного раскрытия стента.
Другой вид стентов представляет WallFlex (Boston Scientific, США). Он выпускается в двух типах — с полным и частичным покрытием. В отличие от других стентов, полностью покрытый WallFlex во время установки может быть реконструирован (вновь закрыт) до 75% от развертывания и до двух раз в течение процедуры для правильного позиционирования. Кроме того, эти стенты имеют специальные тефлоновые петли на проксимальном конце, с помощью которых возможно репозиционирование уже установленного стента или его удаление.
После установки стентов просвет визуально расправляется под механическим воздействием каркаса стента на стенки опухоли. Полное раскрытие стента происходит в течение 3–20 часов (в зависимости от модели стента, степени стенозирования пищевода, плотности опухоли). После установки стента большинство пациентов начинает чувствовать себя значительно лучше, исчезают явления дисфагии, однако больным не рекомендуется сразу же начинать пероральный прием пищи и жидкостей. При установке стентов, даже если они имеют самую небольшую силу расправления, сохраняется риск повреждения стенки полого органа. После проведения этой процедуры необходимо выполнить рентгенологическое исследование с барием для подтверждения правильного позиционирования стента и отсутствия перфораций. Пероральный прием пищи разрешается не ранее чем через 12 часов после эндоскопической установки стента, чтобы плотные фрагменты пищи не смогли изменить его месторасположение. Кроме того, пациентам даются инструкции по приему в первое время после операции щадящей жидкой или гомогенизированной пищи с обязательным запиванием жидкостью для отмывания стента от остатков пищи, способных задержаться на его каркасе.
Приводим пример установки саморасправляющегося стента у больного, находившегося под нашим наблюдением.
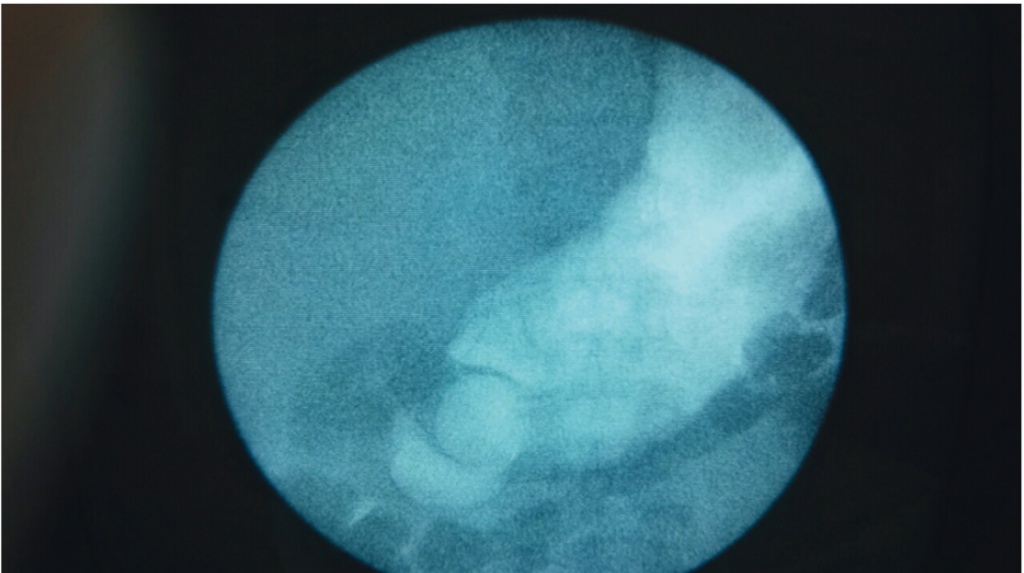
Больной П., 87 лет, с жалобами на боли в области эпигастрия, тяжесть в животе, рвоту съеденной пищей через короткое время после еды. В течение 2 дней после поступления в клинику пациент не принимал не только твердую, но и жидкую пищу. По результатам рентгенологического исследования в области антрального отдела желудок слепо заканчивался, переход в двенадцатиперстную кишку контурировался в виде нитевидного просвета диаметром 1,5–2 мм и протяженностью 4–5 см (рис. 1). При проведении эндоскопии в желудке было определено большое количество химуса. После отмывания желудка от содержимого определился привратник. Диаметр пилорического канала составлял 3 мм, пройти через него даже тонким трансназальным аппаратом не представлялось возможным.
Рис. 1. Рентгенологическое изображение до стентирования. Фото авторов
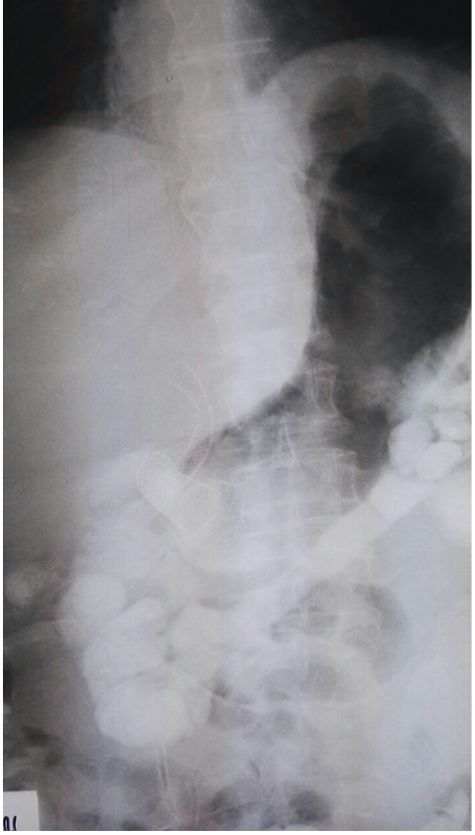
За область стеноза под рентгенологическим контролем был введен проводник. На следующем этапе по проводнику установили саморасправляющийся стент WallFlex с частичным покрытием, что контролировалось как рентгенологически, так и эндоскопически — параллельно введенным эндоскопом. После установки стента таким образом, чтобы его дистальный конец зашел за край стеноза на 2 см, было произведено раскрытие стента. Уже в первые 10 минут процесса раскрытия мы смогли осуществить осмотр двенадцатиперстной кишки, пройдя аппаратом со стандартным диаметром через открывшийся просвет (рис. 2). Рентгенологически определялись правильное расположение стента и восстановление просвета (рис. 3). Практически сразу же после установки стента больной почувствовал облегчение: боли и тяжесть в животе прошли.
Рис. 2. Саморасправляющийся стент установлен в области стеноза. Фото авторов
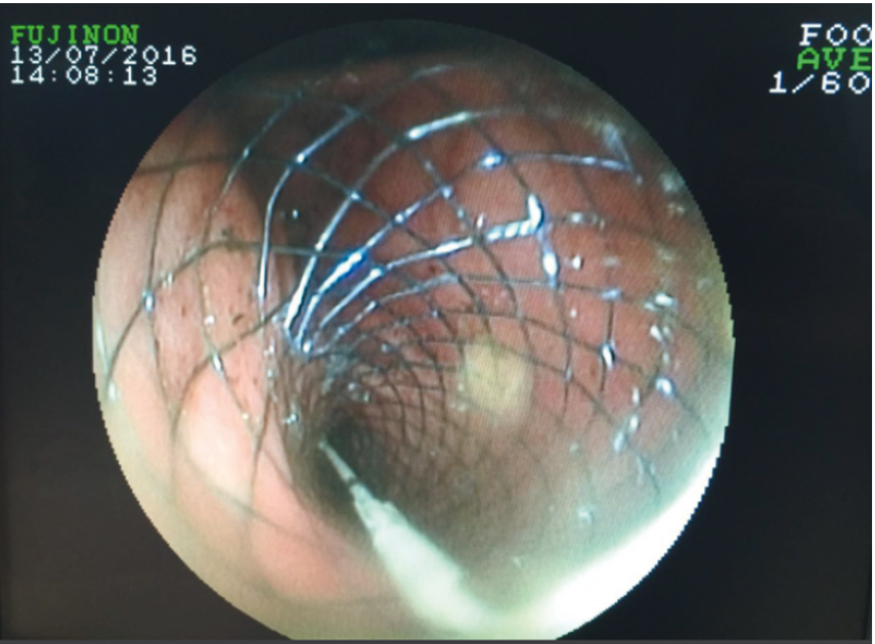
Рис. 3. Рентгенограмма после установки стента. Фото авторов
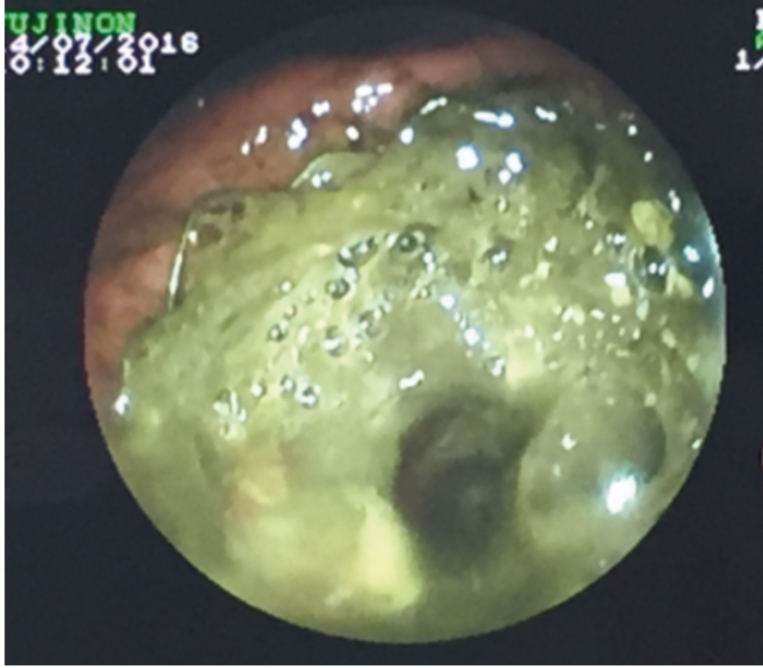
При эндоскопическом контроле на следующий день после установки в желудке определялась примесь желчи. Стент находился в том же положении, в каком был установлен накануне (рис. 4). Больной смог самостоятельно принимать пищу через рот.
Рис. 4. Просвет привратника на следующий день после стентирования. Фото авторов
ЗАКЛЮЧЕНИЕ
Использование саморасправляющихся покрытых металлических стентов при гастродуоденальных злокачественных опухолях является возможным, безопасным и эффективным методом, особенно у пациентов с ограниченной ожидаемой продолжительностью жизни или в особенно критическом состоянии. Эта мера позволяет не только улучшить процесс питания, но и повысить качество жизни больного. Установка самораскрывающихся металлических стентов может служить мостом к окончательному хирургическому лечению у больных с высоким риском злокачественных заболеваний [11, 29], как это произошло при лечении пациента в нашем наблюдении.








