Печень является наиболее частой «мишенью» для гематогенного распространения различных злокачественных опухолей, занимая второе место после лимфатических узлов. Практически у каждого третьего онкологического больного, независимо от локализации первичной опухоли, обнаруживают метастазы в печени[8]. Только у 5–20% больных с первичными и вторичными злокачественными опухолями печени удается выполнить радикальное оперативное вмешательство[4, 9, 12, 23, 27]. Метастазы колоректального рака в печень занимают основную позицию в структуре онкологической заболеваемости и смертности[1, 21]. Ежегодно в мире регистрируется около 1 млн новых случаев заболевания колоректального рака[6, 24]. При этом первичную опухоль толстой кишки в 20–50% диагностируют уже при наличии метастазов в печени.
Основные методы лечения опухолевого поражения печени объединяют в три группы: хирургическое, системная химиотерапия и минимально инвазивные методы локальной деструкции, применяемые отдельно и в различных комбинациях. Ведущим методом радикального лечения метастатического рака печени, позволяющим добиться длительной выживаемости, по мнению ведущих специалистов, остается резекция органа[2, 3, 12, 22]. Важно также отметить, что 30–55% пациентов, получивших потенциально радикальное лечение по поводу рака толстой кишки, имеют риск прогрессирования заболевания в виде метастазов в печени[18].
Большое значение придают применению комбинированного способа, т. е. хирургического вмешательства, лекарственного воздействия (химиотерапии) в сочетании с методами локальной деструкции опухолевой ткани[2, 12, 13, 15, 17, 25].
Несмотря на достигнутые успехи в лечении злокачественных опухолей печени, сохраняется неуклонный рост частоты этого заболевания и низкий уровень выживаемости у больных с III–IV стадией, что обусловливает высокую социальную значимость данной проблемы[6, 20]. Поэтому весьма актуальным остается поиск новых методов локального воздействия на опухолевые образования печени.
В сложившихся условиях трудно переоценить значение методов локальной деструкции (абляции), позволяющих добиться некроза опухоли, не прибегая к резекции печени. Наряду с традиционными методами лечения, включающими оперативное вмешательство, лучевую и химиотерапию, в последнее время все чаще применяют минимально инвазивные методики (суперселективную внутриартериальную химиоэмболизацию артерий, питающих опухоль, крио-, лазерную и радиочастотную абляцию)[5, 9, 11, 19]. В последние годы разработана неинвазивная технология, основанная на применении высокоинтенсивного фокусированного ультразвука — HIFU-абляция (англ. High Intensive Focused Ultrasound) для дистанционного локального направленного разрушения опухолей[7, 10, 14, 16, 26].
Несмотря на накопленный опыт HIFU-абляции в лечении опухолей печени, поджелудочной железы, молочных желез, забрюшинной клетчатки и др., многие вопросы остаются ещё открытыми. Требуется дальнейшее изучение метода с целью уточнения показаний и противопоказаний к применению технологии HIFU. Остаются недостаточно решенными вопросы технических и временных параметров воздействия на образования печени, а также способа оценки полноты коагуляции опухоли во время операции. Необходим расчет объема периопухолевого включения здоровых тканей в зависимости от исходного размера опухоли и дальнейший поиск корреляции между данными инструментальных методов исследований и морфологическими изменениями, происходящими в опухолевых очагах в разные периоды времени после абляции. Вместе с тем требуется дальнейшее проведение комплексных сравнительных исследований, которые позволят оценить эффективность технологии в лечении пациентов с опухолевым поражением печени, а также определить место HIFU-абляции в алгоритме лечения этой тяжелой категории пациентов.
Цель исследования: изучить возможности неинвазивной локальной деструкции вторичных опухолевых очагов печени с помощью высокоинтенсивной фокусированной ультразвуковой абляции (HIFU-абляции) и выработать оптимальные параметры для достижения локального эффекта.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в Национальном медико-хирургическом центре им. Н. И. Пирогова. Изучены непосредственные результаты применения HIFU-абляции для лечения метастатического поражения печени у 94 пациентов в период с 2009 по 2013 гг. В исследование вошло 58 женщин (61,7%) и 36 мужчин (38,3%). Средний возраст пациента составил 61 ± 9 лет.
По локализации первичной опухоли преобладали пациенты с колоректальным раком (ободочная кишка — 45,7% и прямая кишка — 22,3%), реже наблюдались пациенты с раком желудка (8,5%), молочной железы (8,5%), яичника (3,2%) и поджелудочной железы (2,1%), в единичных случаях отмечались опухоли других локализаций. По характеристикам метастатического процесса преобладали больные с синхронными метастазами (63,8%).
Наиболее часто HIFU-абляции выполняли пациентам с III (21,3%) и IV (70,2%) стадиями онкологического процесса и пациентам с мультифокальным билобарным поражением печени. Самой частой гистологической формой вторичной опухоли была аденокарцинома различной степени дифференцировки (90,3%) с превалированием умеренно дифференцированных форм (49,5%). На 9,7% случаев приходятся другие гистологические формы новообразования.
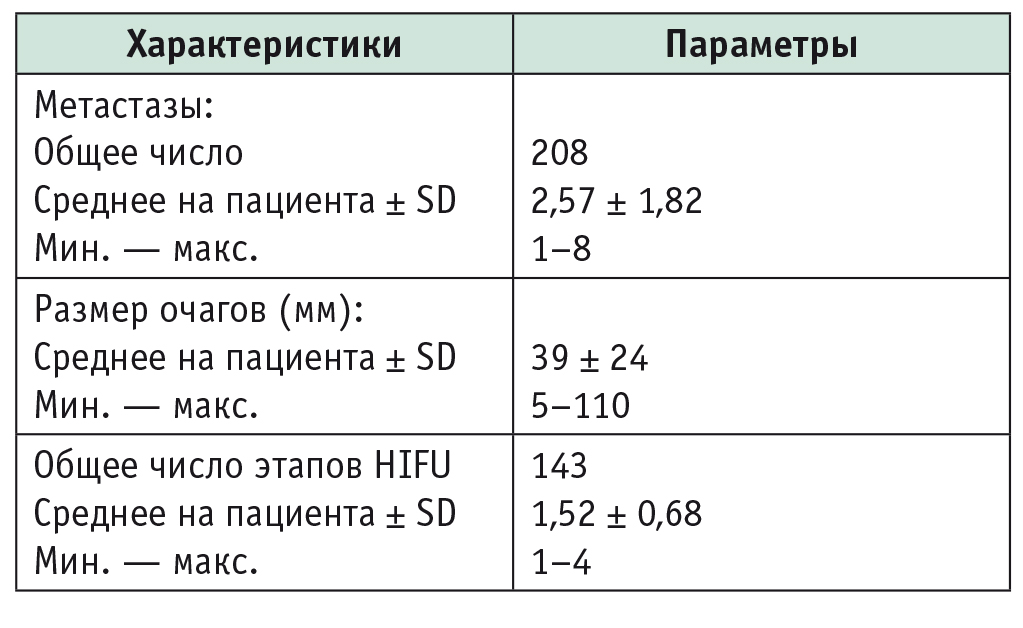
Всего HIFU-абляции были подвергнуты 208 опухолевых очагов. Число вторичных опухолей печени, подвергшихся воздействию у одного пациента, варьировало от 1 до 8 (медиана 2,0, среднее 2,57). Средний максимальный размер опухоли составил 39 ± 24 мм (5–110 мм). Каждый пациент перенес от 1 до 4 этапов HIFU (медиана 1, в среднем 1,52 ± 0,68) (табл.1).
Таблица 1
Характеристика метастазов, подвергшихся ультразвуковой абляции
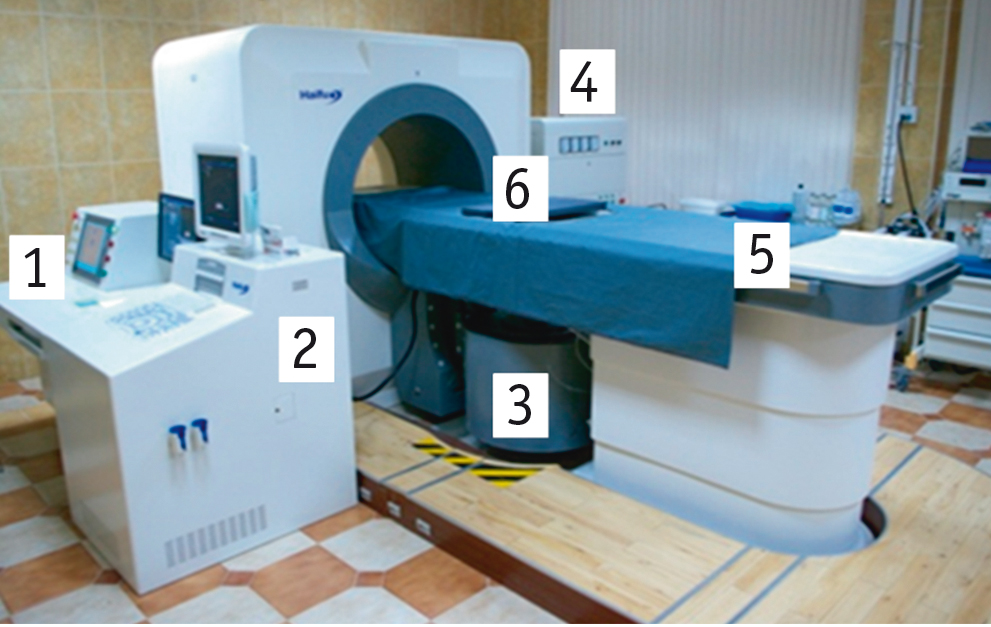
Для проведения HIFU-абляции у пациентов с метастатическим поражением печени использовали систему экстракорпорального лечения JC Focused Ultrasound Therapeutic System компании Chongqing (HIFU) Technology Company (рис.1).
Рис. 1. Общий вид системы экстракорпорального лечения HIFU (1 ― центральная панель управления, 2 ― ультразвуковой сканер, 3 ― кинематическая система, 4 ― высокочастотный генератор, 5 ― процедурный стол, 6 ― лечебно-диагностический блок). Фото авторов
РЕЗУЛЬТАТЫ
С целью изучения и подробного описания динамики ультразвуковых признаков в опухолевых очагах в ходе операции все вторичные образования были разделены на три вида по основному ультразвуковому признаку — эхогенности (гипоэхогенные — 63%, гиперэхогенные — 28%, изоэхогенные — 9%). В результате исследования впервые установлено, что в зависимости от эхогенности метастатических очагов печени они претерпевают различные изменения ультразвуковой картины в процессе локальной деструкции.
В зависимости от размеров очагов все метастазы были разделены на три группы: первая — опухоли диаметром от 1 до 3 см (включительно), вторая — от 3 до 5 см (включительно), третья — более 5 см (табл. 2).
Таблица 2
Технические параметры выполнения HIFU-абляции в зависимости от размеров метастатического очага (М ± δ)
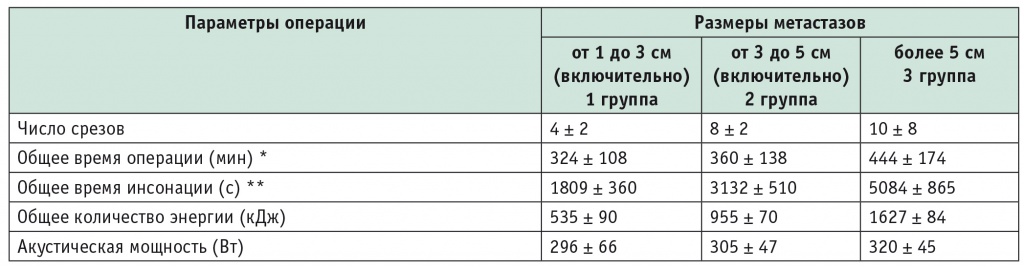
Примечание. * ― различия между первой и третьей группой статистически значимы: p 1–3 = 0,009.
** ― различия между группами статистически значимы: p 1–2 = 0,001, p 1–3 = 0,001, p 2–3 = 0,001.
Таким образом, в результате проведенного анализа впервые установлено, что оптимальными для выполнения локальной HIFU-абляции являлись вторичные образования диаметром от 1 до 5 см, что подтверждалось разработанными техническими параметрами, их сопоставлением с интраоперационными изменениями ультразвуковых признаков процесса деструкции и проведением сравнительного анализа этих параметров в группах в зависимости от размера опухоли.
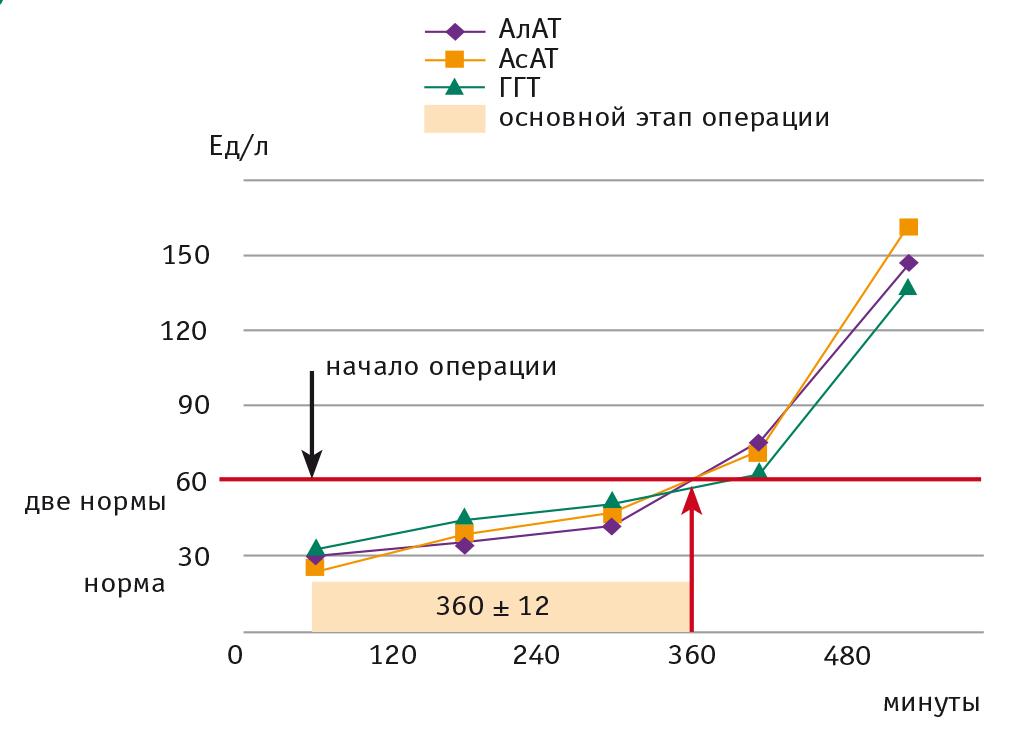
Также установлено, что одним из основных факторов, влияющим на качество интраоперационного ультразвукового контроля и динамику интраоперационных биохимических показателей, определяющих послеоперационное состояние пациентов, является общее время операции. В ходе изучения интраоперационной динамики биохимических показателей (рис. 2), было установлено, что оптимальное среднее время основного лечебного этапа, до появления выраженных изменений биохимических показателей, составляет 360 ± 12 мин.
Рис. 2. График изменений биохимических показателей крови во время операции HIFU-абляции.
Примечание. АлАТ ― аланинаминотрансфераза, АсАТ ― аспартатаминотрансфераза, ГГТ ― гамма-глутамилтрансфераза
За этот период времени возможно выполнить HIFU-абляцию опухолевой ткани средним объемом 120 ± 3 см3, что позволяет при необходимости определить число необходимых этапов операции при множественном поражении печени, а также последовательность деструкции.
Установлено, что факторы, затрудняющие выполнение HIFU-абляции, могут быть разделены на четыре основные группы:
- Зависящие от локализации вторичных опухолей (71% наблюдений) — подкапсульные (прилежащие к петле кишки, ребру), поддиафрагмальные, паравезикальные метастазы.
- Обусловленные термическим воздействием ультразвуковых волн (84% наблюдений) — отек подкожной клетчатки, утолщение капсулы печени, перифокальный отек паренхимы с подкапсульным скоплением жидкости.
- Связанные с исходной эхоструктурой опухоли (9% наблюдений).
- Обусловленные развитием осложнений основного заболевания (6,4% наблюдений) — желчная гипертензия, механическая желтуха, холангит.
Для устранения факторов, препятствующих выполнению HIFU-абляции, и улучшения интраоперационной ультразвуковой картины при гипо- и изоэхогенных метастазах был разработан и внедрен комплекс мероприятий, позволяющий повысить эффективность абляции опухолей при наличии затрудняющих факторов и снизить риск вероятных осложнений:
- при поддиафрагмальном расположении опухоли — наложение искусственного гидроторакса;
- при подкапсульном расположении и прилежании к желчному пузырю — отступ от капсулы и желчного пузыря не менее 1 см;
- использование латексного шарика для отведения полого органа;
- введение коротких периодов охлаждения при выраженной подкожно-жировой клетчатке и ее интраоперационном отеке;
- для улучшения ультразвуковых признаков и дальнейшего интраоперационного контроля при изоэхогенных метастазах — предварительная маркировка их спиртом;
- для снижения желчной гипертензии и устранения механической желтухи — предварительное проведение минимально инвазивных декомпрессионных вмешательств.
С целью повышения эффективности HIFU-абляции и объективизации хода процесса деструкции опухолевой ткани проведено сопоставление результатов УЗИ, КТ с контрастированием и тонкоигольной аспирационной биопсии (ТАБ) под ультразвуковой навигацией. Наиболее информативными в раннем послеоперационном периоде являются КТ с контрастированием, которая позволяет выявить отсутствие накопления контрастного вещества в зоне деструкции, и ТАБ под контролем ультразвука.
Для определения изменений, происходящих в различных участках зоны деструкции после HIFU-абляции, была предложена схема выполнения биопсии и забора материала из 4 зон (центральной, периферической, паранодулярной и на границе паранодулярной зоны и неизмененной печени) (рис. 3).
Рис. 3. Схема выполнения биопсии из центральной, периферической и перинодулярной зон очага деструкции.
Примечание. П ― печень; М ― метастаз; стрелки ― траектории проведения иглы; крестик ― зона биопсии
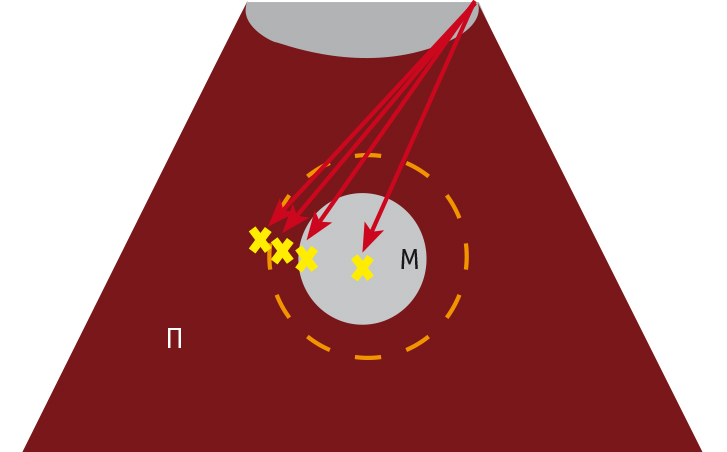
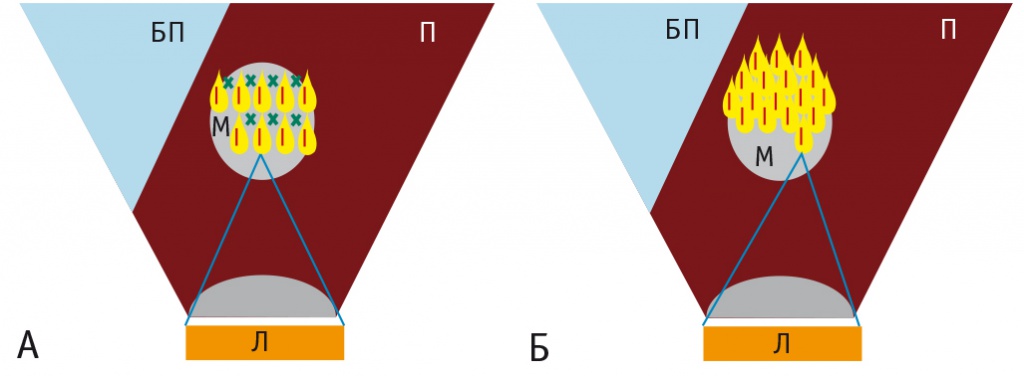
Изменение схемы биопсии и полученные данные послужили основанием для пересмотра плана графического построения операции. Причиной появления в периферических отделах зоны деструкции участков опухоли, не вовлеченных в термическое воздействие, было связано с каплевидной формой распространения энергии в точке фокусировки, что отмечается при «линейном» типе графического построения плана операции этих участков (рис. 4А). Для решения этой проблемы нам потребовалось изменить тип графического построения плана операции с «линейного» на «шахматный», при котором происходит частичное перекрытие вышерасположенного ряда точек инсонаций и вся опухоль подвергается деструкции (рис. 4Б).
Рис. 4. Схема графического построения плана операции ультразвуковой абляции.
Примечание. А ― «линейный» тип графического построения плана операции; Б ― «шахматный» тип графического построения плана операции. П ― печень, БП ― брюшная полость, М ― метастаз, Л ― линза, х ― участки опухоли, не вовлеченные в деструкцию
Результаты ТАБ в раннем послеоперационном периоде и нередкое выявление активных опухолевых клеток на расстоянии 0,5–1 см от видимых границ очага, позволили предложить способ расчета оптимальной зоны деструкции, позволяющий определить величину захвата перинодулярной ткани в зоне деструкции в зависимости от диаметра опухоли:
D = d + 0,5d
Где: D — общий диаметр необходимой зоны деструкции, d — наибольший диаметр опухоли.
При этом величина захвата перинодулярной ткани от опухоли по одному краю (L) составляет:
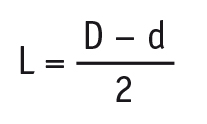
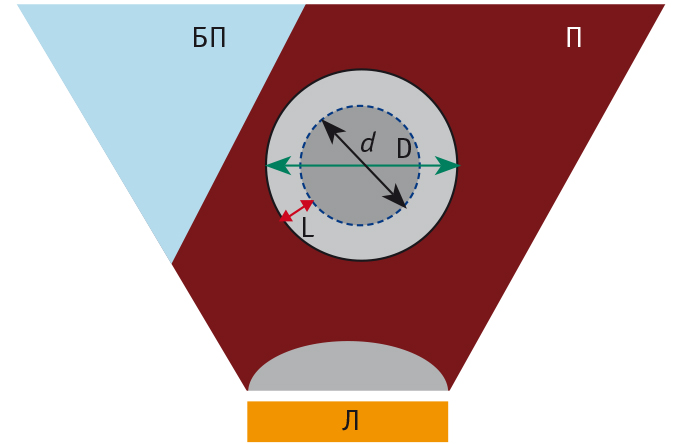
Схема расчета зоны деструкции представлена на рисунке 5.
Рис. 5. Схема расчета зоны деструкции.
Примечание. D ― общий диаметр необходимой зоны деструкции; d ― наибольший диаметр опухоли; L ― искомая величина захвата перинодулярной ткани, П ― печень, БП ― брюшная полость, Л ― линза
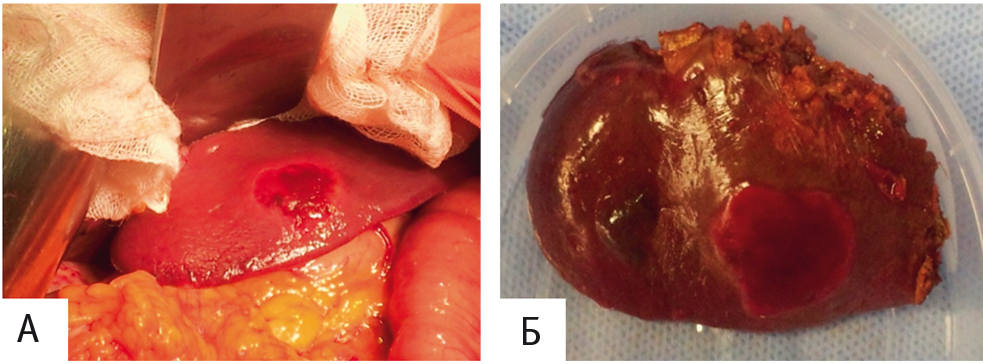
У 3 пациентов, которым ранее была проведена HIFU-абляция, были изучены макропрепараты опухоли при выполнении лапаротомии по иным показаниям, и были подтверждены изменения в очаге деструкции (рис. 6). Во всех наблюдениях макро- и микроскопически подтверждена полная деструкция вторичных опухолей печени.
Рис. 6. Печень с очагами деструкции вследствие HIFU-абляции. Фото авторов.
Примечание. А ― интраоперационный вид при лапаротомии: печень с очагом деструкции; Б ― макропрепарат резецированной доли печени с опухолью, подвергшейся деструкции
Общие реакции организма на операцию HIFU-абляции проявлялись развитием болевого синдрома разной степени выраженности, как правило, субфебрильной температурой (72% наблюдений), а также кратковременным преходящим повышением цитолитических ферментов (39% наблюдений). Каких-либо лечебных манипуляций в связи с этими изменениями не потребовалось.
Вместе с тем отмечены местные реакции в виде отека подкожно-жировой клетчатки (87% наблюдений) в зоне фокуса различной степени выраженности, ожог кожи 1–2 ст. (13% наблюдений), жидкостные скопления в над- и подпеченочном пространстве (8,5% наблюдений) и парестезии (68% наблюдений). В целом они были слабо выражены, и, как правило, проходили самостоятельно в течение ближайших суток. Летальных исходов отмечено не было.
ЗАКЛЮЧЕНИЕ
Впервые в России проведено комплексное исследование инновационной технологии — неинвазивной дистанционной высокоинтенсивной фокусированной ультразвуковой абляции (HIFU). Исследование показало эффективность и безопасность этого метода при локальной деструкции вторичных опухолей печени независимо от их морфологической структуры. Операция HIFU-абляции легко переносится пациентами, не сопровождается выраженными интра- и послеоперационными осложнениями. Применение HIFU-абляции показано в случае невозможности хирургического лечения или в качестве этапа комбинированного лечения.








