В ЖКТ находится множество разнообразных микроорганизмов, необходимых для здоровья, но в то же время являющихся потенциальными причинами развития многих заболеваний. Изменения функции кишечного эпителиального барьера или естественной иммунной противобактериальной защиты могут приводить к воспалительному ответу посредством усиления проникновения бактериальных и пищевых антигенов, стимулирующих иммунную систему [25].
Взаимодействия между кишечными микробами и организмом человека являются объектом научных исследований с тех пор, как было отмечено влияние микробов на развитие множества заболеваний. В некоторых исследованиях с терапевтической целью преднамеренно изменяли кишечную микрофлору. Использование данного метода у пациентов с воспалительными заболеваниями кишечника, язвенным колитом, болезнью Крона, паучитом, антибиотикоассоциированной диареей (ААД) позволило накопить большой опыт, хотя клинические исследования затрагивали в основном начальные стадии заболеваний [6, 13].
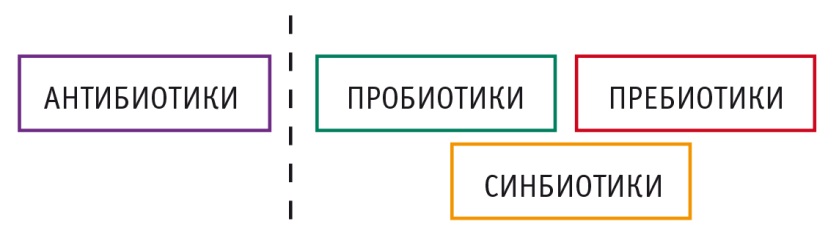
Существует несколько подходов, посредством которых можно изменить микрофлору кишечника: применение антибиотиков, пребиотиков (компонентов пищи, стимулирующих рост и метаболическую активность нормальной флоры), пробиотиков (в том числе бактерий нормальной флоры); трансплантация фекальной микробиоты (фекальная бактериотерапия). Возможно также комбинирование различных подходов, например использование пребиотиков и пробиотиков — синбиотиков (рис. 1). Интерес к этим методам увеличился после проведения клинических исследований.
Рис. 1. Группы препаратов, влияющих на состав кишечной микробиоты
Многие пациенты с воспалительными заболеваниями кишечника самостоятельно принимают пробиотики, поскольку при этом субъективно испытывают улучшение. Так, среди опрошенных больных язвенным колитом их использовали 51%, болезнью Крона — 43%. Такие пациенты при выборе пробиотика чаще всего ориентируются на рекламную информацию о продукте и, как правило, не сообщают врачу о его использовании. Прием пробиотика обсуждают с врачом менее 50% больных воспалительными заболеваниями кишечника [11, 29].
В связи с несомненной актуальностью использования пробиотиков как по назначению врачей, так и пациентами самостоятельно, целью данного обзора явились рассмотрение клинически значимых этиологических факторов диареи при различных состояниях и заболеваниях, обобщение результатов научных исследований применения пробиотиков при диарейном синдроме и обсуждение вопросов их выбора для предупреждения и коррекции диареи пробиотиками.
ПРОБИОТИКИ
Пробиотиками называют микроорганизмы, которые имеют свойства, полезные для человека. Их применяют с лечебной целью достаточно давно. Большинство препаратов первых поколений (как рецептурные и безрецептурные лекарственные средства, так и биологически активные добавки) получены из пищевых источников, в частности молочных культур.
Последние поколения пробиотиков разработаны на основе штаммов микроорганизмов, взятых у здоровых добровольцев и в большей степени соответствующих естественной микробиоте человека. С развитием микробиологии и биотехнологий качество препаратов возросло, появились новые формы выпуска и специальные носители, например капсулы и матрицы. Исследуются штаммы микроорганизмов и разрабатывается их оптимальный состав. В него включены штаммы молочнокислых бактерий (Lactobacillus и Bifidobacterium), непатогенные штаммы кишечной палочки (Escherichia coli Nissle 1917), Clostridium butyricum, Streptococcus salivarius и Saccharomyces boulardii (непатогенный штамм дрожжевых грибов), и список продолжает расти. Разрабатываются также специализированные штаммы бактерий (модифицированных с использованием генной инженерии), нацеленные на иммуномодуляцию [23].
Активно развивается современная концепция восстановления видов потенциально протективных комменсальных бактерий, количество которых уменьшается при некоторых заболеваниях, например при болезни Крона [8].
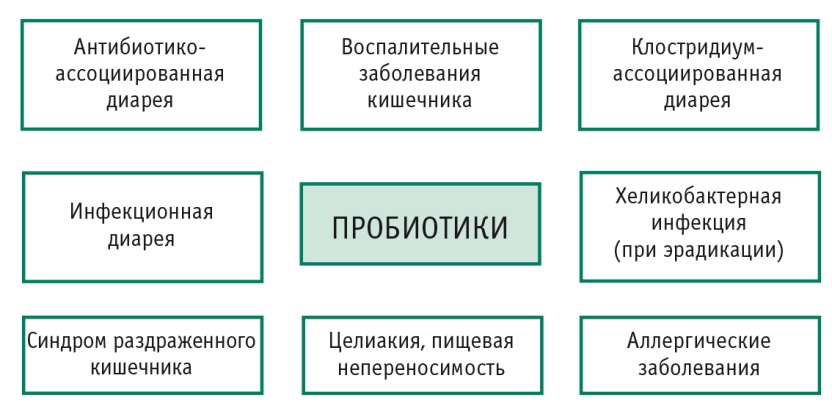
При таких тяжелых заболеваниях ЖКТ, как воспалительные заболевания кишечника (например, паучит), в некоторых исследованиях подтверждена потенциальная польза применения отдельных видов пробиотиков (взятых изолированно или в комбинациях). Получены данные, показывающие эффективность применения пробиотиков при ААД, C. difficile-токсининдуцированном колите, инфекционной диарее, печеночной энцефалопатии, синдроме раздраженного кишечника, аллергических заболеваниях [10, 22, 26].
Основные механизмы действия пробиотиков
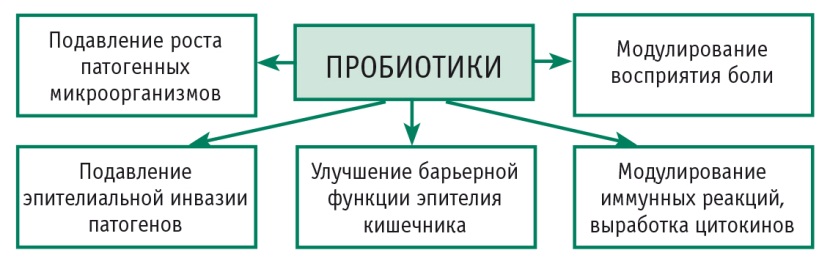
В настоящее время механизмы действия большинства пробиотических штаммов полностью не изучены. Однако описаны четыре их основных эффекта в отношении ЖКТ.
1. Супрессия роста или эпителиальной инвазии патогенных микроорганизмов [14].
2. Улучшение кишечной барьерной функции [31].
3. Модулирование иммунных реакций.
Некоторые виды пробиотических штаммов или их продукты индуцируют выработку защитных цитокинов, включая ИЛ-10 и тканевой фактор роста бета, и угнетают выработку провоспалительных цитокинов, таких как ФНО, в слизистой оболочке у пациентов с паучитом, язвенным колитом, болезнью Крона и в изолированных клеточных культурах. Пробиотические штаммы посредством воздействия на медиаторы воспаления ограничивают миграцию Тh1 в очаг воспалительного процесса в кишечнике [19, 24].
4. Изменение восприятия боли и снижение висцеральной гиперчувствительности.
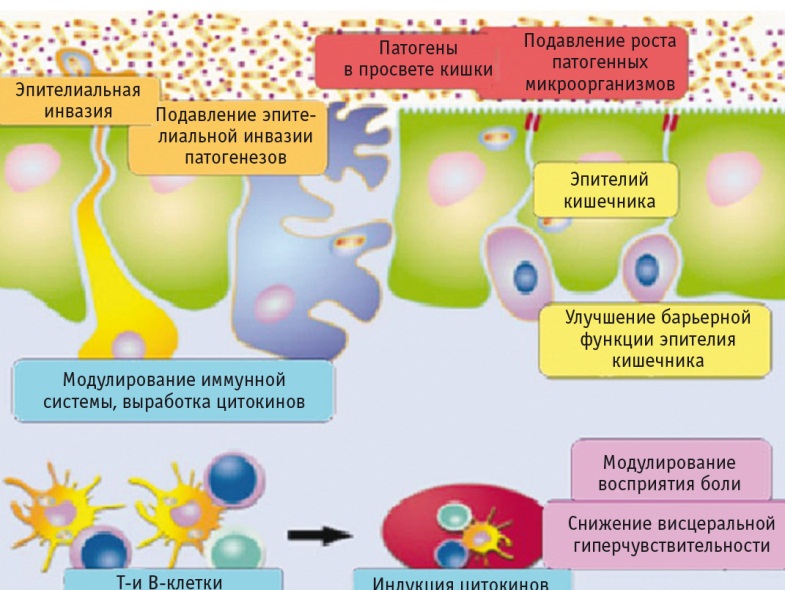
Некоторые штаммы лактобактерий способны индуцировать экспрессию микроопиоидных и каннабиноидных рецепторов в эпителиальных клетках кишечника и опосредовать анальгезирующую функцию в кишечнике, схожую с действием морфина (рис. 2) [28].
Рис. 2. Подтвержденные механизмы действия и эффекты пробиотиков
Пробиотические штаммы различаются по способности противостоять разрушающему воздействию соляной кислоты желудочного сока и желчных кислот при доставке в кишечник. Колонизационная способность штаммов различна, для отдельных видов микроорганизмов необходимы специальные формы выпуска или доставки.
Типы пробиотиков
Не все пробиотики одинаковы, отдельные их виды или комбинации проявляют различные клинические эффекты. Разрабатываются специальные комбинации штаммов микроорганизмов для решения конкретных задач в зависимости от требований клиницистов. Зная основные свойства отдельных штаммов, комбинируя их, можно получать достаточно стойкий и прогнозируемый эффект. Этот подход, все более распространяющийся в различных областях медицины, получил название таргетного, или целевого, подхода.
Большинство пробиотиков имеют неспециализированный состав и, соответственно, бывают малоэффективны при конкретных нозологиях. Их действие крайне слабо ввиду недостаточности как количества микроорганизмов, так и их «специализации». Пробиотические препараты зачастую назначаются без обоснования, врачи не учитывают патогенетические механизмы развития нарушений микробиоценоза кишечника при конкретном заболевании. Для достижения выраженного положительного эффекта в каждой конкретной клинической ситуации необходимо выбирать специализированные наборы штаммов и видов микроорганизмов. При этом необходимо учитывать нацеленность воздействия пробиотических продуктов на патогенетические звенья патологического процесса [6].
Именно с практической позиции важно оценивать состав пробиотика. В разработанной нами классификации выделены три типа пробиотиков в зависимости от их состава:
-
одноштаммовые;
мультиштаммовые, содержащие несколько штаммов одного вида микроорганизмов;
-
многовидовые, содержащие штаммы разных видов бактерий.
H. M. Timmerman и соавт. (2004), исследуя эффекты одноштаммовых, мультиштаммовых и многовидовых препаратов, продемонстрировали, что пробиотики, содержащие большое количество видов, обладают явным преимуществом. Это объясняется тем, что для таких пробиотиков характерно не только взаимодействие бактерий с организмом, но и межмикробное взаимодействие. Полученные данные открывают возможности для создания пробиотических продуктов с направленным действием, т. е. средств для дифференцированного влияния на механизмы развития различных патологических процессов [32].
Одним из первых продуктов, где реализован данный подход, в 2011 г. стал пробиотический комплекс РиоФлора, разработанный с использованием технологии создания таргетных пробиотиков в Winclove B.V. (Нидерланды) специально для предотвращения развития побочных эффектов антибиотикотерапии.
Данный многовидовой комплекс содержит восемь штаммов пробиотических микроорганизмов: два штамма бифидобактерий (B. lactis W51, B. bifidum W23) и шесть штаммов лактобацилл (L. plantarum W62, L. acidophilus W37, L. acidophilus W55, L. rhamnosus W71, L. paracasei W20, L. salivarius W24). Для бактерий, входящих в состав данного продукта, характерны высокая и довольно узкоспециализированная функциональная активность, хорошая выживаемость в ЖКТ, а также способность сохранять активность при комнатной температуре не менее 2 лет. Таким образом, пробиотик способен воспроизводить эффекты разных видов и штаммов полезных микроорганизмов, присутствующих в кишечнике здорового человека.
Продукт РиоФлора, являясь мультивидовым, оказывает свое действие на трех уровнях [4, 5]:
-
в просвете кишечника (ингибирование роста патогенных микрорганизмов);
- на поверхности кишечного эпителия (восстановление барьерной функции слизистой оболочки кишечника);
-
в иммунных клетках кишечника (иммуномодулирующий эффект, повышение уровня иммуноглобулинов).
Особенностью пробиотического комплекса РиоФлора является не только специально подобранный мультивидовой и мультиштаммовый состав, но и современная технология повышения эффективности пробиотиков ProbioAct (Winclove B.V., Нидерланды), позволяющая увеличить выживаемость микроорганизмов в агрессивной среде ЖКТ и сохранить их высокую метаболическую активность в кишечнике.
Другие механизмы действия пробиотиков
Интересны наблюдения, которые показывают, что назначение пациентам живых микроорганизмов не является обязательным для получения положительного результата. Секретируемые протеины и ДНК одного из комбинированных пробиотиков, содержащих лакто- и бифидобактерии, блокируют активацию цитокинов и предотвращают апоптоз эпителиальных клеток кишечника. Эффект зависит от специфики ДНК различных видов бактерий, являющихся компонентами препарата [37].
Комбинации ДНК лакто- и бифидобактерий так же эффективно, как и случайно отобранные виды кишечной палочки, подавляют экспериментальный колит. Эти терапевтические воздействия опосредуются через Toll-подобные рецепторы 9-го типа и индукцию ИФН-1α и ИФН-1β [27].
Белки из разных видов пробиотиков, включая лактобактерии GG, могут ингибировать провоспалительные сигналы и воспалительный цитокининдуцированный апоптоз в эпителии толстого кишечника с помощью механизма рецепторов эпидермального фактора роста [36].
АНТИБИОТИКОАССОЦИИРОВАННАЯ ДИАРЕЯ
На сегодняшний день имеются результаты многочисленных многоцентровых исследований по применению различных пробиотиков в лечении и профилактике ААД. По итогам систематических обзоров, пробиотики эффективно снижают частоту возникновения диареи у пациентов, принимающих антибиотики. Однако в связи с разнородностью данных не удается утвердить необходимые дозы и длительность применения пробиотиков для получения эффекта у разных групп пациентов [18, 34].
В крупном систематическом обзоре 2012 г. были изучены 82 рандомизированных исследования пробиотиков, применявшихся для профилактики ААД. В большинстве из них (69%) ученые использовали различные виды лактобактерий, по отдельности или в комбинациях с другими организмами. Пробиотик, основанный на дрожжевых грибах (Saccharomyces boulardii, Hansen), назначали пациентам в 16 исследованиях (20%). По данным метаанализа, выполненного на основании 63 исследований, включавших 11 811 пациентов, у лиц, которые принимали пробиотики, риск развития ААД был на 42% меньше, чем в группе контроля (без применения пробиотиков). Количество пациентов, нуждавшихся в получении пробиотиков для предотвращения одного случая ААД, составило 13 человек. В 17 исследованиях, в которых изолированно использовали лактобактерии, риск развития ААД снизился на 36% [12].
Авторы всех приведенных исследований анализировали различные штаммы пробиотических микроорганизмов, показав при этом их разную эффективность. В результате были определены штаммы, оказывавшие наиболее выраженное положительное действие при диарее, связанной с приемом антибактериальных препаратов.
Один из наиболее эффективных наборов штаммов для профилактики ААД сконцентрирован в продукте РиоФлора. Доказано положительное влияние данного пробиотика на метаболизм микробной флоры кишечника. Благодаря его действию повышалась активность представителей нормальной микробиоты, снижалась активность протеолитической микробиоты, а также увеличивалась интенсивность синтеза бутирата, играющего важную роль в процессах пролиферации эпителия крипт и регуляции моторики толстой кишки [2].
Специализированный пробиотический микробный комплекс РиоФлора клинически изучен. Состав препарата позволяет применять его для снижения риска развития кишечных расстройств, связанных с приемом антибиотиков [16].
При одновременном использовании с антихеликобактерной терапией РиоФлора оказывал протективное действие на микробиоту кишечника, демонстрировал эффективность при коррекции развившихся дисбиотических изменений: успешно ликвидировал связанные с ними симптомы диспепсии и восстанавливал нормальную метаболическую активность микробиоты кишечника [1, 16].
РиоФлора более эффективен, чем моноштаммовые пробиотики, благодаря синергизму различных видов пробиотических микроорганизмов и симбиозу штаммов. Его многовидовой состав имеет улучшенную функциональность по сравнению с пробиотиками, содержащими разные штаммы одного вида, и моноштаммными пробиотиками [16].
Для предотвращения развития побочных эффектов антибактериальной терапии (диарея, запор, метеоризм) РиоФлора рекомендуется взрослым и детям старше 3 лет по 2 капсулы 2 раза в сутки, желательно натощак (утром и перед сном) в течение 10-14 дней. Возможно растворение содержимого капсулы в теплой воде, молоке или йогурте (если пациенту сложно проглотить целую капсулу). При необходимости прием продукта можно повторить.
ИНФЕКЦИОННАЯ ДИАРЕЯ
Пробиотики, зарегистрированные в качестве лекарственных средств, могут рассматриваться в качестве средства терапии у взрослых и детей с подозрением на инфекционную диарею. Множество систематических обзоров демонстрируют умеренное снижение длительности заболевания при лечении пробиотиками. Данные о специфических штаммах микроорганизмов, дозировках, длительности лечения и механизмах защиты в зависимости от этиологии заболевания ограниченны. Неясно также, могут ли пробиотики снижать риск развития дегидратации и истощения [21].
Метаанализ 2010 г., включавший 63 рандомизированных контролируемых исследования с использованием различных пробиотических препаратов при участии взрослых и детей, выявил уменьшение риска развития диареи спустя 4 дня терапии более чем у 59% пациентов и снижение средней продолжительности диареи на 25 часов. Двумя наиболее изученными пробиотиками были лактобациллы и сахаромицеты [7].
В метаанализе 9 исследований (2002) оценивали эффективность некоторых штаммов лактобактерий в снижении длительности симптомов острой инфекционной диареи у детей. Было установлено, что пробиотики уменьшают длительность диареи на 0,7 дня и ее частоту на вторые сутки до 1,6 раза в день. По результатам метаанализа, пациенту необходимо получать минимум 10 млн КОЕ в течение первых 48 часов для снижения длительности диареи более чем на половину дня [33].
Пробиотики значительно ускоряют восстановление после острой ротавирусной диареи у детей. В двойном слепом плацебоконтролируемом исследовании, включавшем 230 детей с острой ротавирусной диареей, комбинированные препараты, в которых содержатся лакто- и бифидобактерии, значительно снижали частоту стула [15]. В другом рандомизированном исследовании лактобактерии демонстрировали дозонезависимое снижение выделения ротавируса с калом [9].
ДРУГИЕ ЗАБОЛЕВАНИЯ
Потенциальная роль пробиотиков в профилактике диареи, вызванной C. difficile, у пациентов с высоким риском также подтверждена исследованиями. Некоторые штаммы пробиотических микроорганизмов подавляют рост клостридий в кишечнике, другие ингибируют действие токсина или связывают его. Доказан позитивный эффект пробиотиков при диарее путешественников [22, 30].
В литературе есть множество данных об эффективности пробиотиков при воспалительных заболеваниях кишечника, микроскопическом и коллагенозном колите; описаны положительные результаты их применения при запорах и синдроме раздраженного кишечника [35].
Пробиотики имеют огромный потенциал в снижении проницаемости кишечника и генерации провоспалительных цитокинов, экспрессия которых значительно повышена у пациентов с аллергическими заболеваниями. Отдельного внимания заслуживает применение таких препаратов в эрадикационной терапии Helicobacter pylori. На основании целого ряда исследований пробиотики были включены в схемы эрадикации Маастрихт IV, поскольку повышают ее эффективность на 15-20%. Подобные работы проводили и с использованием РиоФлора [1].
Перечисленные выше заболевания и состояния также являются актуальными, но не входят в тему данного обзора (рис. 3) [20].
Рис. 3. Спектр заболеваний и патологических состояний, при которых эффективность применения пробиотиков доказана
ВЫБОР ПРОБИОТИКА
Исследования, приведенные в таблице 1, и анализ свойств разных штаммов пробиотиков (табл. 2) способствовали формированию единых принципов отбора штаммов для изготовления комплексных биопрепаратов. Ученые фокусировали внимание на определенных свойствах конкретных штаммов микроорганизмов, ими было установлено преобладание тех или иных свойств у выбранных штаммов. В дальнейшем эти результаты позволяли подобрать оптимальный видовой состав пробиотического препарата для решения конкретной задачи [32].
Таблица 1
Исследования применения пробиотиков при диарее
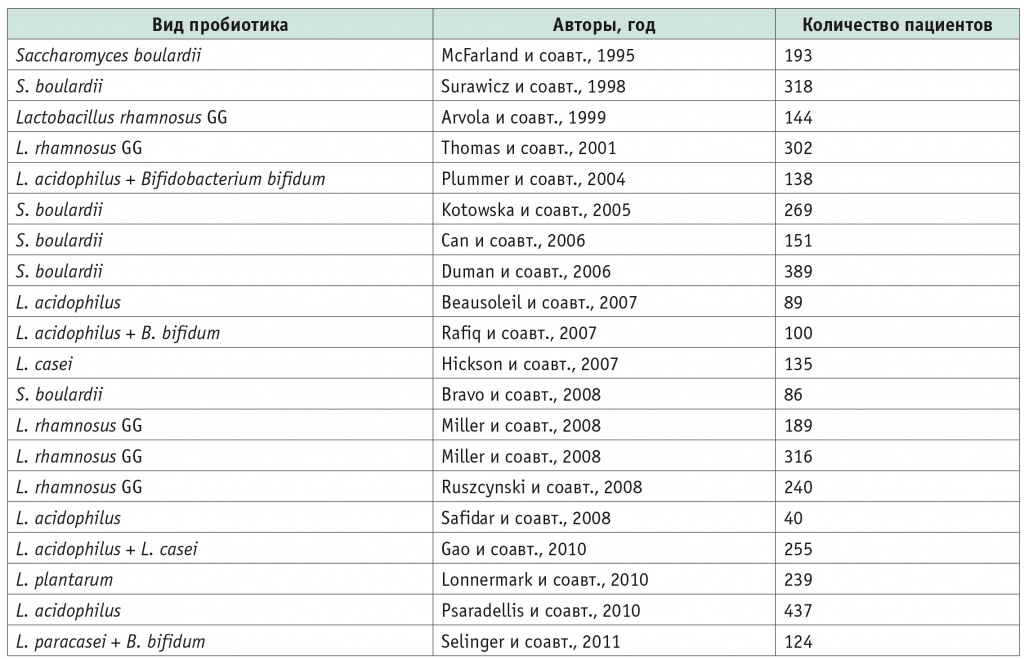
Таблица 2
Состав и свойства пробиотических микроорганизмов пробиотика РиоФлора
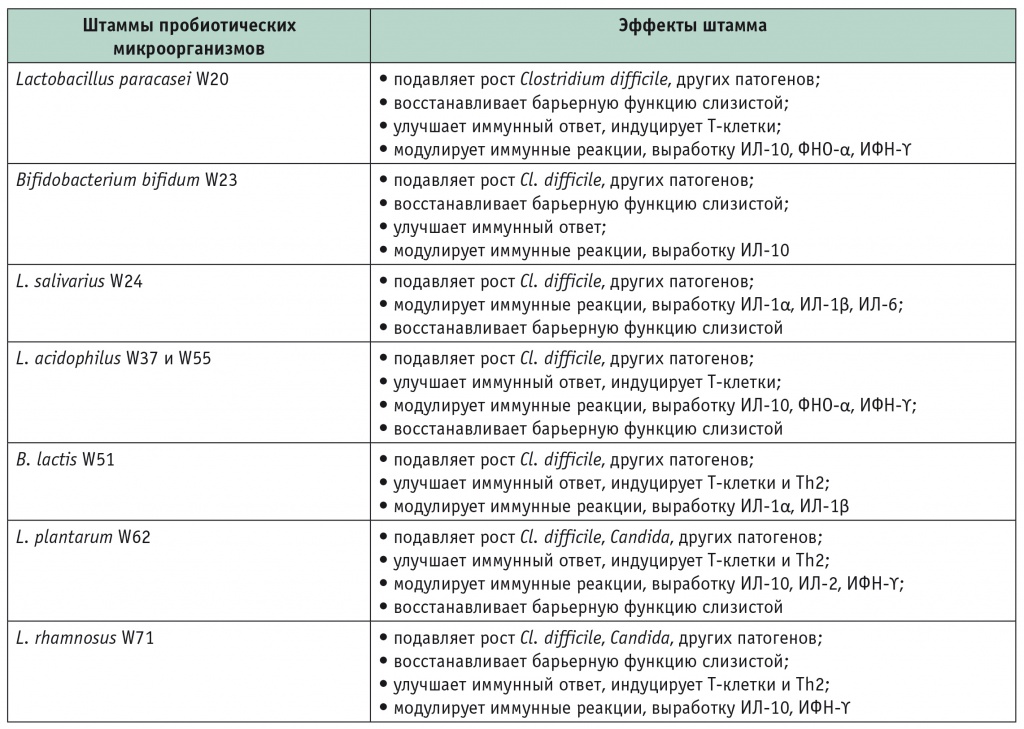
Примечание. ИЛ — интерлейкины; ИФН — интерферон; ФНО — фактор некроза опухоли; Th — T-хелперы.
Научные данные обосновывают применение продукта РиоФлора в качестве комплекса штаммов пробиотиков определенного спектра действия, специально разработанного для снижения риска развития кишечных расстройств (диарея, запор, метеоризм), вызванных приемом антибиотиков [17].
Смесь штаммов пробиотических микроорганизмов сдерживает рост болезнетворных бактерий, поддерживает и восстанавливает полезную микрофлору кишечника, снижая риск развития кишечных расстройств при приеме антибиотиков, и активизирует иммунитет. Штаммы микроорганизмов, входящих в состав продукта, способствуют восстановлению барьерной функции эпителия кишечника на всем его протяжении (см. табл. 2) [2, 3].
За счет комплексного модулирующего действия штаммов, входящих в состав РиоФлора, происходит индукция Т-клеток разного типа, усиливается продукция цитокинов иммунокомпетентными клетками (рис. 4). Подобное иммуногенное воздействие способствует уменьшению выраженности воспаления в слизистой оболочке кишечника, что приводит к уменьшению симптомов диареи.
Рис. 4. Основные эффекты компонентов РиоФлора
ЗАКЛЮЧЕНИЕ
Определенные штаммы пробиотиков эффективны при диарее, возникающей при заболеваниях ЖКТ. Однако различия между штаммами весьма значительны, что необходимо учитывать при выборе пробиотика для конкретных клинических ситуаций.
Современные технологии позволяют создавать специализированные бактериальные препараты нового поколения, характеризующиеся узконаправленным действием и наибольшей эффективностью при определенных нозологиях.
При кишечных расстройствах и нарушениях микробиологического пейзажа, ассоциированных с приемом антибактериальных препаратов, представляется целесообразным применение пробиотического комплекса РиоФлора ввиду целенаправленности его действия и эффективности.








