Однако хирург стремится не только создать путь для прохождения пищи, но и с помощью операции добиться удовлетворительного качества жизни пациента при минимальных осложнениях.
Цель исследования: сравнительный анализ результатов лечения детей с АП после отсроченного эзофагоэзофагоанастомоза и колоэзофагопластики.
МАТЕРИАЛЫ И МЕТОДЫ
На базе ДГКБ № 13 им. Н. Ф. Филатова г. Москвы с 2007 по 2017 г. прооперированы 187 детей с АП. Первичный анастомоз пищевода выполнен у 152 (81,3%) детей с трахеопищеводным свищом (ТПС). Перевязка свища сделана 3 (1,6%) детям с изолированным ТПС. У 5 (2,7%) новорожденных с бессвищевой формой АП выведена эзофаго и гастростома для последующей колоэзофагопластики. Остальным 27 (14,4%) участникам исследования наложена гастростома для выполнения отсроченного эзофагоэзофагоанастомоза. В первые 12 дней с момента поступления 7 (26%) из этих 27 новорожденных умерли. В 3 случаях причиной смерти стала сопутствующая аномалия, в 2 — аспирационная пневмония, в 2 — генерализованная инфекция. Впоследствии 20 выжившим детям с гастростомой выполнен отсроченный эзофагоэзофагоанастомоз.
Кроме того, с 2007 по 2017 г. в ДГКБ № 13 им. Н. Ф. Филатова поступили еще 47 детей с АП из других клиник после выведения эзофаго и гастростомы для выполнения колоэзофагопластики. Впоследствии 52 детям с эзофаго и гастростомой проведена колоэзофагопластика.
В зависимости от метода хирургической коррекции АП для сравнительного анализа результатов лечения выделены две группы прооперированных нами детей: 1ю группу составили 20 детей после отсроченного эзофагоэзофагоанастомоза; 2ю — 52 ребенка после колоэзофагопластики.
Первая группа включала 11 (55%) девочек и 9 (45%) мальчиков. Гестационный возраст детей на момент рождения — 29–40 недель (в среднем — 34,15 недели), средняя масса тела — 1865,5 г. Средний возраст больных к моменту операции — 3 мес, масса тела — 3443,2 г. По классификации Gross, бессвищевую форму АП наблюдали у 7 (35%) детей, АП с дистальным ТПС — у 13 (65%). Девятнадцати больным наложен отсроченный анастомоз пищевода торакоскопически, одному выполнена заднебоковая торакотомия, так как до 2008 г. в ДГКБ № 13 им. Н. Ф. Филатова торакоскопическую коррекцию АП не делали. Для снижения натяжения в области анастомоза у всех детей проведена протяженная мобилизация орального и аборального концов пищевода от шейного отдела до желудка. В 6 случаях для удлинения орального сегмента пищевода в начале операции выполнена циркулярная миотомия.
Во 2ю группу входили 23 (44,2%) девочки и 29 (55,8%) мальчиков. Гестационный возраст детей на момент рождения составлял 31–40 недель (в среднем — 36,19 недели), средняя масса тела — 2429,1 г. Средний возраст к моменту операции — 1 год 3 мес, масса тела — 8981,1 г. По классификации Gross, бессвищевая форма АП зарегистрирована у 31 (59,6%), АП с дистальным ТПС — у 18 (34,6%), АП с проксимальным ТПС — у 3 (5,8%) пациентов. Всем детям выполнена загрудинная колоэзофагопластика.
В 1й группе сопутствующие пороки развития выявлены у 10 (50%) детей, ассоциацию VACTER наблюдали у 4 (20%), а порок сердца — у 8 (40%) больных. Во 2й группе сопутствующие пороки развития обнаружены у 22 (42,3%), ассоциация VACTER — у 4 (7,7%) детей, ассоциация CHARGE — у 1 (1,9%) ребенка, а порок сердца — у 8 (15,4%) (табл. 1).
Таблица 1
Сопутствующие пороки развития у детей с атрезией пищевода, n (%)
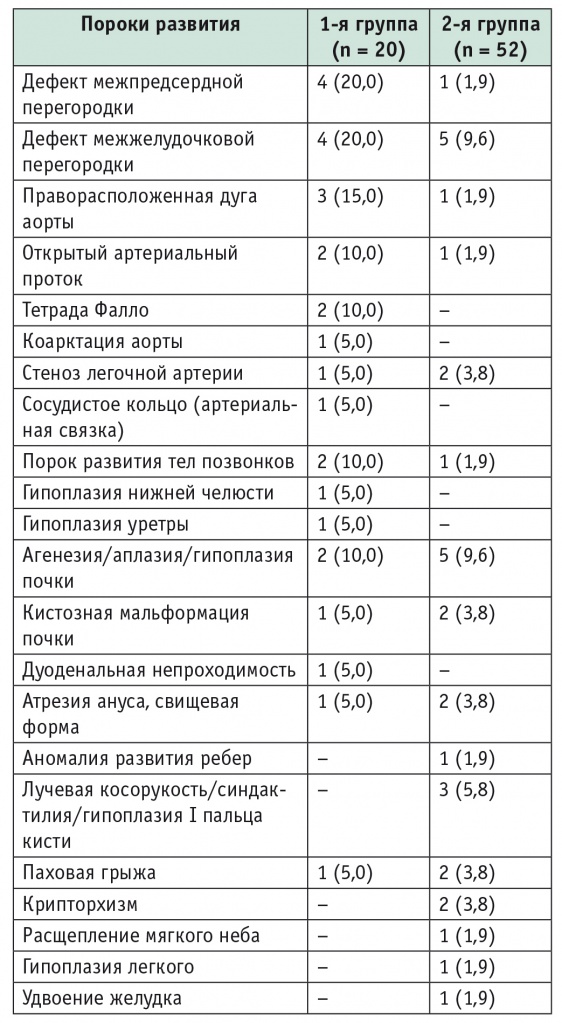
Таким образом, в 1й группе преобладали врожденные пороки сердца и крупных сосудов, суммарная доля которых составила 90% всех сочетанных пороков развития. По классификации Spitz (1994), тяжелые пороки развития сердца наряду с массой тела при рождении существенно влияют на выживаемость детей с АП [10–14]. Следовательно, участники 1й группы поступали в хирургический стационар в более тяжелом состоянии, изначально определявшем худшие прогнозы.
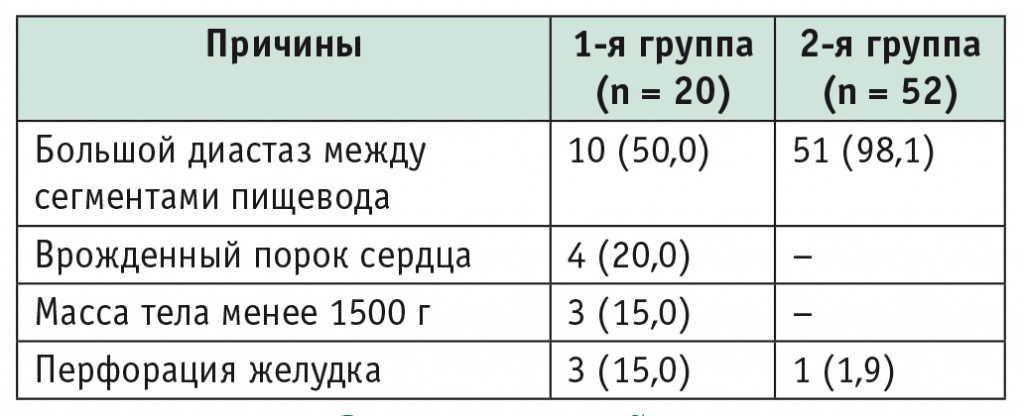
Основные причины, заставившие отложить хирургическую коррекцию АП в обеих группах, представлены в таблице 2.
Таблица 2
Причины, заставившие отложить хирургическую коррекцию атрезии пищевода, n (%)
Методика оперативного вмешательства
В 1й группе детям выполняли отсроченный эзофагоэзофагоанастомоз пищевода. Методика данного вмешательства описана ранее [15]. Ребенка укладывали на живот с приподнятым на 30° правым боком. Мы использовали эндотрахеальную анестезию. В 19 случаях вмешательство осуществляли через правую плевральную полость и в 1 случае, при праворасположенной дуге аорты, — слева. В плевральную полость устанавливали 3 троакара (2 троакара диаметром 4 мм и 1 диаметром 3 мм). Первый троакар (4 мм) для телескопа устанавливали в пятом межреберье по задней подмышечной линии, а второй и третий троакары для эндоскопических инструментов — в третьем и восьмом межреберьях. Инсуффляцию CO2 в плевральную полость проводили под давлением 4–6 мм рт. ст. Этапы оперативного вмешательства:
- мобилизация орального и аборального отделов пищевода;
- вскрытие просветов обоих концов пищевода;
- формирование эзофагоэзофагоанастомоза.
Во 2й группе детям выполнена колоэзофагопластика. Положение ребенка — на спине. Доступ — верхнесрединная лапаротомия. Отсекали гастростому и мобилизовали желудок по большой кривизне с выделением и удалением аборального отдела пищевода. Выполняли пилоромиотомию для декомпрессии желудка. Выкраивали изоперистальтический трансплантат поперечной ободочной кишки на левой ободочной артерии и вене.
Пассаж по толстой кишке восстанавливали наложением однорядных швов между приводящим и отводящим отделами кишки по типу «конец в конец». Разрезом на шее выделяли пищевод. Ножку трансплантата помещали позади желудка (в 2 случаях — кпереди от желудка). Накладывали антирефлюксный анастомоз между дистальным отделом трансплантата и передней стенкой дна желудка по авторской методике [16].
Вплотную к грудине через лапаротомный и шейный доступы вслепую пальцами и тупым инструментом формировали загрудинный тоннель и проводили трансплантат на шею. Анастомоз на шее накладывали однорядным или двухрядным швом между оральным отделом пищевода и трансплантатом по типу «конец в конец». При этом следили за умеренным натяжением трансплантата и отсутствием лишних петель и перегибов на всем его протяжении.
Желудок позади анастомоза фиксировали к краю диафрагмы, отделенной от грудины. Операцию завершали наложением новой гастростомы для декомпрессии и кормления ребенка.
Во 2й группе также выполнены симультанные операции 3 больным. В первом случае пациенту с паховомошоночной грыжей справа ушивали внутреннее паховое кольцо; во втором ребенку с двусторонней паховомошоночной грыжей сделано ушивание внутренних паховых колец; в третьем больному с желчнокаменной болезнью и вентральной грыжей выполнена холицистэктомия, пластика передней брюшной стенки.
РЕЗУЛЬТАТЫ
Критерии сравнительной оценки результатов лечения:
- течение послеоперационного периода;
- послеоперационные осложнения;
- отдаленные результаты;
- летальность.
Таблица 3
Продолжительность различных этапов послеоперационного периода, сутки
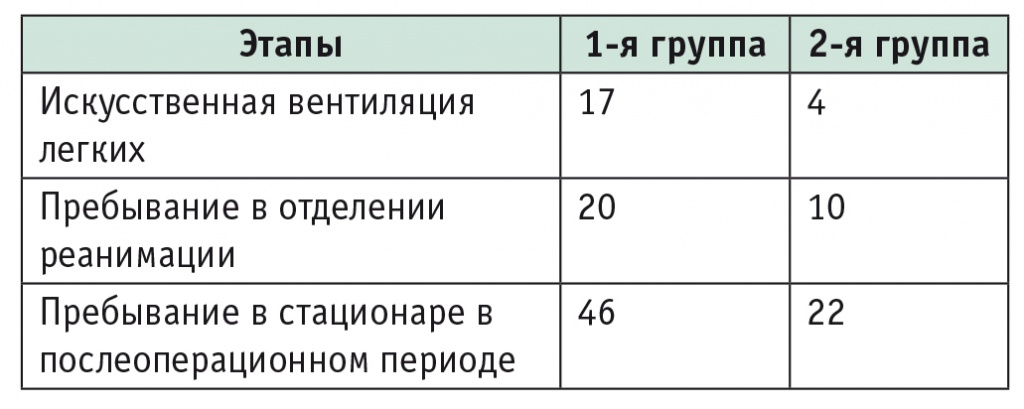
Участникам 1й группы была необходима существенно более длительная ИВЛ, они дольше находились в отделении реанимации и в стационаре.
Интраоперационные осложнения возникли у 1 (5%) ребенка из 1й группы и у 3 (5,8%) детей из 2й группы. У пациента 1й группы ушита поврежденная ветвь грудного лимфатического протока. Интраоперационные осложнения у больных 2й группы — ушиты:
1) поврежденная артерия на шее;
2) трахея, поврежденная при выделении орального сегмента пищевода;
3) дуоденум, вскрытый при пилоромиотомии.
Послеоперационные осложнения развились у 18 (90%) детей в 1й группе и у 30 (57,7%) во 2й. Структура осложнений в зависимости от метода коррекции АП представлена в таблице 4.
Таблица 4
Структура послеоперационных осложнений в исследуемых группах, n (%)
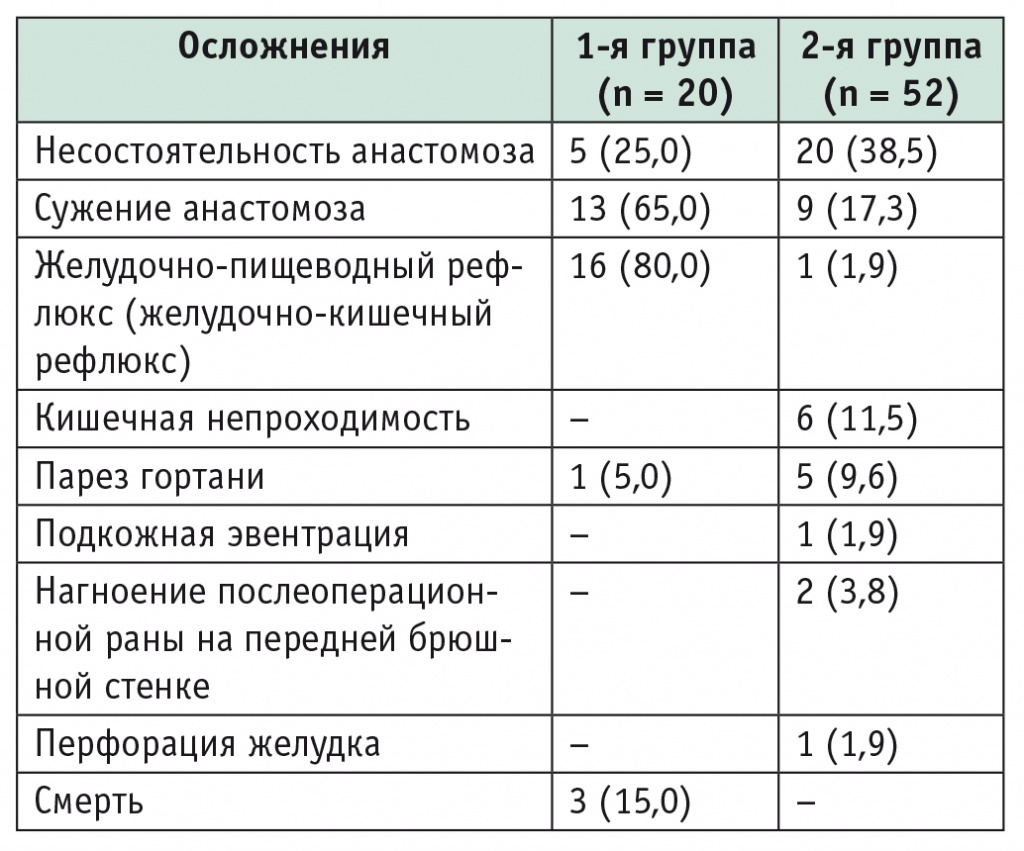
В целом, в 1й группе выше частота послеоперационных осложнений, особенно желудочнопищеводного рефлюкса (ЖПР).
Выбор тактики лечения детей с несостоятельностью анастомоза зависел от тяжести состояния и выраженности дефекта анастомоза. У одного из больных 1й группы изза тяжести состояния, обусловленного течением генерализованной инфекции и развитием медиастинита, проводили консервативную терапию без положительного эффекта. В 2 случаях вследствие выраженного ЖПР консервативную терапию необходимо было дополнить лапароскопической фундопликацией. У 2 детей обнаружен большой дефект анастомоза, в связи с чем в одном случае выполнено торакоскопическое ушивание дефекта, в другом — экстирпация пищевода. У одного ребенка во 2й группе ушит большой дефект эзофагоколоанастомоза, в остальных случаях слюнные свищи зажили самостоятельно.
У всех детей со стенозом анастомоза при эндоскопии диаметр просвета пищевода в зоне анастомоза был в пределах 1–9 мм. Всем им производили бужирование пищевода, и лишь одному пациенту во 2й группе потребовалась реконструкция анастомоза через год после колоэзофагопластики.
В связи с выраженной клинической картиной ЖПР и неэффективностью консервативной терапии 12 (60%) пациентам 1й группы выполнена лапароскопическая фундопликация по Ниссену. Восемь из них прооперированы в раннем послеоперационном периоде (до 3 месяцев с момента хирургического вмешательства), их не выписывали из стационара. Во 2й группе выполнена реконструкция кологастроанастомоза в раннем послеоперационном периоде.
Кишечная непроходимость отмечена только у 6 (11,5%) пациентов 2й группы, из них у 5 — спаечная кишечная непроходимость, у одного ребенка — ущемление петли тонкой кишки в окне брыжейки. Трое из них были оперированы в раннем послеоперационном периоде (до 3 месяцев с момента хирургического вмешательства).
Выбор тактики лечения детей с парезом гортани зависел от выраженности дыхательной недостаточности. Одному пациенту 1й группы и 3 детям из 2й проводили консервативную нейротропную терапию с положительным эффектом. Двум детям из 2й группы, помимо медикаментозного, было необходимо хирургическое лечение: в первом случае — пластика гортани реберным хрящом, трахеостомия через 3 мес, затем, через 1 год 5 мес после колоэзофагопластики, установлена Тобразная трубка; во втором — резекция черпаловидного хряща слева через 5 лет после колоэзофагопластики.
Осложнения послеоперационной раны наблюдали у 3 (5,8%) детей 2й группы. Ребенку с подкожной эвентрацией выполнено ушивание дефекта апоневроза на 3и послеоперационные сутки, нагноение послеоперационной раны зажило консервативно.
У одного ребенка во 2й группе послеоперационный период осложнился несостоятельностью ушитой ранее гастростомы (отсеченной во время колоэзофагопластики), выполнено ушивание желудка.
Летальные исходы зафиксированы только в 1й группе, их доля составила 15%. В 2 случаях причиной смерти послужила генерализованная инфекция, в одном — бронхолегочная дисплазия. Двое из умерших детей имели ассоциацию VACTER.
Мы проследили отдаленные результаты лечения пациентов с АП в среднем через 3 года после операции. В 1й группе удалось оценить отдаленные результаты у 15 из 17 выживших детей, во 2й группе — у 37, так как остальных (2 из 1й группы и 15 из 2й) больше не госпитализировали в отделение.
Для оценки отдаленных результатов лечения мы использовали анкетный опрос родителей. Форма анкеты, содержавшей перечень вопросов с вариантами ответов, разработана авторами. Результаты опроса представлены в таблице 5.
Таблица 5
Распределение респондентов по ответам на вопросы анкеты при оценке отдаленных результатов оперативного лечения пациентов с атрезией пищевода, n (%)
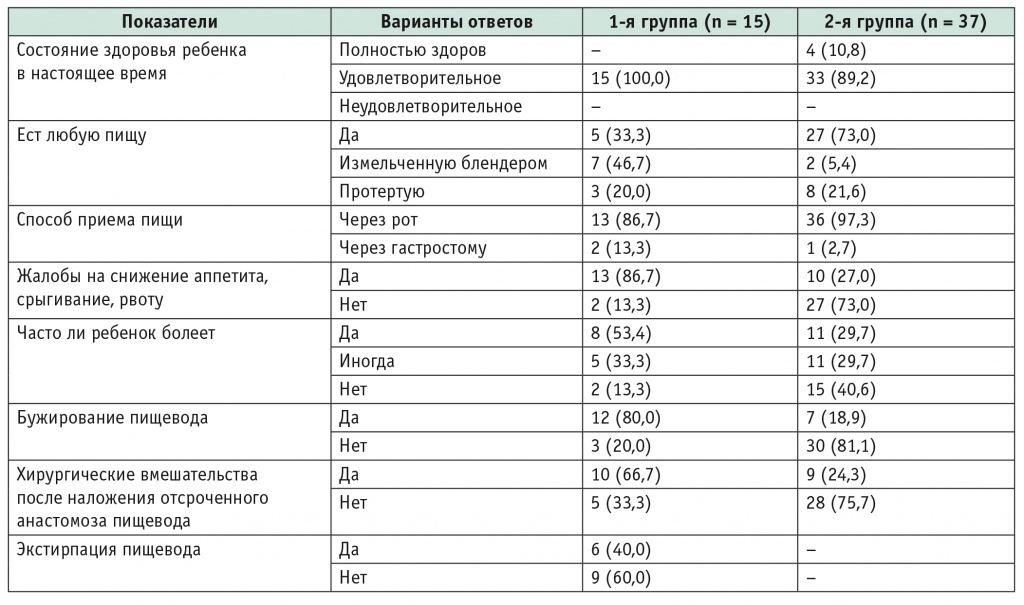
Все 15 (100%) опрошенных родителей участников 1й группы оценивают состояние своих детей как удовлетворительное. Среди родителей детей 2й группы 4 (10,8%) считали детей полностью здоровыми, 33 (89,2%) оценивали их состояние как удовлетворительное.
Восемь (53,3%) родителей больных 1й группы и 11 (29,7%) 2й группы считают своих детей часто болеющими. Основными заболеваниями являлись бронхиты и ОРВИ.
Бужирование пищевода проводили 12 (80,0%) детям в 1й группе (число бужирований варьировало от 5 до 52, в среднем — 20) и 7 (18,9%) детям во 2й группе (1–20 бужирований, в среднем — 5).
После операции отсроченного анастомоза пищевода в 1й группе были повторно оперированы 10 (66,7%) пациентов в среднем на 6й месяц после коррекции АП. Всем 10 прооперированным была выполнена фундопликация по Ниссену. У 3 из них сформировалась грыжа пищеводного отверстия диафрагмы (ГПОД) с рецидивирующим ЖПР: двоим проведена хиатопластика и лапарокопическая фундопликация в среднем через год после операции; одному ребенку изза нарушения адекватного кормления в связи с ГПОД и рецидивирующим неконтролируемым ЖПР пришлось выполнить экстирпацию пищевода в раннем послеоперационном периоде. Во 2й группе повторно прооперированы 9 (24,3%) детей, средний срок от колоэзофагопластики составил 9 мес. Причины повторных операций:
- кишечная непроходимость (n = 4);
- парез гортани (n = 2);
- выраженный ЖПР (n = 1);
- стеноз эзофагоколоанастомоза (n = 1);
- ущемление петли тонкой кишки в окне брыжейки (n = 1);
- эвентрация (n = 1).
В отдаленном периоде, через 5 мес после наложения отсроченного анастомоза пищевода, в 1й группе умер один ребенок. Причиной смерти был врожденный порок сердца. Во 2й группе летальных исходов в отдаленном периоде не зафиксировано.
ОБСУЖДЕНИЕ
Невозможность выполнения первичного анастомоза при АП в периоде новорожденности остается актуальной проблемой для большинства детских хирургов. В таких случаях показано наложение отсроченного эзофагоэзофагоанастомоза либо замена пищевода толстой кишкой или желудком. Однако хирург стремится не только создать путь для прохождения пищи, но и с помощью операции добиться удовлетворительного качества жизни пациента при минимальных осложнениях.
По данным метаанализа 44 статей, выполненного в 2012 г. F. Friedmacher и P. Puri, после наложения отсроченного эзофагоэзофагоанастомоза частота несостоятельности анастомоза составляла 22,9–35,3%, сужения анастомоза — 50,9–62,9%, ЖПР — 41,8–53,9%, летальных исходов — 7,3–14,1% [17]. Сравнивая наши результаты аналогичных операций с литературными данными, следует подчеркнуть высокую частоту ЖПР (80%) после отсроченного анастомоза пищевода. В связи с выраженной клинической картиной и неэффективностью консервативной терапии 12 (60%) детям выполнена лапароскопическая фундопликация по Ниссену.
Вероятно, высокая частота и значительная тяжесть ЖПР после отсроченного анастомоза пищевода связаны с протяженной мобилизацией аборального конца пищевода до желудка для максимального снижения натяжения в зоне анастомоза, которая приводит к укорочению интраабдоминального отдела пищевода, уменьшению тонуса нижнего пищеводного сфинктера в результате тракции и перерастяжения мышц стенки пищевода, увеличению угла Гиса более 90°.
ЖПР является фактором риска сужения анастомоза, так как к этому предрасполагает заброс кислого желудочного содержимого в сочетании с замедленным опорожнением пищевода [18]. Так, в нашей практике во всех 13 случаях стеноза наблюдали ЖПР. Всем пациентам проводили бужирование пищевода до диаметра 0,5–1,0 см (в среднем — до 0,8 см), а затем как основное лечение выполняли лапароскопическую фундопликацию по Ниссену. У всех пациентов бужирования пищевода были результативными, и никто не нуждался в резекции и повторном анастомозе. Одновременно с бужированием все дети получали антирефлюксную терапию.
По данным литературы, после колоэзофагопаластики наиболее ранним и частым осложнением становится несостоятельность анастомоза на шее (более 70%) [19]. В исследовании доля несостоятельности анастомоза составила 38,5%, однако это явление можно отнести к малым осложнениям колоэзофагопластики, так как в большинстве случаев свищ закрывается самостоятельно.
Наиболее грозное осложнение колоэзофагопластики — некроз трансплантата. У наших больных его не наблюдали.
Развитие стеноза и несостоятельности эзофагоколоанастомоза связано с плохим кровоснабжением проксимального конца трансплантата, обусловленным его удаленностью от сосудистой ножки [20]. Мы наблюдали стеноз эзофагоколоанастомоза у 9 (17,3%) детей, но реконструкция анастомоза потребовалась только в одном случае.
ЖПР может приводить к развитию стеноза дистального анастомоза (15–20%), образованию эрозий и язв слизистой оболочки трансплантата в результате воздействия на нее желудочного содержимого с развитием кровотечений [19]. Следовательно, способ наложения дистального анастомоза имеет большое значение. Разные авторы используют различные методики: формирование манжеты вокруг дистальной части трансплантата, наложение анастомоза низко по отношению ко дну желудка с целью имитации острого угла Гиса, препятствующего рефлюксу [20]. В нашей клинике накладывают антирефлюксный анастомоз между дистальным отделом трансплантата и передней стенкой дна желудка по авторской методике [3].
Вероятно, высокая частота развития пареза гортани во 2й группе связана с повреждением возвратного нерва при мобилизации орального отдела пищевода.
Несмотря на частые осложнения в 1й группе, у 11 (64,7%) детей нам удалось сохранить собственный пищевод после наложения отсроченного анастомоза пищевода.
ЗАКЛЮЧЕНИЕ
При невозможности выполнения первичного анастомоза пищевода выведение эзофаго и гастростомы обеспечивает 100% выживаемость, в отличие от детей без эзофагостомы, среди которых летальность составила 26%. После колоэзофагопластики наблюдаются лучшие течение послеоперационного периода и отдаленные результаты хирургического лечения.
Недостатками колоэзофагопластики следует считать техническую сложность и травматичность операции, а также замену естественного пищевода.
После отсроченного эзофагоэзофагоанастомоза частота послеоперационных осложнений, особенно желудочнопищеводного рефлюкса, выше, чем после колоэзофагопластики, что, вероятнее всего, связано с натяжением в зоне анастомоза изза большого диастаза между сегментами пищевода.
Наложение отсроченного эзофагоэзофагоанастомоза позволяет сохранить собственный пищевод в 64,7% случаев.
Раннее бужирование стеноза эзофагоэзофагоанастомоза обеспечивает положительный результат и позволяет избежать повторной операции — реконструкции анастомоза.








