Недержание мочи (инконтиненция) — независимое от желания, т. е. неконтролируемое, выделение мочи из мочевых путей, которое вызывает социальные, психические и гигиенические проблемы. Недержание мочи не угрожает жизни, но значительно снижает ее качество и негативно влияет практически на все аспекты жизни больных[1, 2].
Недержание мочи — заболевание, которое может возникнуть в любом возрасте, но чаще встречается у женщин в период климактерия, во время которого значительно снижается выработка женских половых гормонов, в первую очередь эстрогенов. Тенденция к увеличению продолжительности жизни привела к тому, что современная популяция женщин проводит более трети жизни в постменопаузе[3]. В связи с ростом продолжительности жизни актуальность проблем генитоуринарных эстрогендефицитных нарушений, включающих различные виды недержания мочи, значительно возрастает[4, 5].
Недержание мочи, находясь на стыке нескольких областей медицины, трудно поддается лечению и заслуживает особого внимания врачей. Трудности лечения мочевой инконтиненции объясняются несколькими причинами. Вопервых, многие пациенты стесняются проблемы и откладывают обращение за медицинской помощью[6]. Так, по данным В. Е. Балан, только 4% пациенток, страдающих недержанием мочи, обращаются за медицинской помощью, остальные игнорируют или скрывают это состояние[7]. Вовторых, даже из того небольшого числа женщин, которые на приеме у врача целенаправленно обращали его внимание на наличие симптомов недержания мочи, только 2% получают квалифицированную медицинскую помощь[7, 8]. Причиной недостаточно адекватной помощи больным с расстройствами мочеиспускания является то, что недержание мочи — частый симптом совершенно разных заболеваний, имеющих отличную друг от друга этиологию, патогенез и, соответственно, требующих дифференцированного лечения[9].
В настоящее время известно, что половые стероиды играют существенную роль в регуляции работы мочевыделительной системы. Слизистые оболочки, мышцы и сосуды влагалища, уретры, треугольника Льето и дна мочевого пузыря содержат рецепторы эстрогенов, прогестерона и андрогенов. В свою очередь, установлена гетерогенность самих стероидных рецепторов и их функций. Данные о распределении подтипов стероидных рецепторов в тканях урогенитального тракта пациенток с инконтиненцией достаточно противоречивы и представлены в литературе крайне скудно. Определение уровня экспрессии и распределения изучаемых рецепторов позволит выяснить их значение в процессах удержания мочи, а также наметить пути фармакологической коррекции данного заболевания.
Цель исследования: изучение экспрессии генов рецепторов половых стероидов в парауретральной соединительной ткани пациенток с дисфункцией тазового дна и влияния на нее эстриола в культуре клеток фибробластов.
МАТЕРИАЛЫ И МЕТОДЫ
Нами обследованы 22 женщины, которые наблюдались и были оперированы на базе эндоскопического отделения ГБУЗ МО МОНИИАГ в 2014–2016 гг. Все пациентки подписали информированное согласие на забор биологического материала для клиниколабораторных исследований.
Основную группу составили 11 пациенток с дисфункцией тазового дна и недержанием мочи при напряжении, в контрольную группу вошли 11 женщин без аналогичных проблем. В исследовании была использована парауретральная соединительная ткань, полученная в ходе реконструктивнопластических операций (основная группа) и различных гинекологических вмешательств (контрольная группа).
Обследование всех пациенток начинали с тщательного сбора анамнеза. Возраст участниц обеих групп был сопоставим и составил в среднем 45,1 ± 11,9 года. Известно, что осложненные роды относятся к важнейшим факторам риска недержания мочи. У пациенток со стрессовой инконтиненцией в анамнезе было значимо больше родов, чем у участниц контрольной группы: 2 и более родов было у 9 (81,8%) пациенток основной группы, тогда как в контрольной — только у 4 (36,4%). По остальным основным параметрам группы не различались.
Из биоптатов парауретральной ткани выделяли матричную РНК (мРНК). Выделение мРНК из клеток мононуклеарной фракции периферической крови проводили с помощью набора «Рибопреп» (AmpliSens). Образцы комплементарной ДНК, транскрибированной на матрице мРНК с использованием «РевертаL» (AmpliSens), были проанализированы с помощью ПЦР в режиме реального времени. Для ПЦР использовали SYBR Green PCR Master Mix и прибор iCycler iQ5 realtime PCR (BioRad, Германия).
Значения экспрессии каждого из целевых генов нормировали по уровню экспрессии гена «домашнего хозяйства», кодирующего глицеральдегид3фосфат дегидрогеназу (GAPSH), и представляли как 100 × 2–∆Ct, где ∆Ct — разница между экспрессией исследуемого гена и экспрессией гена «домашнего хозяйства».
Получение суспензии клеток ткани и инкубация их с гормонами: в лунки стерильного 96-луночного круглодонного планшета вносили гормоны с концентрацией в конечном объеме от 10–7 М до 10–8 М. Качество, количество и жизнеспособность клеток в камере Горяева оценивали в присутствии 0,1% раствора трипанового синего. Клеточную суспензию вносили в лунки планшета по 200 мкл. Инкубирование образцов в термостате производили при 37 °С в условиях 5% СО2 в течение 24–48 ч. Из лунок отбирали осадок для ПЦР.
Обработку результатов проводили с использованием статистической программы GraphPadPrism 5. Проверку на нормальность осуществляли с применением критерия Колмогорова — Смирнова, массив наших данных не соответствует критериям нормальности (распределению Гаусса). Поэтому для сравнения двух групп по количественным признакам был применен основной критерий непараметрической статистики — критерий Манна — Уитни. Для оценки взаимосвязи количественных признаков был использован критерий ранговой корреляции Спирмена. Различия считали статистически значимыми при р ≤ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Уровни экспрессии генов стероидных рецепторов в парауретральной ткани пациенток с инконтиненцией и без нее приведены в таблице.
Таблица
Уровни экспрессии генов стероидных рецепторов в парауретральной ткани обследованных пациенток, у. е. (медиана (25-й – 75-й квартили)
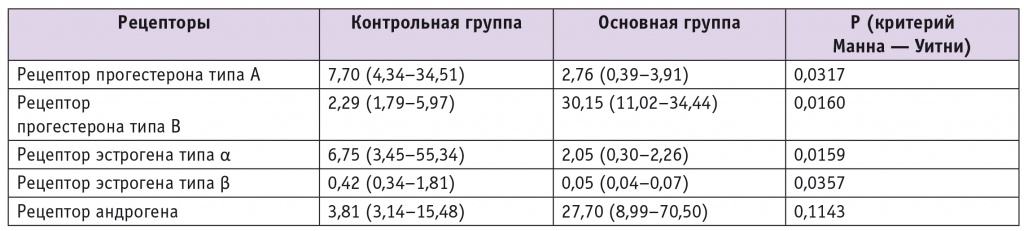
Анализ полученных данных показал, что экспрессия всех изучаемых видов и изоформ рецепторов существенно различалась между двумя группами. Отличия были разнонаправленными: при инконтиненции экспрессия прогестеронового рецептора типа В (ПРВ) значительно больше, чем в контрольной группе, а экспрессия гена рецептора прогестерона типа А (ПРA) в основной группе, напротив, значимо меньше таковой в контрольной группе.
Известно, что прогестерон через ПРА препятствует пролиферации клеток, вызванной активацией рецепторов эстрадиола[10, 11]. Так как при инконтиненции пролиферация клеток в тканях урогенитального тракта заторможена, можно предположить, что снижение экспрессии ПРА представляет компенсаторный процесс, препятствующий дальнейшей атрофии тканей. У пациенток с дисфункцией тазового дна уровень мРНК рецепторов ПРВ, напротив, был значимо увеличен (в 7,2 раза по сравнению с контрольной группой). Форма В рецептора прогестерона способствует пролиферации клеток. Как уже было сказано выше, регенерация тканей урогенитального тракта при инконтиненции нарушена, процессы апоптоза преобладают над пролиферацией. Следовательно, можно думать, что выявленное нами увеличение экспрессии ПРВ также является компенсаторным процессом.
Литературные данные об экспрессии отдельных изоформ рецепторов прогестерона при инконтиненции отсутствуют. Группа шведских ученых из Стокгольма, проводившая исследование уровней рецепторов половых гормонов в межклеточном пространстве парауретрального тракта у женщин в пре и постменопаузе со стрессовым недержанием мочи и без него, не обнаружила различий в суммарной экспрессии прогестероновых рецепторов в изучаемых группах[12].
В настоящее время эстрогенный дефицит считается ведущим этиологическим фактором в развитии недержания мочи. Наличие рецепторов эстрогенов дает возможность оказывать влияние эстрогенсодержащими препаратами на состояние и функцию слизистых урогенитального тракта. Следовательно, для понимания механизма патогенеза и успешного лечения недержания мочи важно знать характер экспрессии эстрогеновых рецепторов в мочевом тракте. Как показывают результаты нашего исследования, экспрессия рецепторов эстрогена обоих типов у пациенток с инконтиненцией была значимо снижена по сравнению с таковой в контрольной группе: рецептора эстрогена типа α (ЭРα) — в среднем в 15,3 раза, рецептора эстрогена типа β (ЭРβ) — в 13 раз.
Литературные данные об экспрессии рецепторов эстрогена противоречивы. Согласно одним исследованиям, уровни ЭРα и ЭРβ в эндотелии, гладкомышечных клетках и фиброцитах в передней вагинальной стенке пациенток со стрессовой инконтиненцией снижены по сравнению с контролем[13]. Согласно другим работам, у пациенток со стрессовой инконтиненцией в пременопаузе уровень ЭРβ, напротив, намного выше, чем в группе контроля, тогда как содержание ЭРα примерно одинаково в обеих группах[12]. В ряде исследований показано, что баланс двух подтипов эстрогеновых рецепторов изменялся при переходе фазы пременопаузы в постменопаузу с преобладающего ЭРα к ЭРβ. Кроме того, плотность ЭРα менялась в зависимости от использования внешнего (экзогенного) эстрогена, а плотность ЭРβ — нет[14].
Противоречивость литературных данных может быть связана с тем, что экспрессию ЭРα и ЭРβ определяли в разные возрастные периоды и разные фазы цикла, а известно, что количество эстрогеновых рецепторов в эстрогензависимых тканях колеблется в течение менструального цикла.
Андрогены также, несомненно, влияют на урогенитальный тракт, так как в стенке влагалища (особенно в его нижней трети), уретры и мочевого пузыря находятся их рецепторы. M. W. Söderberg и соавт. выявили тенденцию к повышению экспрессии рецептора андрогена в ткани вагинальной стенки и кардинальных связках у женщин с патологией тазовых органов, что играет важную роль в этиологии дисфункции тазового дна[15]. По нашим данным, экспрессия гена андрогенового рецептора у пациенток с недержанием мочи увеличена.
Известно, что эстрогеновые, андрогеновые и прогестероновые рецепторы контролируют собственную экспрессию и транскрипцию генов родственных рецепторов. По результатам полногеномного исследования установлено, что экспрессия 59 генов может модулироваться как прогестероновыми, так и андрогеновыми рецепторами. Экспрессия 140 генов модулируется и прогестероновыми, и эстрогеновыми рецепторами. Следовательно, изучаемые гены имеют общие транскрипционные пути и участвуют в регуляции друг друга. Проведенный нами сравнительный анализ полученных данных с помощью метода Спирмена выявил у здоровых женщин положительные корреляции между уровнями ПРА и ПРВ (r = 0,90; р = 0,037), ПРА и ЭРα (r = 0,72; р = 0,029), ПРА и ЭРβ (r = 0,82; р = 0,002), ПРВ и ЭРα (r = 1,00; р = 0,0001), ПРВ и ЭРβ (r = 0,83; р = 0,042). У пациенток с инконтиненцией также обнаружились корреляции между уровнями ПРА и ПРВ (r = 1,00; p < 0,0001), ПРА и ЭРα (r = 0,65; р = 0,029), ПРА и ЭРβ (r = 0,84; р = 0,001), ЭРα и ЭРβ (r = 0,61; р = 0,047).
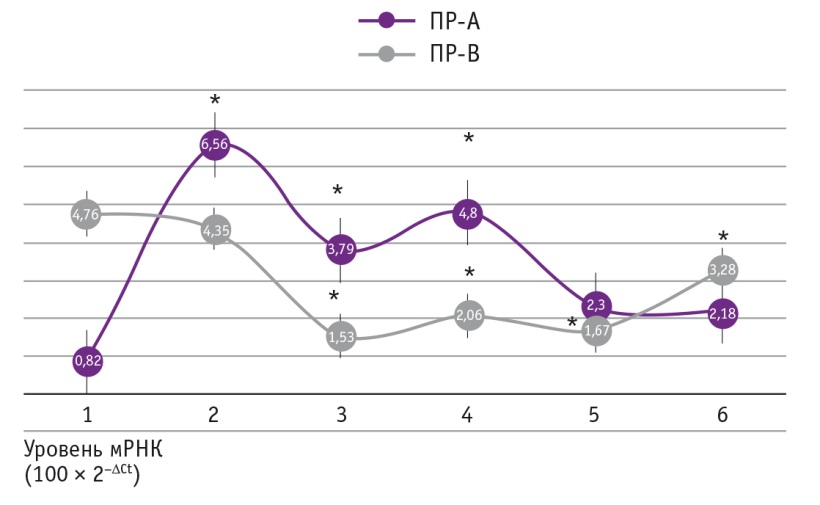
Для выяснения влияния эстриола на уровни экспрессии целевых генов мы проводили инкубацию культуры фибробластов парауретральной ткани пациенток со стрессовой инконтиненцией с разными концентрациями эстриола (рис. 1, 2).
Рис. 1. Влияние эстриола на экспрессию генов рецепторов прогестерона типов А (ПР-А) и В (ПР-В) в культуре фиброцитов из парауретральной ткани пациенток с инконтиненцией. Концентрации эстриола: 1–0, 2–2 × 10–8 М, 3–2 × 10–7 М, 4–2 × 10–6 М, 5–10–5 М, 6–10–4 М.
* Отличие от исходного значения (точка 1) статистически значимо (р ≤ 0,05)
* Отличие от исходного значения (точка 1) статистически значимо (р ≤ 0,05)
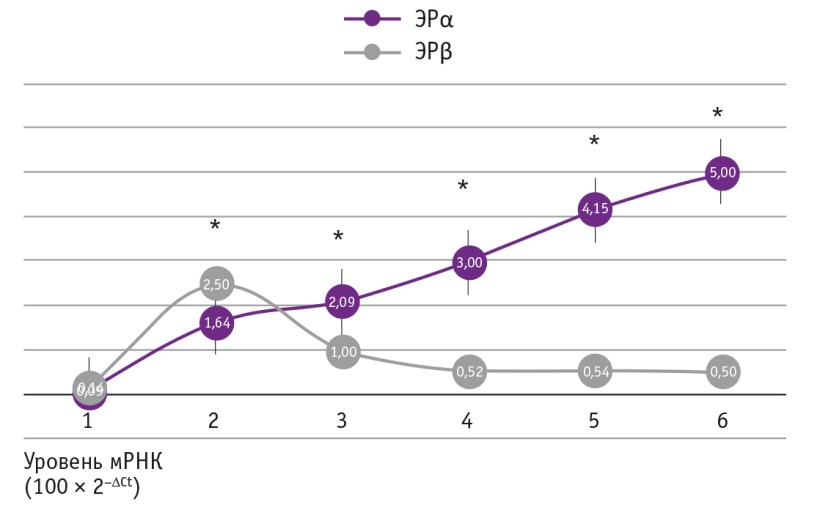
Как видно из рисунков, эстриол дозозависимо повышал экспрессию ЭРα и ПРА, а также снижал уровень мРНК ПРВ. Следовательно, местная заместительная терапия нормализует данные параметры в парауретральной ткани пациенток с инконтиненцией. Таким образом, выяснен один из молекулярных механизмов терапевтического действия эстриола.
ЗАКЛЮЧЕНИЕ
Полученные нами результаты позволяют сделать вывод, что экспрессия рецепторов стероидных гормонов в соединительной ткани урогенитального тракта у пациенток с дисфункцией тазового дна значительно отличается от таковой у здоровых женщин, что указывает на важную роль половых стероидов в патогенезе инконтиненции.
Выявление половины из существующих в норме корреляций между экспрессией генов стероидных рецепторов у пациенток основной группы свидетельствует о сохранении по крайней мере части механизмов ауто и гетерорецепторной регуляции, следовательно, можно прогнозировать успех использования лигандов рецепторов половых стероидов в качестве компонентов терапии инконтиненции.
Эстриол способствует восстановлению нарушенного стероидрецепторного профиля фиброцитов парауретральной ткани пациенток с инконтиненцией.








