Важным открытием (2003) стали идентификация и установление функции кисспептина в половой дифференциации головного мозга, секреции гонадотропинов и индукции овуляции [2]. Обнаружены случаи делеции и инактивации гена кисспептина у пациентов с семейной или спорадической формой идиопатического гипогонадотропного гипогонадизма [3].
Считается, что скоординированная работа репродуктивной системы — это энергозатратный процесс. Экспериментальные и клинические исследования продемонстрировали ингибирующее влияние отрицательного энергетического баланса на функцию гипоталамуса и гипофиза [4]. Нейроны, экспрессирующие кисспептин (KISS1-нейроны), можно считать медиаторами между энергетическим балансом и репродуктивной системой. Цель настоящего обзора — обобщение и систематизация данных литературы о роли кисспептина в регуляции ГГЯО.
Лигандрецепторная система кисспептина
Кисспептин, идентифицированный в 1996 г., относится к семейству RFаминопептидов. Он кодируется геном KISS1, расположенным в локусе 1q32. Гидрофобный белок, кисспептин содержит 145 аминокислотных остатков, в результате расщепления он может распадаться на относительно короткие формы пептидов: кисспептин 54, 14, 13, 10. Основной его активной формой у человека является кисспептин 54.
Первоначально кисспептин был определен как супрессор метастазирования опухолей, поскольку его экспрессия оказалась минимальной или даже отсутствовала при метастазирующих злокачественных заболеваниях, а при неметастазирующих она остается неизменной [5]. Предполагают, что это свойство кисспептина связано с индукцией апоптоза в опухолевых клетках. Биологическую активность кисспептина определяет Сконцевой участок, отвечающий за связывание с рецептором [6].
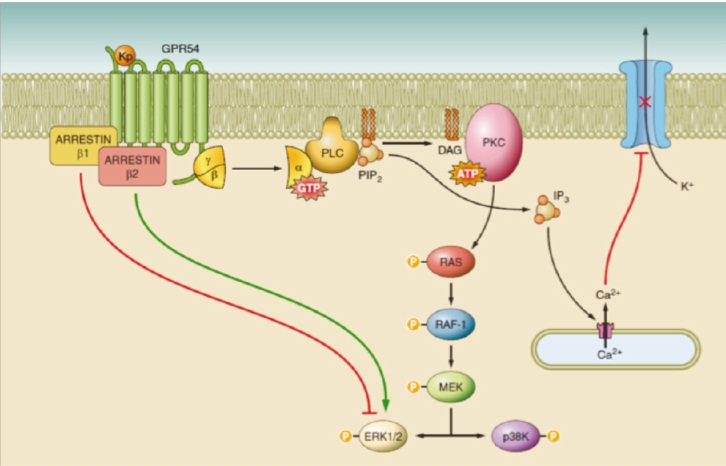
В 2001 г., спустя 5 лет после открытия белка, была выявлена значимая связь между лигандом (кисспептином) и рецептором GPR54 (Gпротеинсвязанный рецептор), именуемым в настоящее время KISS1R [7]. KISS1R состоит из 398 аминокислот и относится к семейству родопсиновых рецепторов, сопряженных с Gпротеинами 7 трансмембранными доменами. Установлено, что взаимодействие кисспептина с рецептором сопровождается активацией Gпротеинов и увеличением уровня внутриклеточного Ca2+ с последующей внутриядерной активацией синтеза ГнРГ и ингибированием пролиферации клеток [8, 9] (рис.).
Рис. Взаимодействие кисспептина с рецептором GPR54 приводит к активации G-протеинов и увеличению уровня внутриклеточного Ca2+. Это способствует активации фосфолипазы С (PLC), гидролизу фосфотидилинозитолбисфосфата (PIP2) в инозитол 1,4,5-трифосфат (IP3), стимуляции синтеза диациглицерина (DAG). Вторичные мессенджеры (IP3 и DAG) индуцируют открытие лиганд-зависимого Са2+-канала, мобилизацию Ca2+ из внутриклеточного депо, активность протеинкиназы С (PKC), фосфорилирование митоген-активируемых протеинкиназ (МАРК) ERK1/2 и р38K, ответственных за усиление внутриядерного синтеза гонадотропин-рилизинг-гормона (ГнРГ) и ингибирование пролиферации клеток. Связывание кисспептина с GPR54 приводит также к активации G-протеин-независимых сигнальных путей и синтезу ГнРГ посредством внутриклеточных мессенжеров ― аррестина β1и β2. По данным [10, 11].
Примечание: ATP (adenosintriphosphate) ― аденозинтрифосфат; GTP (gamma-glutamyl transferase) ― гамма-глютамилтранспептидаза; MEK ― киназа, активирующая МАРК; Raf ― серин-треониновые киназы; Ras ― семейство генов и белков, которые кодируют G-протеины.
Роль кисспептина в регуляции секреции гонадотропинов
Способность кисспептина потенцировать секрецию ГнРГ была впервые описана в 2003 г. Исследования подтвердили, что кисспептин усиливает секрецию ЛГ и ФСГ как у женщин, так и у мужчин. Стимулирующее воздействие кисспептина на ГГЯО было выявлено при различных физиологических состояниях, в различные фазы менструального цикла, а также при беременности и лактации [12].
Установлено, что кисспептин синтезируется во многих органах: в гипоталамусе, плаценте, гонадах, почках, поджелудочной железе, печени, кишечнике, аорте, коронарных артериях и пупочной вене [13]. Экспрессия кисспептина и его рецептора в гипоталамусе происходит в основном в нейронах аркуатного ядра и антеровентрального перивентрикулярного ядра преоптической области. Обе популяции KISS1нейронов поразному участвуют в передаче эффекта половых гормонов ГнРГнейронам. Представляется, что между нейронами преоптического ядра и эстрогенами возникает положительная обратная связь, ответственная за формирование пика ЛГ, в то время как в аркуатном ядре существуют и положительная, и отрицательная обратные связи.
Известно, что повышение уровней эстрогенов в конце фолликулярной фазы менструального цикла способно инициировать преовуляторный пик гонадотропинов. Положительная обратная связь осуществляется преимущественно через эстрогеновые рецепторы α, их экспрессия отсутствует в ГнРГнейронах в отличие от KISS1нейронов. Поэтому эстрогены способны связываться с эстрогеновыми рецепторами α KISS1нейронов, усиливать секрецию кисспептина и ГнРГ. Есть данные, что экзогенное введение кисспептина сильнее повышает концентрацию ЛГ, чем ФСГ. Возможно, это связано с большей устойчивостью ФСГ к влиянию пульсовой секреции ГнРГ и с подавляющим воздействием ингибина А и В на секрецию ФСГ [14].
Котрансмиттеры кисспептинергической системы
Считается, что KISS1нейроны в зоне аркуатного ядра способны экспрессировать нейротрансмиттеры — нейрокинин В и динорфин (KNDнейроны). Полагают, что с помощью аутосинапсов они участвуют в регуляции секреции кисспептина. Динорфин является эндогенным опиоидным пептидом, он связывается с κопиоидным рецептором и участвует в отрицательной обратной связи между прогестероном и ГнРГ. Подобные взаимодействия способствуют ингибированию секреции кисспептина и ГнРГ.
Повышение уровня динорфина, возникающее в ответ на стресс и физические нагрузки, может подавлять секрецию ГнРГ и ЛГ, вызывая ановуляцию и даже гипогонадотропную аменорею. Применение налоксона (блокатора опиоидных рецепторов) способно нормализовать выработку ГнРГ, восстановить ритм менструаций и овуляции [15].
Нейрокинин В, связываясь с рецептором NK3R, напротив, стимулирует секрецию кисспептина в гипоталамусе. Данные литературы свидетельствуют, что введение нейрокинина В или селективного агониста NK3R (сенктида) может стимулировать овуляторный пик ЛГ. Что касается экспрессии гена TAC3, отвечающего за синтез нейрокинина В, она зависит от уровней половых стероидов, предположительно, по механизму отрицательной обратной связи [16]. Показано, что овариоэктомия стимулирует экспрессию гена TAC3 в нейронах аркуатного ядра. Терапия эстрогенами, напротив, подавляет экспрессию гена и секрецию ЛГ [17].
Следует отметить, что подобные результаты не были получены у KISS1Rнокаутных мышей. Это может указывать, что нейрокинин В является важным регулятором кисспептинергической сигнальной системы. Мутации, инактивирующие ген нейрокинина В и его рецептора NK3R, сопряжены с крайне низкими уровнями ЛГ (при нормальных уровнях ФСГ), с возникновением гипоталамического гипогонадизма и бесплодия. Инактивирующие мутации гена KISS1R, ответственные за экспрессию рецептора к кисспептину, ассоциируются с низкими концентрациями и ЛГ, и ФСГ [18]. KNDнейроны связаны с передачей сигнала эстрадиола в аркуатном ядре головного мозга, регулирующего тепловыделение. В эксперименте показано, что аблация KNDнейронов снижает вазодилатацию сосудов кожи и частично блокирует действие эстрадиола на терморегуляцию [19]. Предполагают, что KNDнейроны аркуатного ядра контролируют теплоотдачу и участвуют в патогенезе приливов жара у женщин в постменопаузе.
Секреция кисспептина в органах репродуктивной системы
Несмотря на то что основная функция кисспептина заключается в центральной регуляции ГГЯО, появились данные, подтверждающие его непосредственное участие в регуляции функции яичников, маточных труб, трофобласта и плаценты [20]. Экспрессия элементов кисспептинэргической системы обнаружена в ткани яичников (текаклетках растущих фолликулов, желтом теле) [21]. Недавние исследования продемонстрировали локальное действие кисспептина на яичники мышей, не зависящее от уровней гонадотропинов [22]. Показано также, что экспрессия кисспептина в яичниках повышается во время пубертатного периода.
F. Gaytan и соавт. указывают на возможность предотвращения предовуляторного пика гонадотропинов путем уменьшения уровня кисспептина [22]. Та же группа исследователей выявила, что у мышей с гаплонедостаточностью гена KISS1R может развиваться преждевременная недостаточность яичников при отсутствии изменения содержания гонадотропинов. Для восстановления овуляторных менструальных циклов потребовалось дополнительное введение ГнРГ в сочетании с гонадотропинами в течение недели, что свидетельствует о локальной роли кисспептина в прямом контроле фолликулогенеза и овуляции.
При изучении рецепторов к кисспептину в других органах обнаружено, что их максимальная локализация наблюдается в ткани плаценты. Полагают, что кисспептин участвует в регуляции инвазии синцитиотрофобласта и плацентации. В плаценте женщин с преэклампсией наблюдается высокая экспрессия генов KISS1 и KISS1R, что способствует супрессии мРНК матриксной металлопротеиназы 9 и подавлению миграции клеток трофобласта [23]. Получены также данные о циклической экспрессии кисспептина в фаллопиевых трубах. Предполагается его роль в профилактике эктопической беременности [23].
Роль кисспеПтина в половом созревании
Среди причин идиопатического гипогонадизма приблизительно 2% составляют инактивирующие мутации гена кисспептина и его рецептора [24]. В экспериментальных исследованиях показано, что KISS1Rнокаутные мыши не достигают половой зрелости изза отсутствия секреции ЛГ и активности гена Сfos (маркера клеточной пролиферации, дифференцировки и нейрональной активности). В то же время активирующие мутации гена KISS1 и его рецептора связаны со стимуляцией сигнального пути кисспептина и преждевременным половым созреванием [25]. Ключевым в его индукции считается увеличение активности ГнРГнейронов и секреции гонадотропинов. Исследования на животных показали рост экспрессии KISS1R в преоптическом и аркуатном ядрах гипоталамуса к моменту полового созревания. Согласно имеющимся данным, экзогенное введение кисспептина лабораторным животным стимулирует секрецию ГнРГ и приводит к преждевременному половому созреванию [26].
Кисспептин и энергетический гомеостаз
Репродуктивная система очень энергозатратна, но не является определяющей для сохранения жизни, поэтому ингибирование ГГЯО стало эволюционным механизмом существования в условиях энергетического дефицита. Данные литературы демонстрируют значимость KISS1нейронов не только в регуляции репродуктивной системы, но и в энергетическом гомеостазе [27–29]. В большинстве случаев отрицательный энергетический баланс способствует подавлению кисспептинэргической системы. Показано, что 72часовое голодание приводит к снижению экспрессии мРНК кисспептина в гипоталамусе, уменьшению концентрации ЛГ и количества KISS1нейронов в аркуатном ядре гипоталамуса и к развитию гипогонадотропного гипогонадизма.
Основные метаболические регуляторы кисспептина — лептин, инсулин и грелин. Лептин продуцируется преимущественно адипоцитами белой жировой ткани, в меньшей степени — плацентой, эпителием молочных желез, скелетной мускулатурой и слизистой желудка [30]. Лептин, являясь медиатором энергетического баланса, способен стимулировать ГнРГнейроны. Однако они лишены рецепторов к лептину, в то время как примерно 40% KISS1нейронов аркуатного ядра экспрессируют лептиновые рецепторы [31]. Дефицит лептина, вызванный мутациями, инактивирующими его ген, длительным ограничением каллоража потребляемой пищи, декомпенсированным сахарным диабетом, ассоциирован с низкой экспрессией гена KISS1 и снижением секреции кисспептина. Было показано, что линии мышей с нокаутированным геном лептина (ob/ob) и люди с врожденной лептиновой недостаточностью страдают гипогонадотропным гипогонадизмом и бесплодием. При функциональной гипоталамической аменорее также отмечены низкие уровни лептина [32]. У лептиндефицитных (ob/ob) мышей наблюдается снижение экспрессии мРНК KISS1 в аркуатном ядре гипоталамуса. Введение лептина в условиях пищевого дефицита приводит к увеличению экспрессии мРНК KISS1 у мышей и активации KISS1нейронов в аркуатных ядрах и ГнРГнейронах.
Медиаторами действия лептина являются орексигенные факторы, нейропептиды Y (NPY 1–4). Лептин способен подавлять секрецию NPY в аркуатном ядре гипоталамуса, что приводит к повышению аппетита при уменьшении активности KISS1нейронов. Введение экзогенного лептина снижает экспрессию мРНК NPY и восстанавливает фертильность у лептиндефицитных мышей [33]. Есть данные и о том, что кисспептин 10 может подавлять NPYнейрональную активность через непрямые GABAэргические синаптические механизмы или через взаимодействие с рецепторами NPY, способствуя восстановлению фертильности [34].
Как уже указывалось, посредством влияния на центр питания гипоталамуса NPY стимулирует пищевое поведение [35]. Чувство голода сигнализирует об отрицательном энергетическом балансе в организме, в ответ увеличивается концентрация NPY. Хроническое повышение уровня NPY в аркуатном ядре гипоталамуса приводит к подавлению активности кисспептинэргической системы и, как следствие, к снижению экспрессии кисспептина и ГнРГ. На фоне восстановления положительного энергетического баланса и оптимального уровня «гормонов насыщения» (лептина и инсулина) замечены уменьшение активности NPYнейронов и восстановление экспрессии кисспептина и ГнРГ. В. Meczekalski и соавт. обнаружили низкие уровни NPY в сыворотке крови у пациенток с гипоталамической аменореей, связанной со снижением массы тела, по сравнению с женщинами, имеющими регулярный менструальный цикл [36].
Помимо лептина и NPY, к метаболическим регуляторам относится инсулин, однако сведения о степени его влияния на функцию кисспептиновой системы весьма противоречивы и малочисленны. Есть данные, что инсулин может осуществлять контроль метаболизма углеводов на уровне гипоталамуса [37]. В некоторых исследованиях показано, что инсулин, взаимодействуя с инсулиновым рецептором в ГнРГнейронах, способствует секреции ГнРГ. Приводятся также данные о том, что мыши с нокаутированным геном инсулинового рецептора страдают гипогонадотропным гипогонадизмом и метаболическими нарушениями, хотя в некоторых публикациях указано, что селективная аблация инсулинового рецептора в ГнРГнейронах не способствует снижению фертильности, тогда как потеря инсулинового рецептора в KISS1нейронах и ИПФР1рецептора в ГнРГнейронах приводит к задержке полового созревания [38, 39].
В регуляции пищевого поведения важную роль играет грелин — пептидный гормон, состоящий из 28 аминокислот, который синтезируется преимущественно в париетальных клетках желудка, заметно меньше — в легких, кишечнике, поджелудочной железе, яичках, плаценте, почках и ЦНС. Грелинпродуцирующие нейроны обнаружены также в аркуатном ядре гипоталамуса и гипофиза [40].
Эффекты грелина в регуляции пищевого поведения и репродуктивной системы антагонистичны таковым лептина. В отличие от лептина и инсулина, повышение уровня грелина является индикатором дефицита энергии. Ингибирующее воздействие грелина на репродуктивную функцию может опосредоваться через действие кисспептина. Это показано в исследованиях, в которых введение грелина снижало экспрессию гена KISS1 и пульсационную активность ЛГ [41–44].
Согласно данным литературы, у пациенток с функциональной гипоталамической аменореей, связанной с чрезмерными физическими нагрузками или резким снижением массы тела, отмечается повышение уровня грелина по сравнению с женщинами, имеющими регулярный ритм менструаций [45, 46]. Кроме этого, есть предположение, что высокая концентрация грелина, связанная с подавлением ГГЯО, приводит к сохранению аменореи у женщин даже после восстановления массы тела [47].
Влияние стресса на кисспептинэргическую систему
Подавление функционирования кисспептинэргической системы наблюдается не только при энергетическом дефиците, но и при хроническом стрессе и воспалении.
Ответная реакция организма на стресс проявляется активацией гипоталамогипофизарнонадпочечниковой системы, в частности усилением секреции кортиколиберина и глюкокортикоидов. Открытие кисспептина позволило поновому взглянуть на механизмы подавления репродуктивной системы вследствие стресса. В исследованиях на животных установлено, что иммобилизация мышей мужского пола в течение 10 дней, имитирующая острую стрессовую реакцию, приводила к значимому повышению содержания кортикостерона и шестикратному уменьшению уровня кисспептина [48, 49].
Важно отметить, что основным глюкокортикоидом, вырабатывающимся в ответ на стресс у птиц и у грызунов, является кортикостерон, в то время как у других млекопитающих — кортизол. Результаты исследований на самках мышей показали снижение секреции ГнРГ и кисспептина преимущественно изза нарушения механизма обратной связи между эстрогенами и нейронами аркуатного ядра. Оно препятствовало возникновению пика ЛГ и овуляции [50].
В клинической практике часто наблюдают, как стресс приводит к подавлению репродуктивной системы в виде ановуляции, а иногда и функциональной гипоталамической аменореи. Исследования последних лет продемонстрировали, что супрессивное действие психосоциального стресса на гипоталамус и гипофиз опосредованы кортизолом, который связывается с глюкокортикоидными рецепторами II типа, локализованными на KNDнейронах аркуатного ядра. Нарушение секреции динорфина и нейрокинина В KNDнейронами приводит к угнетению синтеза кисспептина. Эти изменения могут подавлять активность ГнРГнейронов и ингибировать пульсационную секрецию гонадотропинов [51].
Терапевтические возможности кисспептина и его аналогов
Данные о ведущей роли кисспептина в регуляции ГГЯО обосновывают целесообразность применения его аналогов при нарушениях в репродуктивной системе, ассоциированных с его недостаточностью, а также в программах ВРТ. Агонисты кисспептина можно использовать для фармакологической активации ГГЯО при недостаточности его синтеза и интактности ГнРГнейрональной системы.
Аналоги кисспептина вполне могут иметь терапевтический потенциал, близкий к агонистам ГнРГ, которые нашли свое применение при лечении различных гормонозависимых заболеваний и при ЭКО. Однако необходимо отметить разницу между агонистами ГнРГ и агонистами кисспептина с точки зрения секреции гонадотропинов в ответ на болюсное и пролонгированное введение. Так, агонисты ГнРГ пролонгированного действия, связываясь с рецепторами, индуцируют десенситизацию гипофиза, антагонисты ГнРГ предотвращают активацию рецептора к ГнРГ и гонадотропинов. Происходит подавление секреции ЛГ и ФСГ с последующим снижением синтеза циркулирующих стероидных гормонов, концентрация которых становится ниже базальной. Понятно, что чрезмерное уменьшение уровней половых стероидов часто вызывает побочные эффекты, такие как приливы, снижение либидо и потеря костной ткани.
Антагонисты кисспептина способны уменьшать частоту и амплитуду ЛГ, не влияя на базальную секрецию [52]. Данная закономерность позволяет предположить, что антагонисты кисспептина могут найти клиническое применение в таких ситуациях, когда необходимо снизить гонадотропную функцию без полного подавления репродуктивной системы. Потенциально антагонисты кисспептина могли бы применяться при эндометриозе и миоме матки для снижения уровней эстрогенов без возникновения побочных эффектов.
Кроме того, способность антагонистов кисспептина подавлять пик ЛГ без уменьшения его базальной секреции можно использовать для контрацепции [53]. При этом развитие фолликулов и продукция эстрогенов могут сохраняться без последующей овуляции. Такой подход считается инновационным, поскольку современная гормональная контрацепция ориентируется на подавление гонадотропной функции гипофиза за счет супрафизиологических доз половых гормонов.
Хотелось бы отметить, что терапевтический эффект кисспептина оценивали у женщин, страдающих функциональной гипоталамической аменореей. Исследования применения кисспептина у пациенток с функциональной гипоталамической аменореей, связанной с потерей массы тела, начались после выявления его способности кратковременно увеличивать секрецию ЛГ в 2–2,5 раза в ответ на его болюсное введение [54].
Результаты исследования [55], в котором измеряли уровни гонадотропинов и эстрадиола до и после 2недельного введения кисспептина 54, свидетельствуют об увеличении концентраций гонадотропинов лишь в первый день введения с последующим его резким снижением. Авторы сделали вывод, что при 2недельном применении препарата развивается тахифилаксия (уменьшение лечебного эффекта). С целью нивелирования тахифилаксии предложено изменение кратности введения кисспептина до 2 раз в неделю. При таком протоколе наблюдалась лишь частичная тахифилаксия после 2 недель введения препарата, при этом уровень ЛГ достигал 7,9 МЕ/л. Несмотря на увеличение содержания ЛГ, роста фолликулов и утолщения эндометрия не было [56]. Проведенные исследования подчеркивают необходимость дальнейшей оптимизации протоколов введения кисспептина у пациенток с функциональной гипоталамической аменореей.
Способность агонистов кисспептина стимулировать секрецию гонадотропинов без влияния на их базовый уровень нашла свое применение в лечении бесплодия в программах ВРТ [57]. В исследовании 2015 г. был использован стандартный протокол стимуляции овуляции с ФСГ/антагонистами ГнРГ [57]. В качестве триггера овуляции применяли кисспептин 54 в различных дозировках: 3,2, 6,4, 9,6 и 12,8 нмоль/кг. Наиболее высокие показатели были получены при использовании кисспептина в дозе 9,6 нмоль/кг. Частота биохимической беременности, клинической беременности и живорождения — 85%, 77% и 62% соответственно. Ни у одной женщины не развился синдром гиперстимуляции яичников. Авторы сделали вывод, что введение кисспептина способствует более физиологическому выбросу ЛГ по сравнению с экзогенными гонадотропинами. Этот протокол представляется перспективным и безопасным, особенно для женщин с высоким риском синдрома гиперстимуляции яичников.
ЗАКЛЮЧЕНИЕ
Идентификация кисспептинэргической системы является крупным прорывом в современной нейроэндокринологии. Открытие кисспептина, вероятно, эквивалентно открытию ГнРГ в 1970х гг. и лептина в 1990х гг. Исследования кисспептинэргической системы расширили представления не только о процессах опухолевого роста и метастазирования, но и о регуляции репродуктивной функции. В настоящее время кисспептин можно рассматривать как один из основных регуляторов гипоталамогипофизарнояичниковой оси и важнейшее звено в процессе половой дифференцировки, полового созревания, овуляции, поддержания метаболического гомеостаза и фертильности.
Однако знания о влиянии кисспептина на физиологию и патологию репродуктивной системы попрежнему остаются недостаточно полными. Это обосновывает важность дальнейших научных исследований, направленных на изучение его многочисленных эффектов и на разработку таргетной терапии различных нарушений функционирования репродуктивной системы.








