В настоящее время принято выделять спорадический и наследственный рак яичника (РЯ). Наследственные опухолевые синдромы — это группа заболеваний, проявление которых заключается в передаче из поколения в поколение практически фатальной предрасположенности к заболеванию — мутации [1].
Семейный наследственный РЯ — результат мутаций генов BRCA1 и BRCA2. Каждая седьмая больная РЯ в России имеет наследственную повторяющуюся мутацию в генах BRCA1/2, при этом инсерция нуклеотида С в позиции 5382 гена BRCA1 (5382insC) составляет до 90% всех мутаций гена BRCA1 [2].
Мутационный статус генов BRCA1 и BRCA2 у больных с семейным РЯ неоднократно подвергался анализу посредством секвенирования всех кодирующих участков. Исследования, проведенные в Москве, Санкт-Петербурге и Томске, показали, что мутации, не относящиеся к категории повторяющихся, встречаются в России значительно реже, чем странах Европы и в Северной Америке [3–8]. Тем не менее стремительное упрощение и удешевление технологий ДНК-анализа позволяет предположить, что в недалеком будущем полное секвенирование генов BRCA1 и BRCA2 станет настолько доступным, что будет применяться даже в случаях относительно низкой вероятности обнаружения генного дефекта[8].
КЛИНИЧЕСКИЙ СЛУЧАЙ БОЛЬНОЙ Т. М., 67 ЛЕТ
Из анамнеза. В 2011 г. при профилактическом осмотре по месту жительства у пациентки заподозрено наличие опухолей яичников. При эхографическом обследовании в малом тазу визуализировались солидные образования, исходящие из яичников, размерами 45 × 37 мм справа и 54 × 43 мм слева. Уровень СА-125 — 174 Ед/мл. Рост больной — 172 см, вес — 88 кг. Менструации с 14 лет, менопауза с 48 лет. Беременностей — 5, родов — 2, абортов — 3. Гинекологическими заболеваниями не страдала.
Сопутствующие заболевания. Гипертоническая болезнь II степени. Хронический смешанный (поверхностный атрофический) гастрит, вне обострения. Мочекаменная болезнь, конкремент левой почки. Кисты правой почки. Желчнокаменная болезнь, состояние после холецистэктомии (1996). Варикозная болезнь вен нижних конечностей, флебэктомия справа (1992). Наследственный онкологический анамнез отрицательный.
Больная госпитализирована в гинекологическое отделение городского онкологического диспансера, где ей выполнены лапаротомия, гистерэктомия, аднексэктомия, оментэктомия, удаление узла на брюшине в области передней брюшной стенки. Гистологическое заключение — серозная цистаденокарцинома одного из яичников, большой сальник без метастазов, эндометрий индифферентного типа, узел с брюшины с клетками серозной аденокарциномы. Выставлен диагноз: РЯ IIIC (pT3cNхM0).
Послеоперационный период протекал без осложнений. Назначены 6 циклов химиотерапии по схеме РС: паклитаксел в дозе 175 мг/м2/сут внутривенно, карбоплатин в дозе AUC 6 внутривенно; интервал — 21 день (последний цикл проведен 16.11.2011 г.). К моменту завершения адъювантной химиотерапии уровень СА-125 снизился до 8,2 Ед/мл.
Далее пациентка наблюдалась по месту жительства. С июля 2013 г. зафиксирован рост концентрации онкомаркера СА-125 с 35,8 Ед/мл 16.07.2013 г. до 127 Ед/мл 17.09.2013 г. В октябре 2013 г. больная обратилась в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России для дообследования и определения тактики лечения.
Объективно: слизистая культи влагалища не изменена. В правой паховой области пальпировалось эластичное образование размерами до 2 см, безболезненное при пальпации, не связанное с кожей. При ректовагинальном осмотре узловые образования и инфильтраты в малом тазу не определялись. Уровень маркера СА-125 составил 134 Ед/мл.
КТ органов грудной и брюшной полости объемные патологические образования не выявило. При МРТ (01.10.2013 г.) органов малого таза в правой подвздошной области на уровне гребня правой подвздошной кости выявлен узел солидной структуры с четкими неровными контурами размерами 28 × 37 × 30 мм (рис. 1). Накопление контрастного вещества неоднородное. В правой паховой области визуализировались узлы размерами от 7 × 7 мм до 14 × 16 мм, активно накапливавшие контрастный препарат.
Рис. 1. Магнитно-резонансная томограмма органов малого таза пациентки Т. М. от 01.10.2013 г. А — Cor Т2-взвешенное изображение TSE в корональной плоскости (TR — 4860, TE — 104, FOV — 30 × 30 см, MTX — 384 × 224, ST — 4 мм), стрелкой обозначен рецидивный узел; Б — Ax Т2- взвешенное изображение TSE в аксиальной плоскости (TR — 3740, TE — 104, FOV — 34 × 34 см, MTX — 320 × 224, ST — 4 мм), стрелкой обозначен рецидивный узел. Здесь и далее в статье фото авторов
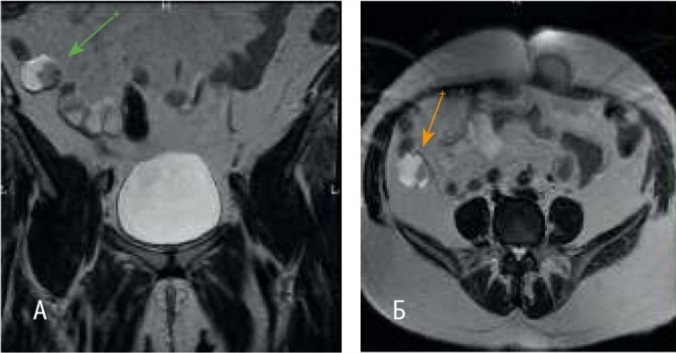
При молекулярно-генетическом тестировании повторяющиеся мутаций в генах BRCA1 (5382insC, 4153del, 185delAG) и BRCA2 (6174 delT) у пациентки не найдены. Тест выполнен при помощи аллель-специфической ПЦР. Поставлен диагноз: РЯ IIIC (pT3cN0M0). Состояние после хирургического лечения и химиотерапии (6 циклов по схеме РС в 2011 г.). Рецидив в малом тазу. Метастаз в правые паховые лимфатические узлы.
В декабре 2013 г. больная госпитализирована в онкогинекологическое отделение ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России для хирургического лечения.
При ревизии во время лапаротомии (06.10.2013 г.) обнаружена картина мелкоузлового канцероматоза в малом тазу; в правой подвздошной области, на брюшине (в области культи правой воронкотазовой связки) — солидный узел размерами около 40 мм с явлениями распада. Произведена циторедуктивная операция: удаление рецидивного узла, перитонэктомия, правосторонняя паховая лимфаденэктомия. С учетом оптимального объема циторедукции выполнена интраперитонеальная гипертермическая химиоперфузия цисплатином в дозе 100 мг/м2, уровень гипертермии — 41–43°С, объемная скорость — 1200 мл/мин, время — 60 мин. Интраоперационных осложнений не было. В послеоперационном периоде зафиксированы тошнота I степени, лейкопения I степени.
Гистологическое заключение: в 8 фрагментах брюшины, в 2 паховых лимфатических узлах метастазы серозной аденокарциномы яичников. Системная химиотерапия не проводилась.
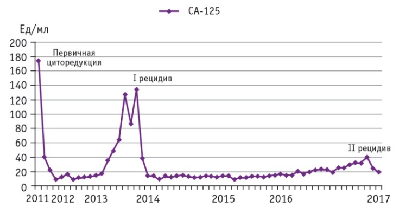
В последующем пациентка наблюдалась по месту жительства. Признаки прогрессирования опухолевого процесса по результатам инструментального обследования (КТ, МРТ) не определялись. Анализ динамики уровня опухолевого маркера СА-125 эскалацию выше референтных значений не фиксировал (рис. 2).
Рис. 2. Динамика уровня СА-125 за период наблюдения (2011–2017 гг.)
|
В сентябре 2016 г. больная обратилась для определения дальнейшей тактики лечения в НМИЦ онкологии им. Н.Н. Петрова. МРТ малого таза (19.09.2016 г.) показала в левой подвздошной области рецидивный узел размерами 24 × 26 × 35 мм, тесно прилежавший к брюшине, с признаками инвазии стенок прилежащего отдела сигмовидной кишки. На постконтрастных изображениях отмечалось активное гетерогенное накопление парамагнетика данным узлом. На фоне послеоперационных и рубцовых изменений культя влагалища без особенностей (рис. 3). |
Рис. 3. Магнитно-резонансная томограмма органов малого таза пациентки Т. М. от 19.09.2016 г. А — Cor Т2-взвешенное изображение TSE в корональной плоскости (TR — 4860, TE — 104, FOV — 30 × 30 см, MTX — 384 × 224, ST — 4 мм), стрелкой обозначен рецидивный узел; Б — Ax Т2-взвешенное изображение TSE в аксиальной плоскости (TR — 3740, TE — 104, FOV — 34 × 34 см, MTX — 320 × 224, ST — 4 мм), стрелкой обозначен рецидивный узел
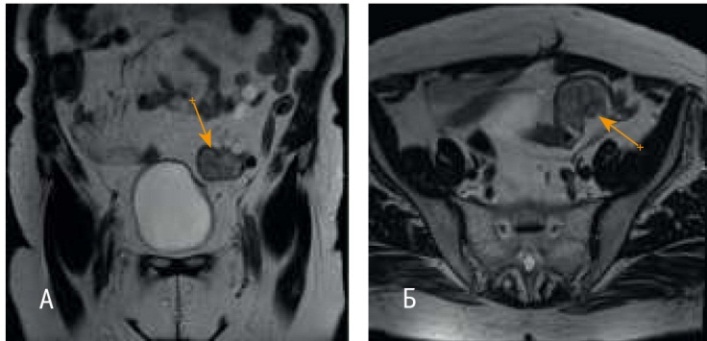
Признаков канцероматоза и отдаленного метастазирования в брюшной полости и грудной клетке по данным КТ не было. При проведении диагностической колоноскопии на расстоянии 25–26 см от ануса определялось сдавление кишки извне плотным образованием, суживавшим просвет до 13–15 мм.
Больная госпитализирована для хирургического лечения. При ревизии органов брюшной полости и малого таза при лапаротомии 05.10.2016 г.: в брюшной полости, малом тазу канцероматоза нет. В брыжейке сигмовидной кишки найден солидный узел размером около 40 мм, инвазировавший стенку кишки. Произведена внутрибрюшная резекция сигмовидной кишки. По данным гистологического заключения и иммуногистохимического типирования № 349816: High grade серозная карцинома яичников (WT1, ER, CK7, p53, PAX8 — позитивные; CK20, Pr — негативные). Рецидив в малом тазу с инвазией в стенку сигмовидной кишки, регионарные лимфатические узлы без метастазов. Края резекции сигмовидной кишки негативные.
С учетом благоприятного течения заболевания (отсутствие признаков канцероматоза и эскалации уровня опухолевого маркера, длительные безрецидивные промежутки, ответ на платиновую терапию) сформированы показания к расширенному молекулярному тесту — высокопроизводительному секвенированию (Next Generation Sequencing) кодирующей последовательности генов BRCA1 и BRCA2. В результате секвенирования выявлена мутация в гене BRCA2 c.5286T>G (p.Y1762X).
В последующем пациентка получила 6 циклов химиотерапии по схеме РС (паклитаксел в дозе 175 мг/м2 внутривенно, карбоплатин в дозе AUC 6 внутривенно с интервалом 21 день). В настоящее время признаки прогрессирования опухолевого процесса, по данным инструментального обследования, не выявлены.
ОБСУЖДЕНИЕ
Многочисленные работы указывают на яркие клинические особенности наследственного РЯ[9–16]. В исследованиях J. Boyd и соавт. [10], I. Cass и соавт. [11], D.S. Tan и соавт. [12] убедительно продемонстрирована лучшая выживаемость пациенток с BRCA-ассоциированным РЯ в сравнении с женщинами со спорадическим. Опухолевые клетки с нарушенной функцией генов BRCA1/2 не способны восстанавливать разрывы двойной цепи ДНК и демонстрируют повышенную чувствительностью к различным ДНК-повреждающим агентам. Ранее в клинике ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» в нескольких исследованиях доказана высокая эффективность ДНК-повреждающего препарата цисплатина у больных РЯ — носительниц мутаций в генах BRCA1/2[17, 18].
В статье представлено описание лечения больной РЯ с редкой мутацией в гене BRCA2 c.5286T>G (p.Y1762X) с анализом отдаленных результатов. Обращает на себя внимание, что у пациентки отсутствовали клинические признаки наследственного РЯ: заболевание манифестировало в 67 лет, случаев рака молочной железы или РЯ у родственниц не было. При молекулярно-генетическом тестировании повторяющиеся мутации в генах BRCA1 (5382insC, 4153del, 185delAG) и BRCA2 (6174 delT) у пациентки не обнаружены.
При анализе отдаленных результатов лечения обращал на себя внимание продолжительный бесплатиновый период: первый составил 48 месяцев, второй — 88,8 месяца. Это и послужило показанием к расширенному молекулярно-генетическому тесту. Мутация c.5286T>G (p.Y1762X) была описана A.J. Willems и соавт. (2008) у больного раком предстательной железы [19]. Однако в настоящее время не достаточно данных о клинической значимости мутации c.5286T>G (p.Y1762X) в гене BRCA2 у больных РЯ.
ЗАКЛЮЧЕНИЕ
В нашей работе сформулированы два важных прикладных аспекта. Во-первых, необходимо расширение показаний к молекулярно-генетическому тестированию у онкологических больных с целью установления наследственного характера заболевания, что может заметно изменить тактику лечения. Второй аспект — тестирование здоровых родственников пациентки; в случае подтверждения мутации организуется комплекс мероприятий, направленных на предупреждение и раннюю диагностику онкологического заболевания.
Работа поддержана грантом РНФ 14-25-00111.








