Влияние воспаления на онкогенез в настоящее время доказано и хорошо изучено, а хроническому воспалению отводится главенствующая роль в этиологии большого числа предопухолевых и опухолевых заболеваний, в том числе злокачественных новообразований женской репродуктивной системы. Например, риск развития рака шейки матки особенно высок среди носительниц ВПЧ онкогенного типа[1].
Сегодня все чаще обсуждается роль воспаления в канцерогенезе рака яичников (РЯ). Эпидемиологические данные свидетельствуют об увеличении заболеваемости РЯ среди пациенток с «хронической овуляцией» и ее снижении у женщин с длительной ановуляцией в связи с беременностями, родами, лактацией, а также приемом оральных контрацептивов; к факторам снижения риска развития РЯ также относят регулярный прием нестероидных противовоспалительных препаратов[2, 3].
Сочетание воспаления в период овуляции и целого ряда молекулярнобиологических и тканевых перестроек с определенной достоверностью позволяет описать вероятную модель канцерогенеза при спорадическом РЯ[4]. В результате многократных овуляторных травм покровного эпителия яичников формируется очаг хронического асептического воспаления, что стимулирует клетки поверхностного эпителия к постоянной пролиферации, увеличивая вероятность генетических повреждений и накопления эпигенетических модификаций[5, 6]. Источником такой пролиферации становятся опухолевые стволовые клетки (ОСК). При этом дальнейшие события могут развиваться по двум вариантам.
Если покровный эпителий представлен производными Мюллерова эпителия, то изначально имеет место относительно локализованный опухолевый процесс в зоне яичников или малого таза, постепенно распространяющийся по брюшной полости (I вариант). При этом варианте РЯ можно отметить многообразие гистологических типов. Если же покровный эпителий представлен мезотелиальным компонентом, то пролиферативный импульс распространен на весь мезотелий (II вариант). При этом изначально имеет место обширное опухолевое поле[7]. При втором патогенетическом варианте РЯ исходный пролиферативный импульс распространяется на весь мезотелий, способствуя стремительному нарастанию критической массы ОСК, циркуляторным руслом для которых становится не только крово или лимфоток, но и выпотная жидкость: асцит и плеврит, что является специфической особенностью РЯ.
Наличие асцита у больных РЯ тесно коррелирует с плохим прогнозом заболевания. Перитонеальная жидкость — основной фактор, обеспечивающий специфическую локализацию рецидивов и метастазов при РЯ (преимущественно в области малого таза), а также обширную внутрибрюшинную диссеминацию опухолевого процесса[8–10].
После признания фундаментальной роли ОСК в патогенезе РЯ и обнаружения метастатически активных ОСК в асците стало ясно, что именно асцит, являясь уникальной провоспалительной нишей туморогенных и химиорезистентных овариальных ОСК, способствует их обширной внутрибрюшинной диссеминации и появлению нечувствительных к стандартной химиотерапии, рецидивных и метастатических форм заболевания[11, 12]. В современном понимании образование опухолевого асцита — это накопление за счет лимфатической обструкции и повышенной сосудистой проницаемости избыточной перитонеальной жидкости, содержащей различные клеточные популяции, центральной из которых является популяция туморогенных ОСК, а также широкий спектр растворимых провоспалительных факторов, определяющих поведение ОСК в ходе дальнейшего канцерогенеза[13–15]. В асцитической жидкости женщин с рецидивными и химиорезистентными формами РЯ содержание ОСК существенно повышено по сравнению с таковым у первичных пациенток и у больных с химиочувствительными опухолями[16, 17].
Кроме ОСК, в асците больных РЯ обнаружены ассоциированные с опухолью фибробласты, мезенхимальные стволовые клетки и иммунные клетки. Будучи компонентами стромального опухолевого микроокружения, они вступают в процессы ауто-паракринной коммуникации и реципрокных отношений с растущими опухолевыми очагами, в результате чего индуцируется стромальный провоспалительный ответ, сопровождающийся образованием различных паракринных и аутокринных молекул (факторов роста, цитокинов, хемокинов, матриксных протеаз, иммуносупрессоров), оказывающих потенцирующее действие на канцерогенез[18, 19].
В асцитах больных РЯ экспрессируются в повышенных количествах проангиогенные факторы — ангиогенин, ангиопоэтин 2 и фактор роста эндотелия сосудов, онкоген GRO (growth related oncogene), молекула межклеточной адгезии ICAM1 (intercellular adhesion molecule 1), ИЛ6, ИЛ1β, ИЛ8, ИЛ10, ИЛ15, а также целый ряд других сигнальных молекул[20–22].
Для многих из этих соединений доказана прогностическая клиническая значимость. У больных РЯ повышенная концентрация в асците (по сравнению с сывороткой крови) важнейших провоспалительных цитокинов — ИЛ1β, ИЛ6, ИЛ8 и ИЛ10 — достоверно коррелировала с плохими прогнозом и ответом на стандартную терапию[23, 24].
Другими авторами установлено, что уровень экспрессии ИЛ8 в овариальных опухолевых клетках коррелировал с их повышенной туморогенностью и образованием асцита, а увеличение содержания ИЛ8 в асците у больных распространенным РЯ вносит важный вклад в общую проангиогенную активность раковых клеток[25]. Доказано, что ИЛ6 способен стимулировать опухолевый рост, инвазию, ангиогенез[26], химиорезистентность. Повышенный уровень ИЛ6 в асците при РЯ коррелирует с уменьшением безрецидивной выживаемости, а у пациенток, отвечавших на стандартную химиотерапию, в асците определялся пониженный уровень ИЛ6 по сравнению с больными, не имевшими ответа на химиотерапию[27]. Вклад в иммуносупрессивную среду вносит упомянутый нами выше ИЛ10, подавляющий Тклеточный иммунный ответ[26].
В настоящее время растет понимание того, что асцит при РЯ является легко доступным и крайне ценным источником опухолевого материала, содержащего широкий спектр растворимых компонентов и клеточных популяций, ответственных за овариальный канцерогенез.
Характеристика и изменение молекулярного и генетического профиля этих факторов в ходе лечения могут рассматриваться как достоверные прогностические маркеры, а также маркеры оценки эффективности (мониторинга) проводимой противоопухолевой терапии[23, 24, 28].
Для терапии больных РЯ применяют традиционные методы лечения рака, такие как хирургия и химиотерапия. Основной мишенью эффективной лекарственной терапии должны стать ОСК, а также всевозможные молекулярные мишени, включая медиаторы воспаления, обеспечивающие различные звенья канцерогенеза[29, 30].
Среди известных противоопухолевых соединений с подобным механизмом воздействия особого внимания заслуживают пищевые индолы – индол3карбинол (Indole3Carbinol, I3C), его физиологический метаболит 3,3’дииндолилметан и флавоноид эпигаллокатехин3галлат (Epigallocatechin gallate, EGCG)[31–33]. Соединения I3C и EGCG обладают противоопухолевой активностью за счет стабилизации генома, уменьшения эстрогензависимой (восстановление соотношения 2ОНЕ/16αОНЕ) и эстрогеннезависимой пролиферации, стимуляции апоптоза, деметилирования геновонкосупрессоров, подавления асептического хронического воспаления и неоангиогенеза, управления дифференцировкой ОСК и снижения их химиорезистентности и метастатической активности[20].
Таким образом, для достижения максимального терапевтического эффекта при лечении злокачественных опухолей предлагается использовать ингибиторы ОСК в комплексе со средствами стандартной терапии[20, 34, 35]. В этом случае, помимо эрадикации первичного очага, можно ожидать уменьшения вероятности рецидива, а также роста чувствительности опухоли к средствам традиционной терапии.
Основываясь на вышесказанном, мы посчитали необходимым включить в состав стандартной терапии РЯ препарат I3C в сочетании с EGCG, чтобы посредством его воздействия на основные звенья этиопатогенеза заболевания повысить ее эффективность.
Цель исследования: определение уровней цитокинов в асцитической жидкости у пациенток с серозным РЯ III–IV стадии до и после неоадъювантной химиотерапии (НХТ), проводимой на фоне применения препарата I3C в сочетании с EGСG.
МАТЕРИАЛЫ И МЕТОДЫ
Все пациентки проходили обследование и лечение в отделении онкогинекологии ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России в 2015–2016 гг.
Асцитическая жидкость до начала специального лечения была взята у 24 пациенток. Семь из них не смогли завершить участие в исследовании. Причинами стали гранулезоклеточная опухоль (ГКО), вторичное метастатическое поражение яичников, цистаденома яичника, терапевтическая патология (цирроз печени), и у одной женщины забор биологического материала проведен во время оперативного вмешательства, без НХТ. Результаты, полученные у этих пациенток, были рассмотрены за рамками протокола, они представляют научный интерес в качестве группы сравнения.
Таким образом, в исследование вошли 17 женщин. Средний возраст составил 59 ± 3,8 года. Критериями включения были впервые установленный и морфологически верифицированный серозный РЯ III–IV стадии, асцитный вариант; отсутствие мутации генов BRCA1 и BRCA2, подписанное информированное согласие, общее состояние больной по шкале Eastern Cooperative Oncology Group — 0–2 балла, возраст старше 18 лет, ожидаемая продолжительность жизни — более 6 месяцев.
На 1м этапе комбинированного лечения проводилась НХТ по стандартной схеме: паклитаксел 175 мг/м2 в/в в 1й день и карбоплатин (AUC 6) в/в во 2й день, медиана составила 4 курса (2–8), с интервалом в 21 день. Дополнительно к НХТ все больные, включенные в исследование, на протяжении всего курса лечения получали препарат, содержащий I3C и EGCG, по 2 капсулы 3 раза в сутки.
На 2м этапе всем 17 пациенткам было выполнено хирургическое вмешательство (экстирпация матки с придатками, субтотальная резекция большого сальника).
Забор биологического материала (асцита) осуществлялся двукратно: до начала НХТ путем лапароцентеза и интраоперационно (не ранее чем через 21 день после НХТ, медиана — 28 дней).
Забор асцита производился в стерильные стандартные пробирки объемом 50 мл. Центрифугирование полученного материала проводилось при 1500 об./мин в течение 15 минут при комнатной температуре для сепарации клеточной части. Затем образцы помещали на хранение в специализированную холодильную камеру с температурным режимом –80 °С и в последующем транспортировали в специальном контейнере для перевозки биологического материала в лабораторию.
В лаборатории на полученных образцах асцита было проведено цитокиновое профилирование с использованием набора BioPlex Pro Human Cytokine 17plex Assay (BioRad, США). По 50 мкл смеси магнитных микрочастиц вносили в лунки 96луночного планшета, затем дважды промывали частицы буфером для промывки и вносили по 50 мкл стандарта или образца в соответствующие лунки. Инкубирование проводили при комнатной температуре на орбитальном шейкере 850 об./мин в течение 30 минут. Затем планшеты промывали трижды буфером для промывки и в каждую лунку добавляли по 25 мкл биотинилированных антител. Через 30 мин инкубации при комнатной температуре производили три промывки и вносили по 50 мкл буфера StreptavadinPE с последующим инкубированием в течение 10 минут. Планшеты были промыты трижды буфером для промывки, после чего микрочастицы ресуспендировали в 125 мкл буфера для анализа. Измерение проводили с помощью прибора BioPlex Reader. Были определены уровни 17 цитокинов: ИЛ1β, ИЛ2, ИЛ4, ИЛ5, ИЛ6, ИЛ7, ИЛ8, ИЛ10, ИЛ12, ИЛ13, ИЛ17, GCSF, GMCSF, ИФНγ, MCP1 (MCAF), MIP1b, ФНОα — до и после НХТ.
Статистическая обработка полученных результатов проведена на компьютере при помощи программного пакета SPSS Statistics 21.0 for Windows. Изза небольшой выборки и отличного от нормального распределения в ходе анализа применяли непараметрические методы. По этой же причине в описательном анализе данных, помимо среднего значения, высчитывалась медиана. Различия считали статистически значимыми при р ≤ 0,05.
РЕЗУЛЬТАТЫ
Для определения динамики уровней цитокинов в опухолевом асците в ответ на химиотерапию нами было проведено цитокиновое профилирование.
У пациенток в общей группе (n = 24) средняя концентрация ИЛ1β в асците до НХТ составила 2–3 (0–5) нг/мл, ИЛ4 — 2–3 (0–5) нг/мл, ИЛ6 — 0–10 000 нг/мл, ИЛ8 — 0–350 нг/мл, ИЛ10 — 0–160 нг/мл.
В группе пациенток, завершивших исследование (n = 17), после НХТ значимо уменьшилось содержание всех цитокинов, особенно выраженно снизились уровни ИЛ6 и ИЛ8 (табл., рис. 1, 2).
Таблица
Динамика уровней цитокинов в асците на фоне неоадъювантной химиотерапии в сочетании с приемом препарата индол-3-карбинола и эпигаллокатехин-3-галлата
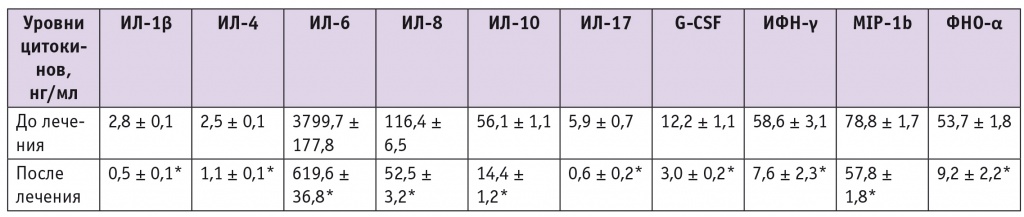
* Отличие от исходного уровня статистически значимо (р ≤ 0,05).
Рис. 1. Динамика уровней цитокинов со средней концентрацией менее 60 нг/мл на фоне неоадъювантной химиотерапии в сочетании с препаратом индол-3-карбинола и эпигаллокатехин-3-галлата. Содержание интерлейкинов (ИЛ) 5, 7, 12 и GM-CSF оказалось ниже детектируемого уровня чувствительности прибора, и сигнал обнаружен не был.
* Отличие от исходного уровня статистически значимо (р ≤ 0,05)
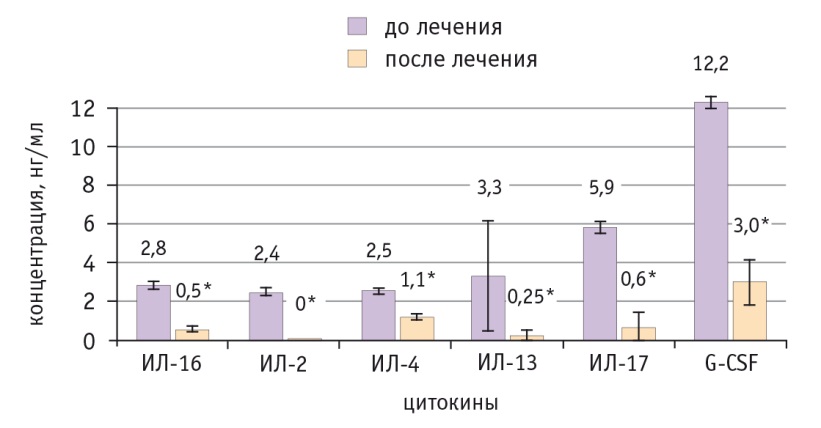
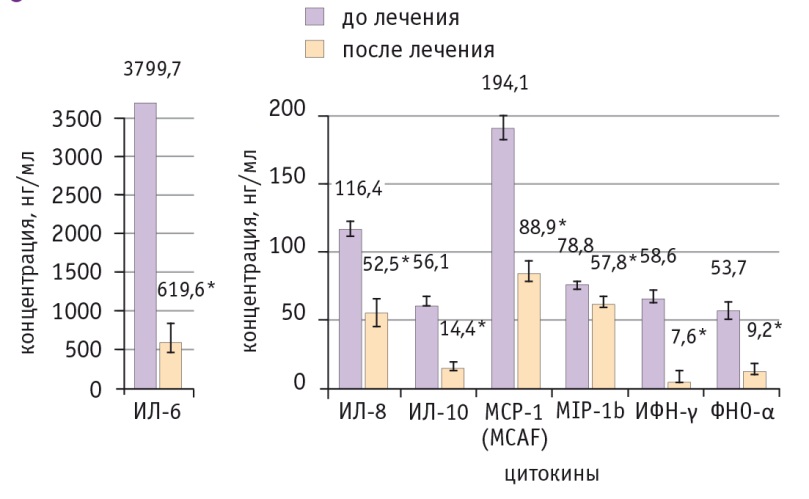
Рис. 2. Динамика уровней цитокинов со средней концентрацией 60 нг/мл и более на фоне неоадъювантной химиотерапии в сочетании с препаратом индол-3-карбинола и эпигаллокатехин-3-галлата.
* Отличие от исходного уровня статистически значимо (р ≤ 0,05)
В нашем исследовании у пациентки с неблагоприятным прогнозом (низкая степень дифференцировки опухоли, молодой возраст) и плохим ответом на НХТ регистрировались изначально высокие уровни ИЛ5, ИЛ6, ИЛ10, MCP1 (MCAF). После НХТ отсутствовала положительная динамика в виде снижения концентраций в асците ИЛ1β, ИЛ4, ИЛ5, ИЛ6, ИЛ8, ИЛ17, GCSF, ИФНγ, MCP1 (MCAF), ФНОα. Отмечено увеличение уровня ИЛ10. Таким образом, отсутствие уменьшения содержания цитокинов может быть фактором неблагоприятного прогноза.
Среди результатов пациенток, исключенных из основной группы исследования, интерес представляют следующие данные. При цистаденоме яичника регистрировались наименьшие значения ИЛ6 (113 нг/мл), ИЛ10 (3,3 нг/мл), ИЛ1β (0,6 нг/мл), ИЛ4 (1,2 нг/мл), GCSF (1,99 нг/мл), ИФНγ (15,9 нг/мл), ФНОα (17,4 нг/мл). У пациентки с ГКО установлены минимальные значения ИЛ1β (0,5 нг/мл), ИЛ4 (0,2 нг/мл), ИЛ6 (375,4 нг/мл), ИЛ8 (18,7 нг/мл), ИЛ10 (3,5 нг/мл), ИФНγ (7,5 нг/мл); GCSFне определялся.
В асцитической жидкости, полученной интраоперационно у пациентки, которая не получала НХТ, наблюдались высокие уровни ИЛ1β (5,1 нг/мл), ИЛ4 (4,6 нг/мл), ИЛ6 (9728,7 нг/мл), ИЛ8 (368,7 нг/мл), GCSF (12,1 нг/мл), MCP1 (MCAF) (227,2 нг/мл), ФНОα (87,9 нг/мл), ИФНγ (86,3 нг/мл), значительно превышающие концентрации данных цитокинов в группе пациенток, получавших НХТ, что говорит о необходимости ее проведения у женщин с асцитной формой РЯ.
ОБСУЖДЕНИЕ
В нашем исследовании определение уровней медиаторов воспаления проводилось дважды — до и после НХТ, что позволило оценить их динамику. До начала НХТ уровни факторов воспаления у всех больных, включенных в наше исследование, были значимо увеличены и превышали те же показатели у пациенток с доброкачественными новообразованиями. На фоне проведенной НХТ в сочетании с приемом препарата I3C и EGCG в большинстве наблюдений отмечено снижение уровней цитокинов, что позволяет предположить, улучшение прогноза дальнейшего течения и исхода заболевания.
Показано, что асцит — это провоспалительная среда, в которой концентрации биологически активных веществ (цитокинов, хемокинов и факторов роста) способны динамично изменяться, в том числе на фоне НХТ. Они могут быть использованы как биомаркеры, прогнозирующие лекарственную резистентность. Полноценное исследование цитокинов и других молекулярнобиологических факторов позволяет дополнить и обосновать теорию канцерогенеза РЯ.
В данной статье представлены результаты пилотного исследования. Научная работа продолжается, проводится набор пациенток как в основную группу, так и в контрольную. Полученные результаты мы представим в наших следующих публикациях. Но уже на данном этапе становится очевидным, что включение в протокол комбинированного лечения серозного РЯ препаратов, содержащих I3C и EGCG, представляет собой попытку улучшить прогноз заболевания, воздействуя на разные уровни сигнальных каскадов и метаболических путей канцерогенеза.
ЗАКЛЮЧЕНИЕ
Определение уровней медиаторов воспаления в асците у больных распространенным серозным раком яичников (РЯ) до и после проведения стандартной неоадъювантной химиотерапии (НХТ), дополненной применением препаратов, содержащих индол3карбинол и эпигаллокатехин3галлат, безусловно, имеет весомые основания и научный интерес с точки зрения их прогностической значимости и дальнейшего клинического течения заболевания. Уровни цитокинов в асците при РЯ могут служить своеобразными биомаркерами, необходимыми для своевременной оценки чувствительности опухоли к тому или иному лекарственному препарату и коррекции проводимой терапии.
_____
Цитокиновое профилирование выполнено в рамках гранта Российского научного фонда (Проект № 177520205).







