Частота местнораспространенного рака шейки матки (МРШМ), по данным различных исследований, колеблется от 41,2% до 70%[1, 2]. Несмотря на определенные успехи в его лечении, в этой области онкологической практики имеется целый ряд проблем и ограничений [1–5]. Прогресс в понимании причин и механизмов развития РШМ не позволил достигнуть скольконибудь значительного снижения показателя запущенности. Почти 50% женщин умирают в течение первого года в связи с поздней диагностикой и высоким (более 48%) удельным весом заболевания IIb–IV стадии[6, 7]. Сохраняется тенденция к росту числа больных молодого возраста. В возрасте 25–39 лет находятся более 60% пациенток, в этой группе РШМ занимает 2е место среди злокачественных новообразований — 11,8%[4, 7, 8].
В клинике Российского научного центра рентгенорадиологии в течение последних 20 лет проводятся исследования, направленные на формирование концепции многокомпонентного лечения МРШМ с использованием неоадъювантной полихимиотерапии и последующим хирургическим вмешательством[1, 6], 199 больных получили неоадъювантную полихимиотерапию с включением препаратов таксанового ряда и платины. Из этой группы у 139 (69,8%) пациенток установлена IIIВ стадия по классификации International Federation of Gynecology and Obstetrics (FIGO). Целесообразность включения лекарственной терапии на начальных этапах лечения МРШМ обусловлена влиянием неоадъювантной полихимиотерапии на первичный опухолевый очаг, метастазы и опухолевые эмболы[2–4, 8].
Применение неоадъювантной полихимиотерапии способствует максимальному уменьшению объема опухоли и параметральной инфильтрации, что позволяет более адекватно удалить первичную опухоль, регионарные метастазы и потенциально резистентные очаги, облегчает возможность полноценного стадирования, снижает риск интраоперационной диссеминации опухолевых клеток[4]. Подобные комплексные подходы[1, 3, 6] позволили повысить средние показатели общей (до 70,4%) и безрецидивной (до 62,8%) выживаемости больных МРШМ.
У значительной части пациенток при распространенном РШМ, особенно с экзофитными формами роста, заболевание сопровождается кровотечением из опухоли, объем которого может угрожать жизни больной. Резкое и значительное снижение уровня гемоглобина ограничивает возможности проведения специальной терапии.
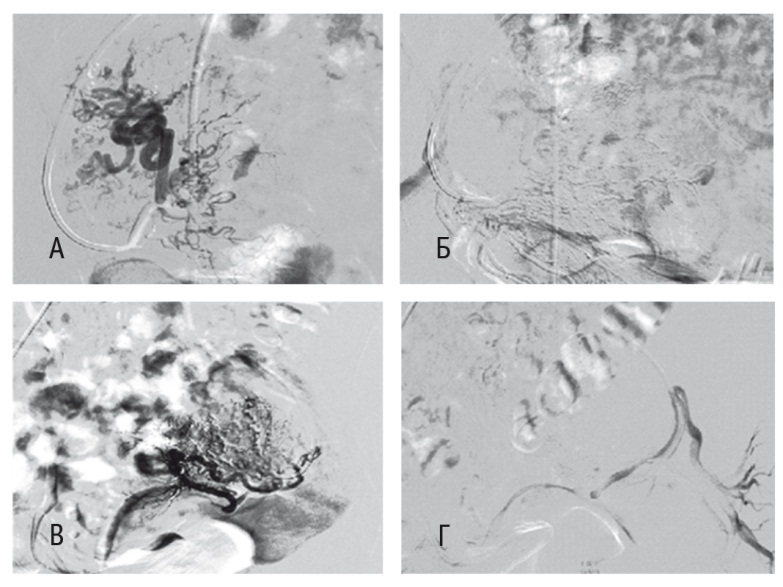
Одним из методов остановки кровотечения является эмболизация маточных артерий (ЭМА). Селективная эмболизация маточных сосудов снижает скорость кровотока и вследствие этого — кровопотерю, благодаря гипоксии уменьшается объем опухоли, а также происходит частичный некроз в ткани новообразования. В сочетании с внутриартериальной химиотерапией методика позволяет в 1,5 раза повысить концентрацию лекарственных препаратов в опухоли и в то же время снизить токсичность химиотерапии (рис. 1)[9, 10].
Рис. 1. Химиоэмболизация маточных артерий (ХЭМА) у пациентки В., 55 лет, с раком шейки матки IIIB стадии (Т2bN1М0): А — правая маточная артерия до ХЭМА; Б — правая маточная артерия после ХЭМА; В — левая маточная артерия до ХЭМА; Г — левая маточная артерия после ХЭМА. Здесь и далее в статье фото из архива Российского научного центра рентгенорадиологии
Эндоваскулярные вмешательства применяются уже более 100 лет. Основополагающими в этой области были исследования S. I. Seldinger (1953), который разработал методику чрескожной пункции сосудов[11], и P. Oedman, который в 1959 г. предложил использовать рентгеноконтрастные катетеры. С 1990х гг. рентгеноэндоваскулярные вмешательства начали применяться и в онкологии для лечения больных со злокачественными поражениями печени, почек, мочевого пузыря, а также РШМ[12, 13]. J. A. Oliver (1979) впервые применил ЭМА для остановки профузного кровотечения после родов. С 1997 г. ЭМА — один из основных эффективных методов лечения больных миомой матки.
Внутриартериальная химиотерапия при РШМ используется более 20 лет. При внутриартериальном введении высокая концентрация химиопрепарата создается не только в самой опухоли, но и в регионарных лимфатических узлах и параметральной клетчатке[14].
По данным литературных источников[14–17], проведение внутриартериальной химиотерапии в сочетании с ЭМА улучшает результаты комплексного лечения и оптимизирует условия хирургических вмешательств.
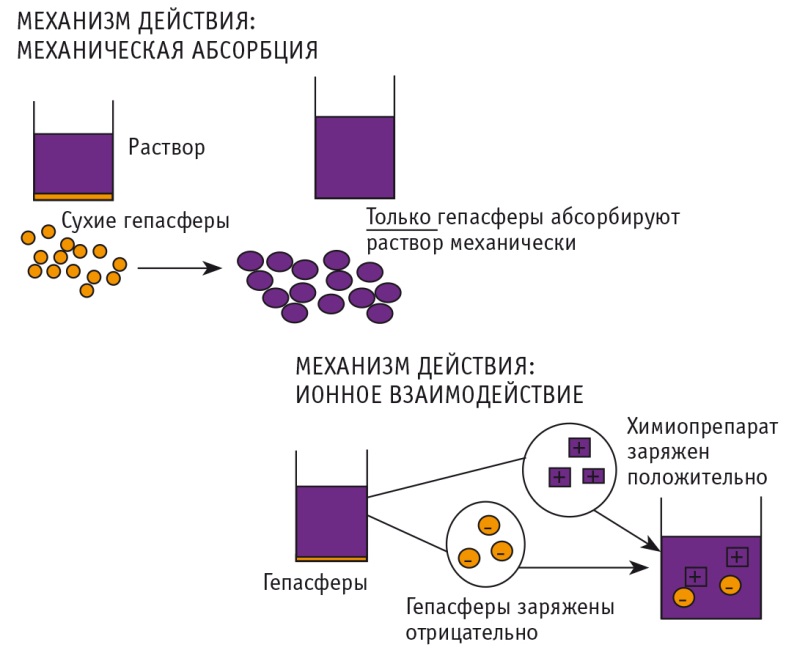
Важным фактором, определяющим эффективность рентгеноэндоваскулярной окклюзии артерий, является выбор эмболизирующих препаратов. В рамках настоящего исследования были использованы эмболизационные материалы нового поколения, способные загружать, транспортировать и высвобождать цитостатики непосредственно в опухолевую ткань, что улучшает результаты лечения, создавая более высокую концентрацию препаратов в опухоли. При применении загружаемых микросфер — гепасфер, представляющих собой кополимер акрилата натрия и этилового спирта, — связывание химиопрепарата происходит как за счет ионообменного механизма, так и за счет абсорбции (рис. 2).
Рис. 2. Сравнение различных механизмов действия эмболизирующих материалов
В настоящее время нет четко обоснованного и однозначного представления специалистов об особенностях воздействия и необходимой дозировке лекарственных препаратов, применяемых для химиоэмболизации маточных артерий (ХЭМА). В большинстве исследований представлены результаты использования препаратов платины (в основном цисплатина) в различных дозировках: гемцитабин, доксорубицин, цисплатин — 75 мг/м2, доцетаксел — 75 мг/м2, доцетаксел 75 мг/м2 + цисплатин 100 мг/м2 по 2 цикла с интервалом 4–5 недель, карбоплатин, цисплатин 100 мг/м2 + доксорубицин 40 мг/м2[5, 18–22].
Цель исследования: оценка эффективности и целесообразности селективной ХЭМА в комплексном лечении МРШМ.
МАТЕРИАЛЫ И МЕТОДЫ
В Российском центре рентгенорадиологии и в Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии им. акад. В. И. Кулакова накоплен собственный опыт проведения ХЭМА. С 2014 по 2017 г. произведена селективная ХЭМА 49 больным МРШМ IB–IIIB стадий: 16 (32,7%) со стадией Ib2а по FIGO (Т1b2аN0М0), 18 (36,7%) со стадией IIb (Т2bN0М0), 15 (30,6%) со стадией IIIаb (Т1bN1V0, Т2aN1М0, Т2bN1М0, Т3bN0М0, Т3bN1М0).
Средний возраст пациенток — 45,8 года. Средний объем шейки матки до лечения составил 88,3 см3. Среди участниц преобладали больные с экзофитными формами роста опухоли (44%), смешанная форма роста опухоли имела место у 24% пациенток и эндофитная форма — у 32%. Морфологически структура опухолей была представлена плоскоклеточным раком в подавляющем большинстве наблюдений (89,7%, из них низкодифференцированный рак — 26,9%). У остальных 10,3% женщин диагностирована аденокарцинома.
Все пациентки были комплексно обследованы до начала лечения.
Проведены цистоскопия, ректороманоскопия/колоноскопия, МРТ органов малого таза с внутривенным контрастированием, ультразвуковое 3Dисследование органов малого таза, измерение уровня онкомаркера SCC. Для оценки характера и интенсивности васкуляризации опухолевого очага использовали методики ультразвуковой ангиографии с трехмерной реконструкцией сосудов, изображение которых было получено в режиме энергетического доплеровского картирования. Проводилась также оценка гемодинамических показателей внутриопухолевого кровотока и кровотока в маточных и яичниковых артериях в динамике: до начала лечения и на 7й, 14й, 21й день после ХЭМА.
Всем пациенткам была произведена селективная ХЭМА с использованием карбоплатина AUC 4. После операции осуществляли еженедельный мониторинг объема шейки матки и кровотока в опухоли.
Критерии включения в исследование:
1) возраст не менее 18 лет;
2) наличие гистологически подтвержденного РШМ;
3) объем шейки матки 50 см3 и более и/или кровотечение из опухоли.
Критерии исключения из исследования:
1) объем шейки матки менее 50 см3 при отсутствии кровотечения из опухоли;
2) тяжелые соматические заболевания;
3) непереносимость используемых препаратов;
4) технические сложности, анатомические особенности, выявленные интраоперационно (в процессе проведения ангиографии):
- дистальные анастомозы между маточной и пузырной артериями, требующие использования для эмболизации с целью остановки кровотечения спиралей Gianturco;
- стеноз маточной артерии (в данном случае пациентке проводится химиоэмболизация с одной стороны);
5) отказ от участия в исследовании.
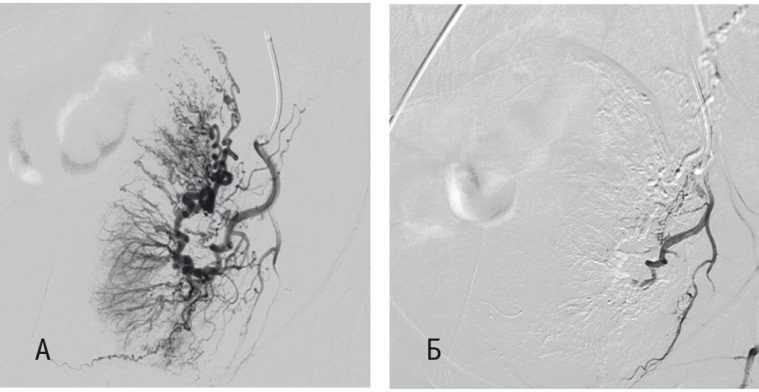
Методика эмболизации. В условиях рентгенооперационной под спинномозговой анестезией производят пункцию бедренной артерии. Поэтапно катетер типа Робертс 5F проводят и устанавливают селективно в левую внутреннюю подвздошную артерию. Выполняют ангиографию для уточнения рентгеноанатомии левой маточной артерии, после чего катетер Робертс устанавливают суперселективно в левую маточную артерию. Выполняют селективное медленное введение химиопрепарата карбоплатина AUC 4 и сразу же — химиоэмболизацию артерии микросферами Hepasphere 2 мл (размер микросфер подбирают индивидуально в зависимости от диаметра маточных артерий), заранее загруженными химиопрепаратом карбоплатином 50 мг. После эмболизации артерии осуществляют контрольную ангиографию для подтверждения отсутствия кровотока в маточной артерии, а также выявления дополнительных источников кровоснабжения опухоли. При их отсутствии катетер Робертс проводят по проводнику с гидрофильным покрытием на ипсилатеральную сторону, и процедура повторяется (рис. 3).
Рис. 3. Левая маточная артерия до (А) и после (Б) проведения химиоэмболизации маточной артерии
РЕЗУЛЬТАТЫ
У всех пациенток в течение недели после операции удалось добиться остановки или значительного снижения интенсивности кровотечения из опухоли.
При контрольном обследовании установлено значительное уменьшение объема опухоли после ХЭМА — он составил от 16 см3 до 63 см3, в среднем — 36,6 см3. При этом наибольшее снижение объема (на 76,3%) отмечено у пациенток с экзофитными формами заболевания. При использовании режима энергетического доплеровского картирования было выявлено существенное снижение количества внутриопухолевых сосудов и скорости кровотока, повышение индекса резистентности.
Наибольший эффект от проведенного лечения отмечен через 14 дней после ХЭМА, что позволило именно в этот промежуток времени определить дальнейшую тактику ведения пациенток (рис. 4, 5).
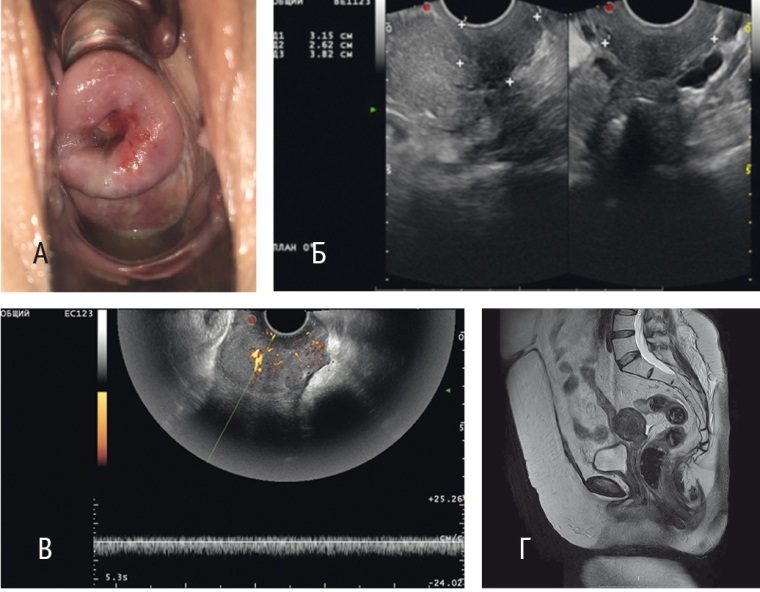
Рис. 4. Пациентка В. Рак шейки матки IIА стадии (до лечения): А — осмотр в зеркалах, первичный объем опухоли шейки матки — 203 см3; Б — ультразвуковое исследование в режиме серой шкалы; В — ультразвуковое исследование в режиме энергетического доплеровского картирования с трехмерной реконструкцией; Г — магнитно-резонансная томограмма органов малого таза (саггитальный срез)
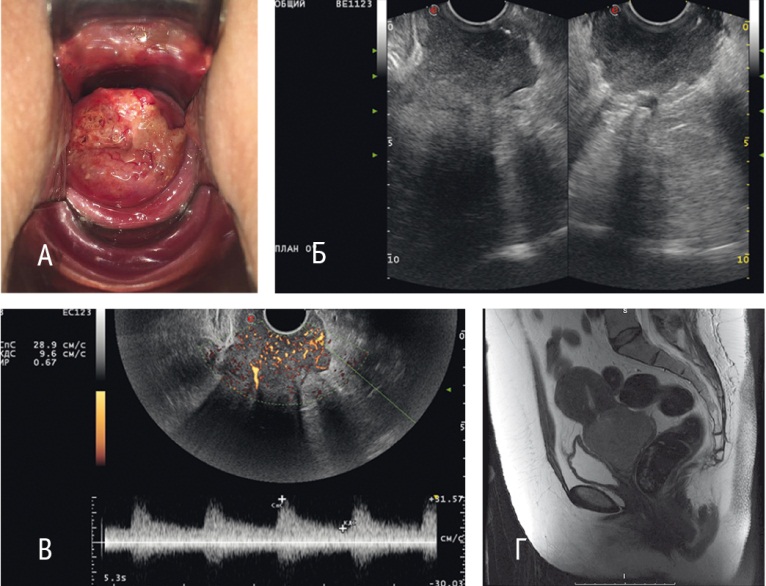
Рис. 5. Пациентка В. Рак шейки матки IIА стадии (после химиоэмболизации маточных артерий): А — осмотр в зеркалах, объем шейки матки — 25 см3; Б — ультразвуковое исследование в режиме серой шкалы; В — ультразвуковое исследование в режиме энергетического доплеровского картирования с трехмерной реконструкцией; Г — магнитно-резонансная томограмма органов малого таза (саггитальный срез)
Через 21 день после ХЭМА 10 (20,4%) пациенткам, у которых отсутствовала инфильтрация параметральной клетчатки и объем опухоли уменьшился на 50% и более, было произведено хирургическое лечение в объеме расширенной экстирпации матки с придатками/без придатков. У 39 участниц продолжено проведение неоадъювантной полихимиотерапии — 2 курса в таксаноплатиновом режиме с интервалом 21 день. После завершения 2 курсов полихимиотерапии осуществили радикальное хирургическое лечение еще 25 (51,0%) пациенткам, у которых после комплексной неоадъювантной терапии удалось добиться значительного уменьшения объема опухоли и резорбции параметральных инфильтратов. У 14 (28,6%) участниц с остаточной параметральной инфильтрацией или уменьшением объема опухоли шейки матки менее чем на 50% провели курс сочетанной лучевой терапии.
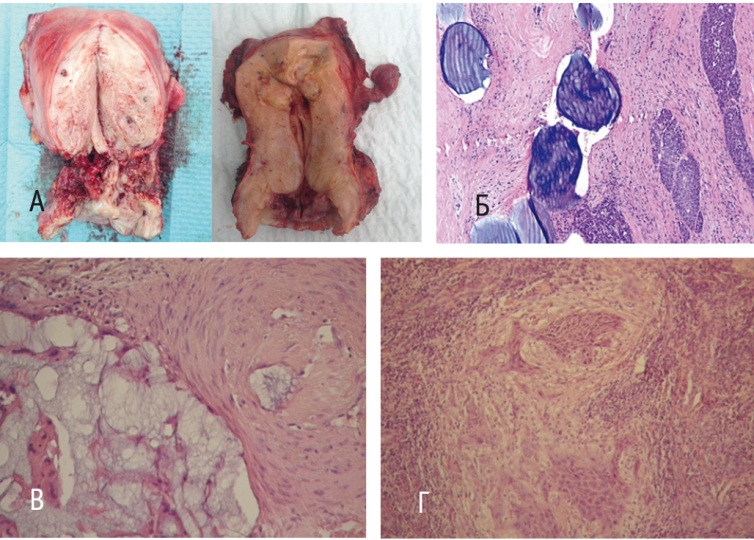
По данным гистологического исследования послеоперационного материала прооперированных больных, лечебный патоморфоз в опухоли был выявлен во всех 35 наблюдениях. Патоморфоз 1й степени отмечен у 42,8%, 2й степени — у 31,4 %, 3–4й степени — у 25,8% женщин. Таким образом, у большинства пациенток имел место выраженный ответ на проведенное неоадъювантное лечение (рис. 6).
Рис. 6. Патоморфоз опухоли после химиоэмболизации маточных артерий: А — эмболизат в сосудах миометрия и стромы шейки матки (макроперапарат); Б — эмболизат в просвете артерий (окраска гематоксилином и эозином); В — жировая эмульсия в просвете артерий стромы шейки матки (окраска гематоксилином и эозином); Г — комплексы дистрофичных клеток плоскоклеточного рака в строме шейки матки, лечебный патоморфоз 2-й степени (окраска гематоксилином и эозином)
ОБСУЖДЕНИЕ
Несмотря на широкий спектр мнений различных авторов и существенные различия в трактовке полученных результатов лечения с использованием ХЭМА при РШМ, следует подчеркнуть значительную роль и большие перспективы данного метода.
Для достижения наибольшего эффекта в виде уменьшения объема первичной опухоли предпочтительно выполнение ХЭМА. При использовании этой методики достигаются мощный противоопухолевый лекарственный и гемостатический эффекты. При отсутствии массивного кровотечения из опухоли предпочтение следует отдать системной химиотерапии с последующей, через 14–21 день, селективной ХЭМА. Эффективность данного метода необходимо оценивать по результатам комплексного обследования (МРТ, УЗИ органов малого таза), а также на основании общего состояния пациентки, восстановления уровня гемоглобина за счет остановки или значительного снижения интенсивности кровотечения из опухоли, уменьшения объема опухоли шейки матки.
Быстрое восстановление показателей крови и уменьшение опухоли за счет снижения ее кровоснабжения после селективной ХЭМА при МРШМ позволяют не только продолжить лечение в оптимальные сроки, но и выполнить радикальную хирургическую операцию у большинства больных с последующим полноценным курсом лучевой терапии.
Отдаленные результаты общей и безрецидивной выживаемости оценить пока не представляется возможным, но все пациентки находятся под динамическим наблюдением, прогрессирование заболевания на настоящий момент выявлено лишь у 4 (8,2%) больных с IIIB стадией в виде местного рецидива.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования свидетельствуют о целесообразности включения в комплексное лечение больных местнораспространенным раком шейки матки селективной химиоэмболизации маточных артерий. Применение этого метода представляется особенно перспективным у пациенток с экзофитной формой роста опухоли, сопровождающейся кровотечением, поскольку оно позволяет существенно расширить возможности последующего специального лечения.








