Приоритетами современных программ охраны репродуктивного здоровья женщин являются профилактика и своевременная диагностика рака шейки матки (РШМ), который занимает 2-е место в мире в общей структуре причин смерти женщин 15–44 лет [1]. Согласно сведениям экспертов, неблагоприятной тенденцией становится омоложение пациенток с цервикальными дисплазиями и неоплазиями [1–5]. По заключению рабочей группы ВОЗ, при отсутствии должного внимания и задержке с принятием необходимых мер в течение ближайших 10 лет смертность от РШМ возрастет на 25% [4].
В большинстве развитых стран мира за последние три десятилетия отмечено существенное снижение заболеваемости РШМ, главным образом за счет планомерной работы государственных скрининговых программ [2, 6]. Доказанными мерами повышения эффективности профилактики РШМ являются, во-первых, организованное, а не оппортунистическое проведение цитологического скрининга; во-вторых, вовлечение в обследование большего числа женщин (не менее 80%) [2, 6, 7].
Еще одно перспективное современное направление совершенствования скрининговых программ — внедрение новых технологий и методов исследований. После установления роли ВПЧ в цервикальном канцерогенезе во многих странах стали активно включать выявление ВПЧ высокого онкогенного риска (ВПЧ-ВР) в программы скрининга РШМ [2, 3, 7–10]. Рекомендуемый возраст начала цитологического скрининга составляет 25 лет, а ВПЧ-тестирования — 30 лет [2, 3, 6, 7].
Наблюдения последних лет показали, что использование только ВПЧ-теста в качестве скринингового метода у женщин старше 25 лет имеет равную эффективность с гибридным скринингом, при котором в возрасте 25–29 лет проводят только цитологическое исследование, а в группе старше 30 лет дополнительно выполняют ВПЧ-тест [10]. Установлено, что тестирование на ВПЧ обладает гораздо более высокой чувствительностью для выявления high grade squamous intraepithelial lesion (HSIL), чем цитологическое исследование, а персональная идентификация ВПЧ 16-го и 18-го типов может представлять собой более ценную методику для первичного скрининга РШМ в сравнении с жидкостной цитологией [11].
По данным многочисленных исследований, проведенных в странах с разным социально-экономическим уровнем развития, существенным препятствием для реализации скрининговых программ по профилактике РШМ является нежелание пациенток посещать гинеколога из-за неприятных ощущений, возникающих во время забора материала для цитологического исследования или типирования ВПЧ. В связи с этим в последние годы в мире разработаны различные устройства для самозабора вагинальных выделений для ВПЧ-теста и дана оценка их диагностической ценности, экономической эффективности и удобства применения [12–20].
Многоцентровые исследования продемонстрировали достаточно высокую чувствительность метода самозабора образца для ВПЧ-теста: на Гаити — 87,5% [21], в Китае — 86,2% [22]; в США — 85% [23], в Индии — 83% [24], в Великобритании — 81% [25], в России — 78,3% [26]. В более ранней работе, датированной 2000 г., показана меньшая чувствительность данного способа — 66% [27], что, на наш взгляд, связано с недостаточно отработанной технической стороной метода на этапе его внедрения.
Все исследователи отмечают экономическую эффективность, основанную на снижении стоимости такого варианта обследования в связи с отсутствием затрат на визит к врачу, расходов при заборе и транспортировке материала, рассылки приглашений пациенткам на осмотр [28, 29].
Цель исследования: сравнить эффективность и приемлемость обследования на ВПЧ-ВР при самостоятельном и врачебном заборе вагинального отделяемого у женщин разных возрастных групп.
Материалы и методы.
Данное исследование одобрено Этическим комитетом Читинской государственной медицинской академии (протокол № 64 от 23 июня 2014 г.) и согласовано с Министерством здравоохранения Забайкальского края (протокол согласования от 30 июня 2016 г.).
Для достижения поставленной цели в октябре 2016 г. выполнено кросс-секционное исследование, в которое вошли 200 сексуально активных женщин репродуктивного возраста (18–45 лет, средний возраст — 32,7 ± 6,9 года), обратившихся в поликлинику № 4 города Читы для прохождения медицинского осмотра с целью получения допуска к работе. Все женщины были проинформированы о целях и дизайне исследования, ознакомлены с инструкцией по применению устройства Qvintip (Aprovix, Швеция) и противопоказаниями.
Критериями включения в исследование явились возраст 18–45 лет, отсутствие беременности и кровянистых выделений из половых путей, информированное добровольное согласие пациентки.
Взятие материала для исследования на ВПЧ-ВР было проведено с помощью двух методов: самостоятельно женщиной из влагалища при помощи устройства Qvintip (согласно прилагаемой инструкции) и врачом из цервикального канала при помощи универсального урогенитального зонда (тип А). Материал, полученный врачом, помещали в пробирку типа «Эппендорф» с транспортной средой; материал, взятый женщиной самостоятельно, — в сухую пробирку без транспортной среды (согласно инструкции Qvintip). Образцы биологических проб маркировали по порядковым номерам забора и были полностью обезличены, т. е. не содержали персональных данных и сведений анамнеза пациенток.
Оба образца исследовали в одинаковых условиях и одним методом в лаборатории ЗАО «Сиблабсервис» г. Новосибирска (лицензия № 5401002699 от 30.05.2015 г.). Выявление и дифференциацию 12 наиболее распространенных генотипов ВПЧВР (16-го, 18-го, 31-го, 33-го, 35-го, 39-го, 45-го, 51-го, 52-го, 56-го, 58-го, 59-го) проводили методом ПЦР в режиме реального времени.
Участницы исследования были стратифицированы на три возрастные группы: 18–25 лет (молодежь, согласно определению ВОЗ) — 38 девушек, 26–35 лет (оптимальный репродуктивный период) — 88 женщин, 36–45 лет (поздний репродуктивный период) — 74 женщины.
На основании результатов обследования на ВПЧ-ВР пациентки были разделены на две клинические группы: 1я — 84 инфицированные ВПЧ-ВР, 2я — 116 ВПЧ-ВР–негативных женщин. Проведено письменное анонимное интервьюирование всех обследованных по специально составленной анкете, включающей вопросы о социальном статусе, возрасте, возрасте менархе и коитархе, паритете, методах контрацепции, вредных привычках, имеющихся гинекологических и экстрагенитальных заболеваниях и т. п. Анкеты были пронумерованы в соответствии с номером на пробирках с образцами биологических проб и полностью обезличены.
Удобство и приемлемость самостоятельного и врачебного взятия материала для ВПЧ-теста оценивали на основании письменного опроса пациенток о комфортности, болезненности, конфиденциальности, смущении при заборе вагинального отделяемого.
При статистической обработке результатов использовали пакет программ Statistica Version 10. При анализе количественных признаков определяли среднее арифметическое, дисперсию и 95%-ный ДИ. Достоверность различий между двумя средними показателями оценивали с помощью парного t-теста Стьюдента. Для проверки статистических гипотез о различиях долей и отношений в двух независимых выборках использовали критерий χ2
Значения считали статистически значимыми при χ2 > 3,84, при р ≤ 0,05. Эффективность сравниваемых методов выявления ВПЧ оценивали по ОШ, взаимосвязь фактора и заболевания — по ОР. ДИ строились для доверительной вероятности p = 95%.
Результаты и обсуждение
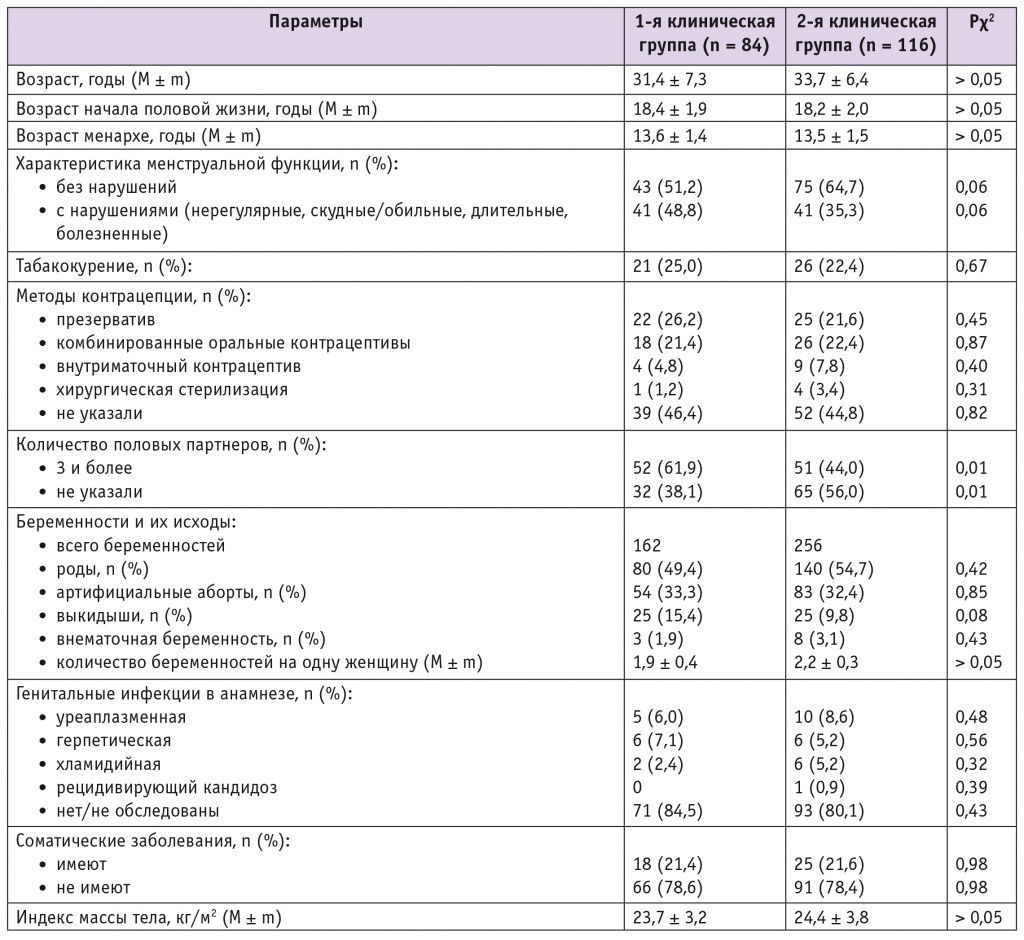
В целом в когорте обследованных женщин частота выявления ВПЧ-ВР составила 42%; отрицательный результат получен у 58%. Медико-социальная характеристика пациенток сравниваемых групп представлена в таблице 1. Средний возраст женщин был сопоставимым и составил в группе с выявленной ВПЧ-ВР инфекцией 31,4 ± 7,3 года, у неинфицированных — 33,7 ± 6,4 года (p > 0,05). В обеих группах также не выявлено статистически значимых различий в возрасте менархе и коитархе, показателях, характеризующих менструальную функцию, в численности курящих, методах контрацепции, количестве беременностей и их исходах, частоте соматических заболеваний и генитальных инфекций в анамнезе, в ИМТ.
Таблица 1
Медико-социальная характеристика пациенток сравниваемых групп
 Ранее мы показали, что значимыми факторами риска инфицирования ВПЧ женщин раннего фертильного возраста (до 35 лет) являются использование КОК в течение 5 лет и более (ОР = 15,4), хронический тонзиллит (ОР = 4,6), частые острые респираторные инфекции (ОР = 3,7), курение (ОР = 3,4), хроническая анемия и хронический пиелонефрит (ОР = 3,1), колонизация генитального тракта условно-патогенными (ОР = 4,6) и патогенными (ОР = 2,4) микроорганизмами, возраст 20–26 лет (ОР = 1,6), отказ от использования презерватива (ОР = 1,5) [30]. Результаты настоящего исследования в когорте пациенток и раннего, и позднего репродуктивного возраста (18–45 лет) подтверждают мнение других авторов, что конфаундинг-факторы высокой восприимчивости к ВПЧ-ВР меняются с возрастом [31].
Ранее мы показали, что значимыми факторами риска инфицирования ВПЧ женщин раннего фертильного возраста (до 35 лет) являются использование КОК в течение 5 лет и более (ОР = 15,4), хронический тонзиллит (ОР = 4,6), частые острые респираторные инфекции (ОР = 3,7), курение (ОР = 3,4), хроническая анемия и хронический пиелонефрит (ОР = 3,1), колонизация генитального тракта условно-патогенными (ОР = 4,6) и патогенными (ОР = 2,4) микроорганизмами, возраст 20–26 лет (ОР = 1,6), отказ от использования презерватива (ОР = 1,5) [30]. Результаты настоящего исследования в когорте пациенток и раннего, и позднего репродуктивного возраста (18–45 лет) подтверждают мнение других авторов, что конфаундинг-факторы высокой восприимчивости к ВПЧ-ВР меняются с возрастом [31].
При ранжировании участниц исследования по возрасту действительно было установлено, что в 18–25 лет удельный вес ВПЧ-положительных пациенток больше, чем ВПЧ-отрицательных: 27,4% vs 12,9% (χ = 6,61, p = 0,01) (табл. 2).
Согласно сведениям Информационного центра по ВПЧ-инфекции, удельный вес ВПЧ-позитивных пациенток в возрастной группе менее 25 лет существенно выше (около 30%), чем среди женщин старшего возраста [1].
Таблица 2
Частота и относительный риск инфицирования вирусом папилломы человека высокого онкогенного риска в зависимости от возраста, n (%)
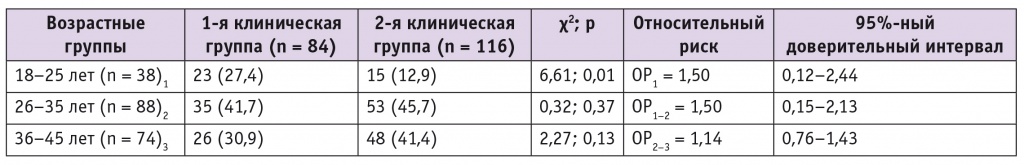 Нами не выявлено повышение риска инфицированности ВПЧ-ВР с увеличением возраста: максимальный показатель ОР был в группе пациенток 18–25 лет (ОР = 1,5; 95%-ный ДИ: 0,12–2,44), у женщин 26–35 лет он остался неизменным (ОР = 1,5; 95%-ный ДИ: 0,15–2,13), в возрастной группе 36–45 лет риск стал минимальным (ОР2–3 = 1,14; 95%-ный ДИ: 0,76–1,43) (см.табл. 2). Данные закономерности описаны другими авторами и объясняются способностью организма со временем элиминировать ВПЧ [1–3, 5, 32].
Нами не выявлено повышение риска инфицированности ВПЧ-ВР с увеличением возраста: максимальный показатель ОР был в группе пациенток 18–25 лет (ОР = 1,5; 95%-ный ДИ: 0,12–2,44), у женщин 26–35 лет он остался неизменным (ОР = 1,5; 95%-ный ДИ: 0,15–2,13), в возрастной группе 36–45 лет риск стал минимальным (ОР2–3 = 1,14; 95%-ный ДИ: 0,76–1,43) (см.табл. 2). Данные закономерности описаны другими авторами и объясняются способностью организма со временем элиминировать ВПЧ [1–3, 5, 32].
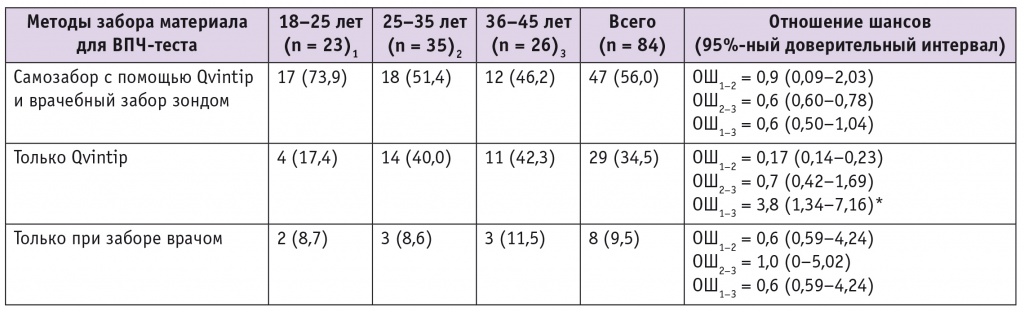
При анализе результатов ВПЧ-теста установлено, что эффективность обследования с помощью устройства Qvintip была выше, чем при заборе материала врачом: 38% vs 27,5% (ОШ = 1,6; 95%-ный ДИ: 0,48–2,45; р = 0,025). ВПЧ-ВР выявлен одновременно обоими методами у 56% (47/84) женщин, при самостоятельном взятии вагинальных выделений (Qvintip) — у 34,5% (29/84), при заборе исследователем — у 9,5% (8/84) пациенток (ОШ = 5,0; 95%-ный ДИ: 1,61–6,71; р = 0,0001) (табл. 3). Таким образом, наибольший эффект зарегистрирован при использовании устройства Qvintip: этот метод повышает шанс выявления ВПЧ-ВР в 5 раз по сравнению с забором материала врачом урогенитальным зондом.
Таблица 3
Частота выявления вируса папилломы человека (ВПЧ) высокого онкогенного риска сравниваемыми методами у пациенток разных возрастных групп, n (%)
* Р < 0,05.
В настоящее время в мире разработаны и используются различные устройства для самостоятельного взятия материала для ВПЧ-теста. В литературе имеются данные о сравнении отзывов пациенток, проводивших самозабор влагалищного секрета с использованием прибора Qvintip и щеточки Evalyn (Rovers Medical Devices), на основании которых сделан вывод: женщинам было легче понять технику взятия образца (р < 0,001) и использовать (р = 0,002) устройство Qvintip [16].
При оценке результативности сравниваемых способов во всех возрастных группах нами обнаружено очевидное преимущество идентификации ВПЧ-ВР с помощью Qvintip (см. табл. 3). При самостоятельном взятии вагинальных выделений вероятность выявления ВПЧ-ВР была наибольшей в группе женщин 36–45 лет по сравнению с девушками 18–25 лет (ОШ = 3,8; 95%-ный ДИ: 1,34–7,16).
ОШ показателя выявления ВПЧ-ВР при использовании прибора Qvintip в сравнении с забором материала урогенитальным зондом было максимальным в группе женщин 26–35 лет — 7,1 (1,96–9,04), в младшей и старшей возрастных группах он оказался несколько меньше: 18–25 лет — ОШ = 2,2 (0,79–7,07); 36–45 лет — ОШ = 5,6 (1,73–8,59). ОШ для всех 84 ВПЧ-позитивных женщин составило 5,0 (1,61–6,71).
Известно, что 16-й и 18-й типы ВПЧ отвечают примерно за 70% всех случаев цервикального рака во всем мире, 41–67% случаев HSIL, 16–32% low grade SIL. Еще около 20% случаев РШМ ассоциированы с типами ВПЧ-31, -33, -35, -45, -52 и -58 [1]. Согласно полученным нами данным, распространенность ВПЧ 16-го типа была наибольшей (17,7%) (рис. 1).
Рис. 1. Частота идентификации типов вируса папилломы человека (ВПЧ) высокого онкогенного риска
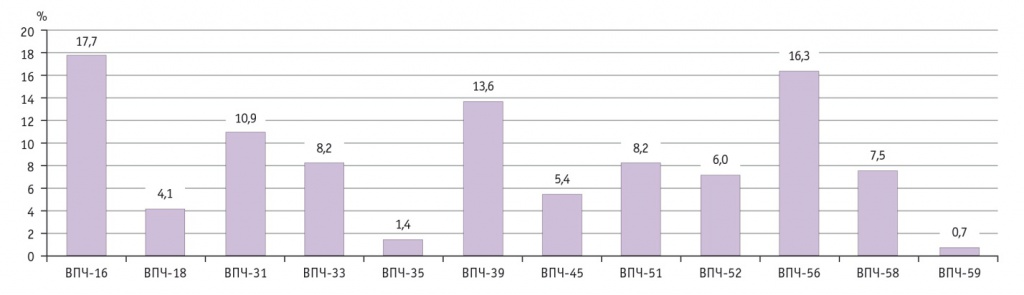 Эпидемиологические исследования, проведенные в различных странах и их регионах, показали, что спектр генотипов ВПЧ имеет географические особенности, поэтому условно выделяют «европейские» (16-й, 18-й, 31-й, 33-й, 45-й и др.) и «азиатские» типы ВПЧ (52-й, 58-й, 59-й, 65-й и др.) [1, 5]. У обследованных нами жительниц Забайкальского края ДНК ВПЧ 16-го типа идентифицирована с наибольшей частотой (17,7%), ДНК ВПЧ 18-го типа обнаружена в 4,3 раза реже (4,1%). Исследования, проведенные в других субъектах Сибирского федерального округа, выявили аналогичные закономерности: в Республике Тыва (РТ), Кемеровской (КО) и Томской (ТО) областях частота выявления ВПЧ-16-позитивных образцов существенно превышала число таковых с генотипом ВПЧ-18 [26, 33]. Однако в целом количество пациенток с ВПЧ-16 в Забайкальском крае (ЗК) было существенно ниже, чем в сравниваемых с ним трех других регионах Сибирского федерального округа: ЗК — 17,7%; РТ — 59,1% (p < 0,001); КО — 43,6% (p < 0,001); ТО — 53,9% (p < 0,001) [26, 33].
Эпидемиологические исследования, проведенные в различных странах и их регионах, показали, что спектр генотипов ВПЧ имеет географические особенности, поэтому условно выделяют «европейские» (16-й, 18-й, 31-й, 33-й, 45-й и др.) и «азиатские» типы ВПЧ (52-й, 58-й, 59-й, 65-й и др.) [1, 5]. У обследованных нами жительниц Забайкальского края ДНК ВПЧ 16-го типа идентифицирована с наибольшей частотой (17,7%), ДНК ВПЧ 18-го типа обнаружена в 4,3 раза реже (4,1%). Исследования, проведенные в других субъектах Сибирского федерального округа, выявили аналогичные закономерности: в Республике Тыва (РТ), Кемеровской (КО) и Томской (ТО) областях частота выявления ВПЧ-16-позитивных образцов существенно превышала число таковых с генотипом ВПЧ-18 [26, 33]. Однако в целом количество пациенток с ВПЧ-16 в Забайкальском крае (ЗК) было существенно ниже, чем в сравниваемых с ним трех других регионах Сибирского федерального округа: ЗК — 17,7%; РТ — 59,1% (p < 0,001); КО — 43,6% (p < 0,001); ТО — 53,9% (p < 0,001) [26, 33].
ВПЧ в виде моноинфекции выявлен у 48,8% пациенток. У 51,2% ВПЧ-позитивных женщин обнаружены несколько типов ВПЧВР: два — у 34,5%, три — у 9,5%, четыре — у 6,0%, пять — у 1,2%. ВПЧ-16 сочетался с ВПЧ-18 в 3,6% наблюдений и чаще, чем ВПЧ-18, идентифицировался в комбинации с другими генотипами (31-м, 33-м, 45-м, 52м, 58-м): 15,5% vs 3,6%, χ2 = 6,91; p = 0,009.
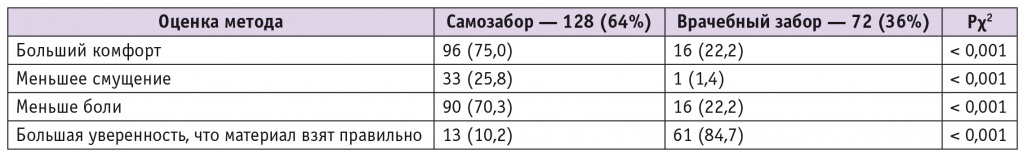
Второй задачей исследования было изучить удобство и приемлемость двух сравниваемых методов взятия материала для ВПЧ-теста по данным анкетного опроса пациенток.
В целом 64% пациенток отдали предпочтение методу самозабора материала для ВПЧ-теста, количество женщин, предпочитающих врачебное взятие образцов, было значительно меньше — 36% (p < 0,001) (табл. 4). Основными причинами, по которым пациентки выбрали метод самостоятельного приготовления образца, были ощущение большего комфорта (75,0% vs 22,2%, р < 0,001), меньшей болезненности (70,3% vs 22,2%, р < 0,001) и меньшего смущения (25,8% vs 1,4%, р < 0,001). Единственной причиной предпочтения взятия образца ДНК ВПЧ врачом является бóльшая уверенность, что материал взят правильно (10,1% vs 84,7%, р < 0,001). В будущем подавляющее большинство участниц исследования (96% vs 4%, p < 0,001) выберут самостоятельный забор материала для ВПЧ-теста, поскольку это просто и не требует визита к врачу.
Таблица 4
Оценка взятия материала для ВПЧ-теста: самостоятельный забор vs забор врачом, n (%)
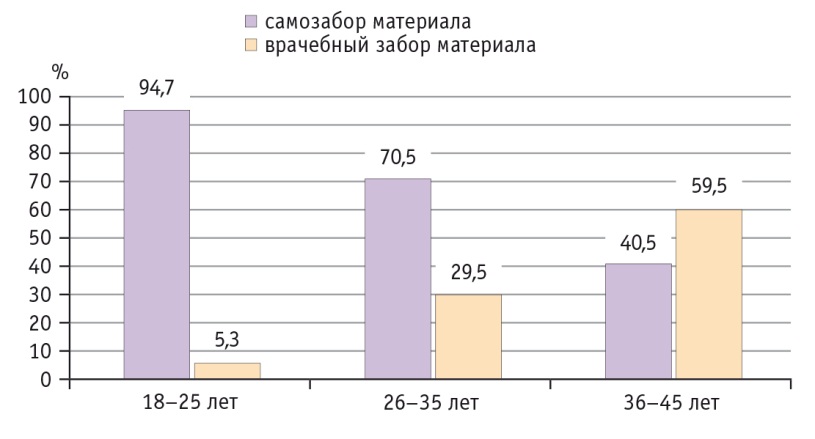
Следует отметить, что большинство пациенток, предпочитавших самостоятельное взятие материла для ВПЧ-теста, были в возрасте 18–25 лет — 94,7%, в группе женщин 26–35 лет их количество значительно снизилось и составило 70,5% (χ21–2= 9,05, p = 0,003), а пациентки позднего репродуктивного периода (36–45 лет) продемонстрировали наименьшую приверженность методу самозабора — 40,5% (χ22–3= 11,66, p = 0,0001). Данный факт объясняется тем, что женщины старшего возраста чаще опасались, что при самостоятельном взятии вагинальных выделений материал будет приготовлен неправильно (рис. 2). Наши данные полностью совпадают с результатами, полученными Y. Deleré и соавт. (2011), что самозабор материала для ВПЧ-теста — надежный способ определить распространенность ВПЧ-ВР и хорошо воспринимается женщинами в возрасте 20–30 лет [14].
Рис. 2. Предпочтения пациенток разных возрастных групп в выборе метода забора материала для ВПЧ-теста (n = 200).
Примечание: различия между всеми группами достоверны для метода самозабора материала для ВПЧ-теста (р < 0,05) и для врачебного взятия материала для ВПЧ-теста (р < 0,05)
В ряде исследований, проведенных в разных странах мира, также выявлена высокая комплаентность женщин к методу самостоятельного взятия образца для ВПЧ-теста. Так, в Испании в 2012 г. 68% женщин в будущем предпочтут самостоятельное взятие образцов дома, если врач даст им тест, а 71% выразили готовность произвести самозабор дома, если тест будет направлен им по почте. Основными причинами предпочтения метода самозабора были меньшее чувство смущения (27,3% vs 1,5%, p < 0,001) и больший комфорт (72,7% vs 20,9%, p < 0,001) [34]. В Швеции количество женщин, отдавших предпочтение самостоятельному взятию вагинальных выделений для ВПЧ-теста, было в три раза больше, чем женщин, пришедших для осмотра специалистом. По данным анкетного опроса, ведущей причиной обоснования такого выбора были неприятные ощущения, связанные с гинекологическим осмотром [35]. В исследовании F. Sultana и соавт. (2017) 88% пациенток предпочтут самостоятельный забор материала для ВПЧ-теста дома в будущем, потому что этот метод прост, не требует визита к врачу и не связан с эмоциональными переживаниями [19]. По данным H. H. Chou и соавт. (2015), большинство женщин, прошедших самотестирование, отмечают простоту и удобство метода (90,8%) и порекомендуют пройти этот вид обследования своим знакомым (88,3%) [36].
Заключение
Выявленная широкая распространенность ВПЧ высокого онкогенного риска (ВПЧ-ВР) у женщин репродуктивного возраста (42%) в сочетании с высокими показателями заболеваемости раком шейки матки (РШМ) в Забайкальском крае (2015 год — 485,1; РФ — 222,7 на 100 000 женского населения [37]) служат основанием для активизации работы по профилактике РШМ в регионе и оптимизации программ цервикального скрининга населения. Использование устройства Qvintip для самостоятельного взятия вагинальных выделений повышает ОШ выявления ВПЧ-ВР в генитальном тракте в 1,6 раза в сравнении с забором материала врачом (38,0% vs 27,5%). ВПЧ-тест в 3,6 раза чаще был положительным при самозаборе материала с помощью прибора Qvintip, чем при приготовлении образца врачом с использованием урогенитального зонда (34,5% vs 9,5%). Большинство пациенток отметили простоту использования, больший комфорт, безболезненность и приватность самозабора. Наибольшую приверженность к самостоятельному взятию материла для ВПЧ-теста проявили девушки в возрасте 18–25 лет (94,7%).
Таким образом, устройство Qvintip для самостоятельного взятия образца ДНК ВПЧ обеспечивает высокую диагностическую эффективность, является простым и удобным и может быть рекомендовано к использованию при выявлении ВПЧ-ВР с целью увеличения численности женщин, участвующих в программах скрининга на РШМ.
Авторы выражают благодарность министру здравоохранения Забайкальского края, доктору медицинских наук Давыдову Сергею Олеговичу, главному врачу Городской поликлиники № 4 города Читы Карповой Светлане Валерьевне, заместителю главного врача Городской поликлиники № 4 Веселкову Александру Викторовичу за содействие в организации исследования; членам Молодежного научного общества Читинской государственной медицинской академии Самбуевой Наталье Борисовне, Шемякиной Ксении Николаевне и Мальцевой Екатерине Евгеньевне за участие в статистической обработке материала.








