Проблема раннего сосудистого старения рассматривается сегодня как ключевая в формировании неблагоприятного прогностического профиля у пациентов с метаболическим синдромом. Процесс старения сосудов является физиологическим, но при наличии факторов риска сердечно-сосудистых заболеваний (АГ, ожирения, дислипидемии, гипергликемии, курения и др.) в стенке сосуда преждевременно развиваются структурные и функциональные изменения, не характерные для биологического возраста.
В настоящее время сосудистое старение связывают прежде всего со снижением сосудистой эластичности [6, 9, 12, 13].
Накопленные за последние десятилетия данные показали, что сосудистая жесткость и повышение скорости распространения пульсовой волны имеют высокую прогностическую значимость в отношении риска развития сердечно-сосудистых осложнений [12]. Сегодня связь сосудистой жесткости с АГ, а также с другими факторами риска, включая ожирение, считается доказанной [1, 4, 5, 7]. Вместе с тем получены данные о том, что зачастую снижение периферического АД не сопровождается улучшением эластичности крупных амортизирующих сосудов [2] и, более того, при одинаковом уровне АД лучшая выживаемость пациентов наблюдается только в случае восстановления сосудистой эластичности [14]. Этот факт объясняют сведения о том, что повышение центрального систолического АД (САД) эквивалентно увеличению возраста на 10 лет [9].
В связи с этим представляется актуальной проблема выбора оптимальной антигипертензивной терапии у пациентов с АГ и избыточной массой тела, способной предупреждать раннее сосудистое старение и в максимальной степени улучшать сосудистую эластичность.
Препараты, подавляющие активность ренин-ангиотензиновой системы, являются терапией выбора у пациентов с АГ и метаболическим синдромом [11], однако их ангиопротективная эффективность существенно различается даже внутри одной группы лекарственных средств [2, 15].
Цель исследования: сравнить ингибиторы АПФ (иАПФ) периндоприл и эналаприл для оценки их возможностей в предупреждении раннего сосудистого старения.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на кафедре терапии и эндокринологии факультета усовершенствования врачей Волгоградского государственного медицинского университета на базе ГКУЗ «Волгоградская областная клиническая больница № 3» в период с января по июнь 2016 г. Дизайн простого слепого рандомизированного сравнительного исследования в параллельных группах представлен на рисунке. В две параллельные группы были включены 60 пациентов (31 мужчина, 29 женщин) с АГ и избыточной массой тела или ожирением (ИМТ ≥ 27 кг/м2) в возрасте от 37,7 до 56,1 года. Рандомизация на группы осуществлялась методом конвертов: на протяжении 24 недель пациенты 1-й группы (n = 30) принимали периндоприл (препарат Престариум А производства компании «Лаборатории Сервье», Франция) в суточной дозе 10 мг, больные 2-й группы (n = 30) — эналаприл (Ренитек, «Мерк Шарп и Доум Б.В.», Нидерланды) в суточной дозе 20 мг.
Рис. Дизайн исследования: сравнение эффективности периндоприла и эналаприла в предупреждении раннего сосудистого старения
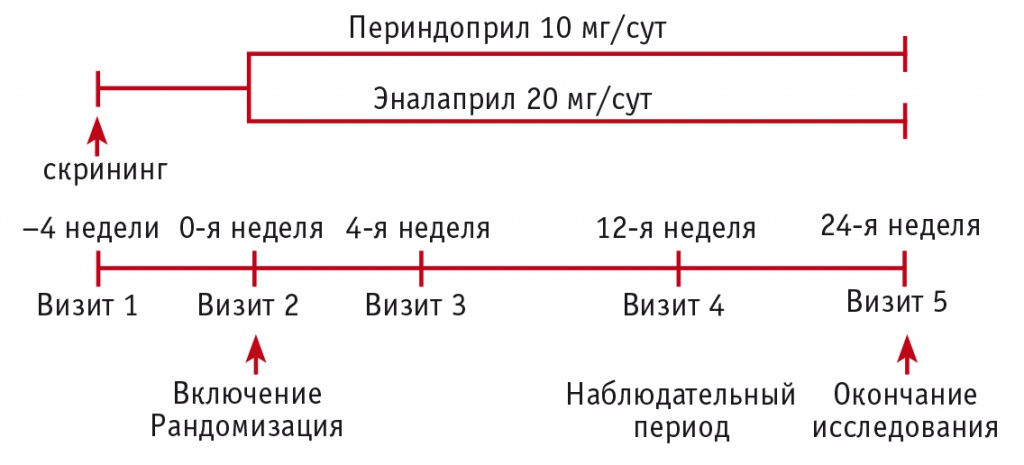
Согласно критериям включения, у участников должно было быть САД, определенное методом Короткова в положении пациента сидя, ≥ 140 мм рт. ст. и < 160 мм рт. ст. и/или диастолическое АД (ДАД) ≥ 90 мм рт. ст. и < 100 мм рт. ст. Допускалось включение в исследование больных, не принимавших гипотензивные препараты в течение как минимум двух недель до визита скрининга. В каждой группе пациентам были рекомендованы изменение образа жизни и снижение массы тела (диета, повышение физической активности). Препараты для уменьшения веса ни в одной из групп не использовались. Все участники до включения в исследование подписывали информированное согласие, а сам протокол исследования был одобрен локальным этическим комитетом.
Всем пациентам исходно и после курсовой терапии проводились суточное мониторирование АД (СМАД), исследование сосудистой эластичности, лабораторное обследование и расчет сосудистого возраста с помощью модифицированных шкал Systematic Coronary Risk Evaluation (SCORE).
СМАД производили на аппарате SpaceLabs 90207 (США). В дневные часы (7:00–23:00) АД измеряли каждые 15 мин, в ночные часы (23:00–7:00) — каждые 30 мин. Использовалась специальная манжета для измерения АД у тучных пациентов.
Скорость пульсовой волны (СПВ) определяли с помощью компьютеризированного устройства Colson (протокол исследования и оборудование, аналогичное таковому в исследовании Complior), которое автоматически рассчитывает СПВ. Индекс аугментации и центральное давление в аорте оценивали с помощью прибора Sphygmocor (AtCor, Австралия).
Содержание высокочувствительного СРБ (вчСРБ) измеряли усиленным латексными частицами иммунотурбидиметрическим методом (высокочувствительный метод), уровень гомоцистеина в сыворотке — методом ИФА с использованием наборов «Гомоцистеин» фирмы Axis-Shield (Шотландия), адипоцитокинов в сыворотке — методом ИФА с применением стандартных наборов фирмы DSL (США) для лептина и BCM Diagnostics (США) для адипонектина.
Для определения количества жировых отложений использовался жироанализатор OMRON BF-306 (Япония).
Расчет сосудистого возраста осуществлялся с помощью модифицированных шкал SCORE для стран с высоким абсолютным риском сердечно-сосудистых заболеваний [3]. Сосудистый возраст исходно и после 24-недельной терапии рассчитывался с учетом следующих параметров: возраст, пол, САД, уровень общего холестерина, статус курения. Сначала рассчитывался абсолютный сердечно-сосудистый риск в процентах для каждого пациента с использованием стандартных шкал SCORE, затем рассчитанный риск в процентах сопоставлялся с сосудистым возрастом из модифицированных шкал SCORE.
Статистическую обработку результатов исследования проводили с использованием пакета статистических программ BMDP. Непрерывные количественные исходные и демографические признаки были протестированы простым t-критерием для независимых выборок. В случае распределения значений признака, отличного от нормального, был использован критерий Манна — Уитни. Для качественных признаков применяли либо точный критерий Фишера, либо тест χ2, в зависимости от количества наблюдений в каждой ячейке таблицы сопряженности.
Данные представлены в виде M ± m, где М — среднее, m — стандартная ошибка. Для выявления достоверности изменений до и после лечения использовали парный t-критерий Стьюдента. Статистически значимыми считали различия при значении р < 0,05.
РЕЗУЛЬТАТЫ
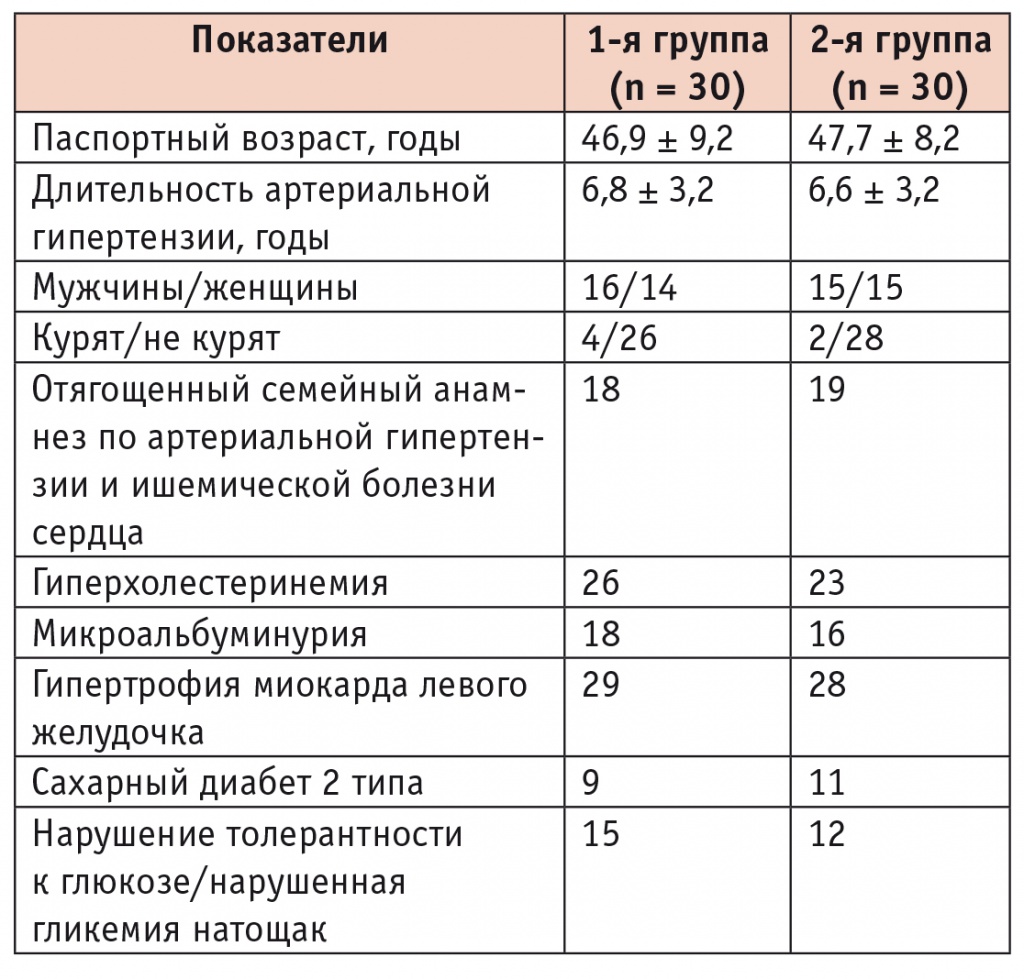
Клинико-демографические характеристики пациентов, включенных в исследование, представлены в таблице 1. Как видно из представленных данных, по основным показателям сравниваемые группы статистически значимо не различались.
Таблица 1
Клинико-демографическая характеристика сравниваемых групп
В таблице 2 представлена динамика изменений САД и ДАД по данным СМАД при различных вариантах лечения.
Таблица 2
Динамика показателей суточного мониторирования артериального давления при терапии периндоприлом и эналаприлом, исходно/через 24 недели (мм рт. ст.)

Примечания.
1. ДАД — диастолическое артериальное давление, САД — систолическое артериальное давление, ЧСС — частота сердечных сокращений, СУП — скорость утреннего подъема.
2. Здесь и в таблицах далее знаком (*) отмечены статистически значимые отличия: (*) — от исходного показателя (р < 0,05); (**) — от 2-й группы (р < 0,05).
Оказалось, что периндоприл эффективнее снижал суточное, дневное и ночное САД и ДАД, чем эналаприл. Так, снижение суточного САД и ДАД на периндоприле составляло 15,2% и 18,0% против 7,3% и 12,6% на эналаприле, дневного — соответственно 18,0% и 15,3% против 10,4% и 5,2%, ночного — соответственно 6,9% и 6,3% против 4,9% и 2,4% (отличие от группы эналаприла во всех случаях статистически значимо, p < 0,05). По данным СМАД, на фоне терапии периндоприлом во все исследуемые промежутки времени отмечено статистически значимое уменьшение ЧСС по сравнению с исходным значением, которое было более выражено, чем при терапии эналаприлом. Кроме этого, периндоприл статистически значимо сильнее уменьшал скорость утреннего подъема САД и ДАД по сравнению с эналаприлом.
В таблице 3 представлена динамика биохимических показателей у обследованных больных.
Таблица 3
Динамика биохимических показателей крови при терапии периндоприлом и эналаприлом, исходно/через 24 недели
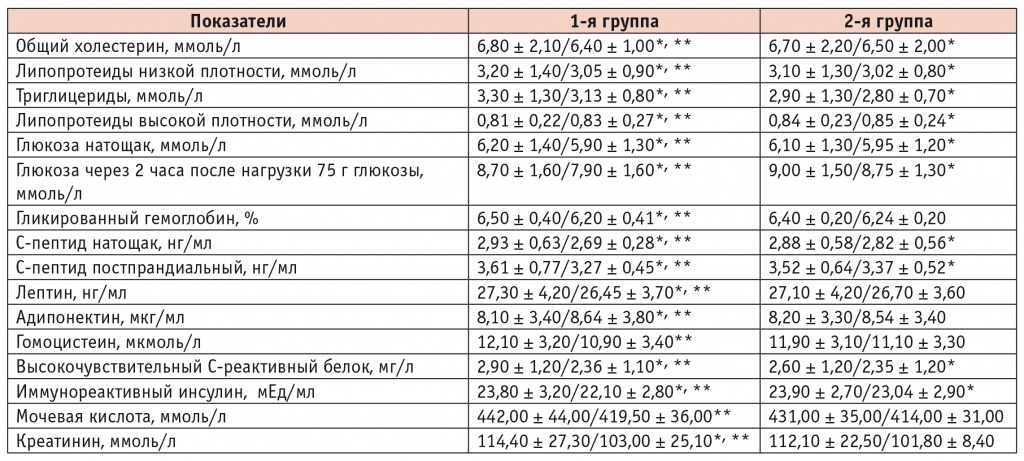
Существенные различия между препаратами были выявлены по влиянию на показатели липидного, углеводного и пуринового обмена. При терапии периндоприлом имело место значимо более выраженное снижение содержания общего холестерина — на 5,9% против 3,0% на эналаприле; ЛПНП — на 4,7% против 2,6%; триглицеридов — на 5,1% против 3,5% (отличие от группы эналаприла во всех случаях статистически значимо, p < 0,05) на фоне повышения концентрации ЛПВП на 2,5% (1,2% на эналаприле, p < 0,05). В группе периндоприла уровень мочевой кислоты уменьшился на 5,1% против 3,9% в группе эналаприла, а уровень креатинина — на 10,0% против 9,2% на эналаприле (для обоих показателей p < 0,05).
Проводимая терапия приводила к различному снижению содержания глюкозы натощак и через 2 часа после нагрузки 75 г глюкозы — на 4,8% и 9,2% на периндоприле против 2,5% и 2,8% на эналаприле; гликированного гемоглобина — на 4,6% против 2,5%; С-пептида натощак и постпрандиального — соответственно на 8,2% и 9,4% против 2,1% и 4,3%; иммунореактивного инсулина — на 7,1% против 3,6% (отличие от группы эналаприла во всех случаях статистически значимо, p < 0,05). Принципиально важным для пациентов с АГ и ожирением является выявленное уменьшение уровня лептина крови на 3,1% (1,5% при применении эналаприла, p < 0,05) и повышение концентрации адипонектина на 6,7% (4,2% на эналаприле, p < 0,05).
В таблице 4 показаны изменения ИМТ, отношения объема талии к объему бедер (ОТ/ОБ) и процента жировых отложений при различных вариантах лечения.
Таблица 4
Динамика антропометрических показателей при терапии периндоприлом и эналаприлом, исходно/через 24 недели

При терапии периндоприлом ИМТ снизился на 6,4% против 2,6% в группе эналаприла, ОТ/ОБ — на 8,1% против 5,1%, а процент жировых отложений — на 7,8% против 3,2% (во всех случаях p < 0,05).
В таблице 5 представлена динамика сосудистого возраста, рассчитанного с помощью модифицированных шкал SCORE для стран с высоким абсолютном сердечно-сосудистым риском в начале исследования и через 24 недели после терапии иАПФ, а также изменения, характеризующие состояние сосудов эластичного, мышечного типа и амортизирующих сосудов.
Таблица 5
Изменение сосудистого возраста, эластичности различных сосудов при терапии периндоприлом и эналаприлом, исходно/через 24 недели
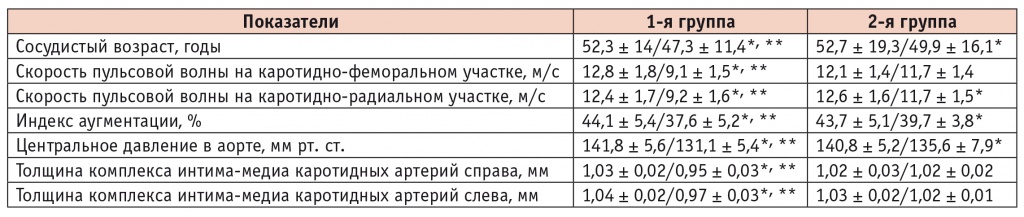
Сосудистый возраст при использовании периндоприла в течение 24 недель уменьшился больше, чем при приеме эналаприла: на 5 лет против 2,8 года. Примечательно, что исходный сосудистый возраст был в среднем на 5,4 года больше паспортного в 1-й группе и на 5,0 лет больше во 2-й.
Максимальное улучшение эластичности сосудов мышечного и эластичного типов было отмечено при терапии периндоприлом, который снижал СПВ на каротидно-феморальном участке на 28,9% и на каротидно-радиальном на 25,8% против 3,3% и 7,1% при лечении эналаприлом (для обоих показателей p < 0,05). Еще более выраженные различия наблюдались по влиянию препаратов на индекс аугментации и центральное давление в аорте, которые уменьшились на фоне терапии периндоприлом соответственно на 14,7% и 7,5%, эналаприлом — на 9,2% и 3,7% (для обоих показателей p < 0,05). Периндоприл также оказывал более значительное положительное воздействие на комплекс толщины интима-медиа каротидных артерий по сравнению с эналаприлом.
Важно отметить, что лучшее воздействие периндоприла на сосудистую эластичность сочеталось с уменьшением уровня гомоцистеина на 9,9% (6,7% при терапии эналаприлом, p < 0,05) и вчСРБ на 18,6% (9,6% на эналаприле, p < 0,05).
ОБСУЖДЕНИЕ
Полученные данные о большей эффективности периндоприла по сравнению с эналаприлом в предупреждении раннего сосудистого старения подтверждены более выраженным положительным его влиянием практически на все показатели эластичности амортизирующих и резистивных сосудов. Кроме этого, обращает на себя внимание более значительная положительная динамика уровней гомоцистеина и вчСРБ в группе периндоприла, что свидетельствует об уменьшении неинфекционного воспаления.
По-видимому, благоприятное влияние периндоприла на сосудистый возраст, эластичность и воспаление обусловлено положительным действием препарата на показатели липидного обмена, инсулинорезистентность и лептинорезистентность. Отдельно следует обратить внимание на повышение уровня адипонектина при терапии периндоприлом, что важно с позиции улучшения жирового обмена и служит дополнительным фактором ангиопротекции [8]. Хотелось бы отметить, что сходные данные о различном влиянии периндоприла и эналаприла на указанные выше показатели были получены и другими авторами [10].
Очевидно, что именно дополнительные свойства периндоприла предопределяют его высокую эффективность в предупреждении раннего сосудистого старения.
Какова же причина выраженного внутриклассового различия между двумя иАПФ — периндоприлом и эналаприлом? На наш взгляд, это бóльшая продолжительность антигипертензивного эффекта, лучшее влияние на вариабельность АД и максимальная среди всех иАПФ липофильность, которая обеспечивает в наибольшей степени подавление гиперактивации ренин-ангиотензиновой системы, повышенной продукции проатерогенных адипокинов и воспаления, которые обусловлены избытком жировой ткани и гипертрофией адипоцитов.
ЗАКЛЮЧЕНИЕ
Проведенное исследование подтверждает, что именно периндоприл лучше подходит для предупреждения раннего сосудистого старения у пациентов с АГ и избыточной массой тела.








