Фибрилляция предсердий (ФП) — распространенное в популяции нежизнеугрожающее нарушение ритма, особенную сложность для практикующих врачей ФП вызывает при ее сочетании с ИБС и при выполнении у этих пациентов эндоваскулярных коронарных вмешательств.
В данной статье проведено сравнение действующих американских и европейских рекомендательных документов и представлен обзор современных подходов к назначению антитромботических препаратов больным с ФП, подвергающимся чрескожным коронарным вмешательствам (ЧКВ).
Пациент, подвергающийся ЧКВ, нередко имеет показания для длительной антикоагулянтной терапии. Самая распространенная причина этого — ФП[1, 2]. Доказано, что частота сочетания различных форм ИБС с ФП значительно увеличивается с возрастом[3, 4]. В целом указываемая в исследованиях распространенность ИБС у больных с ФП может варьировать от 17% до 50%[5, 6], а у пациентов старческого возраста — до 82%.
ЧКВ для лиц с ИБС — часто используемый метод реваскуляризации миокарда как при стабильной, так и при острых формах заболевания[7, 8]. В среднем у 21% пациентов с ИБС выявляется ФП; до 15% больных ФП подвергаются ЧКВ с применением стентов[9].
Вместе с тем результаты коронарных вмешательств у пациентов с ФП хуже, чем у больных без ФП. В американском регистре ЧКВ (2002–2011), где анализировались показатели летальных исходов у более 3 млн пациентов, определено, что смертность больных с ФП в 2 раза выше, чем пациентов без данной аритмии[10]. Одним из объяснений этому феномену может быть более высокая частота сердечно-сосудистой коморбидности у лиц с ФП[11, 12].
У больных ФП высок риск развития тромбоэмболических осложнений (ТЭО), в т. ч. эмболического инсульта. Вероятность ТЭО возрастает пропорционально увеличению тяжести сердечно-сосудистой и соматической коморбидности. Так, в реальной клинической практике у большинства пациентов с ФП определяется высокий балл по шкале CHA2DS2-VASc, являющийся отражением их соматической коморбидности (до 86,1% пациентов в наблюдательной программе GLORIA-AF; 96,3% пациентов регистра РЕКУР-ФП)[11, 13].
Высокий риск ТЭО, прежде всего эмболического инсульта, у пациентов с ФП обусловливает потребность в неопределенно долгом (пожизненном) назначении оральных антикоагулянтов (ОАК) с целью первичной профилактики ТЭО при ФП.
С другой стороны, факт проведения ЧКВ диктует необходимость двойной антитромбоцитарной терапии (ДАТ), состоящей из ацетилсалициловой кислоты (АСК) и ингибитора P2Y12 рецепторов тромбоцитов, с целью профилактики тромбоза стента. Такую терапию пациент вынужден получать в течение 1–12 месяцев после проведения ЧКВ (в зависимости от риска кровотечений и экстренности выполнения ЧКВ), а после окончания приема ДАТ к 12-му месяцу — даже до 36 месяцев в зависимости от клинической ситуации, а также с учетом соотношения риска ишемических и геморрагических событий[14].
У пациентов с ОКС без ФП вместе с АСК в составе ДАТ обычно используют «новые» дезагреганты (празугрел, тикагрелор) или, если их невозможно назначить в силу тех или иных причин, клопидогрел. При стабильной ИБС у большинства пациентов используется клопидогрел[15].
Следует отметить, что попытки снизить риск ТЭО при ФП с помощью только монотерапии АСК или ДАТ (АСК + клопидогрел) и заменить ими ОАК для профилактики ТЭО не увенчались успехом[16–18]. И применение только одних ОАК для снижения риска коронарных атеротромботических осложнений, в том числе тромбоза стентов, у пациентов с ОКС и/или при стентировании коронарных артерий на фоне хронической ИБС считается недостаточным. По-видимому, это связано с патофизиологическими различиями механизмов образования тромба внутри коронарных артерий и в полостях сердца при ФП[19, 20].
Турбулентность и замедление локального кровотока, а также активация различных факторов свертывания крови играют определяющую роль в тромбообразовании при ФП, в то время как при образовании тромба внутри коронарного стента решающее значение имеют повреждение эндотелия и активация тромбоцитов. Это постулирует необходимость применения различных классов лекарственных препаратов для снижения риска ТЭО при ФП и риска тромбоза стента.
Поэтому пациенту с ФП, который подвергается ЧКВ, необходима тройная антитромботическая терапия (АТТ) — сочетание ОАК с дезагрегантами. Однако тройная АТТ, особенно при длительном использовании, очень серьезно увеличивает риск массивных, в том числе жизнеугрожающих, кровотечений[21].
Имеются убедительные данные ряда исследований, показавшие значительный рост риска кровотечений на фоне увеличения агрессивности АТТ[22, 23]. Более того, в последние годы появились доказательства того, что эффекты массивных кровотечений сопоставимы с последствиями ишемических событий по степени влияния на показатели общей смертности пациентов[24–26].
Вследствие этого доказанное повышение риска кровотечений на фоне тройной АТТ явилось причиной поиска оптимальных схем медикаментозной терапии для управления риском тромботических осложнений, а также повышения геморрагической безопасности АТТ. Важным шагом к обеспечению большей безопасности АТТ стало внедрение в клиническую практику новых антикоагулянтов — прямых ОАК (ПОАК), не антагонистов витамина К: апиксабана, дабигатрана, ривароксабана, эдоксабана[27]. Еще один способ повысить безопасность АТТ — сокращение времени приема тройной АТТ за счет отмены в ближайшем периоде после ЧКВ одного из компонентов ДАТ — АСК[27].
Данные клинических исследований, сравнивающих эффективность и безопасность двойной и тройной АТТ, а также их продолжительность, использованы для формирования действующих клинических рекомендаций, касающихся ведения пациентов с ФП, включая обновленные рекомендации по ФП American Heart Association/American College of Cardiology (2019)[28], европейские рекомендации по реваскуляризации миокарда[29] и консенсус European Society of Cardiology по ДАТ[15].
Какие же важные вопросы необходимо решить практикующему врачу для оптимального выбора максимально эффективной и безопасной АТТ у больных с ФП, которым проведена ЧКВ?
Во-первых, следует оценить необходимость приема антикоагулянтных препаратов для профилактики ТЭО у пациентов с ФП. Напомним, что необходимость длительного приема ОАК определяется исходным риском в баллах шкалы CHA2DS2-VASc[28]. Абсолютным показанием для применения ОАК является наличие у мужчин 2 и более баллов, а у женщин — 3 и более баллов шкалы CHA2DS2-VASc[29]. Проявления ИБС у пациента с ФП — фактор риска ТЭО, они учитываются в шкале как 1 балл[30]. Мужчина с ИБС характеризуется одним баллом по шкале CHA2DS2-VASc, а женщина — двумя баллами (ИБС + вклад гендерного фактора). С учетом других возможных факторов риска ТЭО вне зависимости от пола выполнение у больного с ФП ЧКВ является поводом для неопределенно долгого приема ОАК.
При этом американские специалисты достаточно категоричны при формулировке назначения ОАК мужчинам с одним баллом и женщинам с двумя баллами по шкале CHA2DS2-VASc — «прием ОАК может быть рассмотрен»[28]. Европейские эксперты в рекомендациях по ФП 2016 г. обозначают эту позицию как «следует рассмотреть индивидуально с учетом характеристик и предпочтений»[30].
Итак, проявления ИБС и высокая частота сердечно-сосудистой коморбидности (АГ, ХСН, СД)[11–13] определяют необходимость назначения антикоагулянтов пациентам с ФП, подвергаемым ЧКВ, практически в 100% случаев. Это подтверждают и результаты российских исследований. Так, в работе Е.Н. Кривошеевой и соавт. показано, что медиана совокупности баллов по шкале CHA2DS2-VASc у пациентов с ФП и ЧКВ составила 5, при этом у всех больных имели место абсолютные показания для применения ОАК[31].
Второй вопрос состоит в выборе конкретного лекарственного препарата из группы ОАК для АТТ. Внедрение в клиническую практику ПОАК стало настоящим прорывом в лечении пациентов, которым требуется длительная антикоагулянтная терапия. Ряд крупных многоцентровых рандомизированных клинических исследований доказал по меньшей мере сопоставимую эффективность ПОАК и варфарина в профилактике ТЭО, а также более высокую безопасность ПОАК в отношении тяжелых геморрагических осложнений у больных ФП, чем у варфарина[32–35].
Метаанализ клинических исследований, ставивших своей целью сравнить эффективность и безопасность использования антагонистов витамина К (АВК) и ПОАК у больных ФП (всего 12 исследований, включающих 17 011 пациентов), показал значительное снижение риска больших кровотечений (ОШ = 0,76; 95%-ный ДИ: 0,62–0,93) и геморрагического инсульта (ОШ = 0,48; 95%-ный ДИ: 0,40–0,57), а также общей смертности (ОШ = 0,86; 95%-ный ДИ: 0,82–0,91) на фоне приема ПОАК по сравнению с таковым при приеме АВК[36]. Более низкая частота больших кровотечений при использовании ПОАК, чем при применении АВК, рассматривается как один из механизмов уменьшения смертности при назначении препаратов данной группы[37].
Приведенные факты послужили основой современных американских и европейских рекомендаций[28, 29]: «При отсутствии противопоказаний ПОАК следует предпочесть назначению АВК из-за более низкого риска кровотечений», что ранее было определено как класс-эффект всей группы ПОАК[38].
Для каждого из применяемых в настоящее время ПОАК в последние годы проведены исследования, доказавшие целесообразность назначения ПОАК пациентам с ФП, подвергаемым ЧКВ. Крупные клинические протоколы PIONEER-AF PCI[39] и RE-DUAL PCI[40] представили явные преимущества сочетания ПОАК с антиагрегантами (ривароксабана, дабигатрана) перед с АВК с антиагрегантами[41]. В крупном клиническом исследовании AUGUSTUS[42] подтверждена более высокая безопасность апиксабана, чем варфарина, которая определяется меньшей частотой больших кровотечений у пациентов с ИБС и ФП.
С другой стороны, в исследовании ENTRUST-AF PCI с эдоксабаном не найдено его геморрагическое преимущество перед варфарином для больных с ФП после ЧКВ: тенденция к меньшей частоте кровотечений всех видов выявлялась только к 90-му дню приема АТТ и не достигла статистической значимости[43].
Следует отметить, что использование АВК в составе тройной АТТ всегда более проблемно с практической точки зрения, поскольку требует тщательной титрации препарата для достижения целевого МНО (для примера, достаточно сложно добиться нахождения МНО в интервале 2,0–2,5)[44]. В протоколе AUGUSTUS МНО было ниже 2,0 всего 23% времени[42].
Таким образом, если пациент с ФП и выявленными проявлениями ИБС (ОКС и/или проведение ЧКВ) уже принимает АВК, то вполне понятным и обоснованным будет его перевод на ПОАК с целью снижения риска геморрагических осложнений при сочетанном приеме с антиагрегантами. АВК сохраняют свою монополию в качестве ОАК у пациентов с ФП на фоне клапанных пороков (в частности, среднего и тяжелого митрального стеноза и/или протезирования механическими протезами клапанов сердца).
Использование АВК рассматривается и у больных с ФП и терминальной стадией почечной недостаточности.
Тем не менее в настоящее время американская регуляторная администрация медикаментозного и пищевого рынков Food and Drug Administration допускает применение ПОАК (в частности, апиксабана и ривароксабана) у пациентов с хронической болезнью почек, находящихся на гемодиализе[45].
Следующий важный вопрос касается продолжительности тройной АТТ. Обсуждая этот вопрос, следует помнить, что риск ТЭО у пациентов с ФП растет со временем. Хорошо известно утверждение о том, что «ФП порождает ФП». ФП является отражением прогрессирования структурно-функционального ремоделирования сердца[46]. Это предопределяет сохранение условий для нарушений ритма и формирования локального тромбоза[47]. Иллюстрацией являются результаты тайваньского когортного исследования[48], продемонстрировавшего увеличение в течение 3,5 года балла по шкале CHA2DS2-VASc при наблюдении за 14 600 пациентами с впервые выявленной ФП. Показано, что у 90% больных появляется дополнительный фактор риска до развития ишемического инсульта. Исходно при включении в исследование все эти пациенты были с ФП и количеством баллов по шкале CHA2DS2-VASc 0 для мужчин и 1 для женщин (без показаний для ОАК). Усиление с течением времени риска системных тромбоэмболий, включая инсульт, постулирует абсолютную необходимость регулярной переоценки баланса ишемических и геморрагических рисков (включая оценку функции почек с помощью клиренса креатинана и скорости клубочковой фильтрации) у больных ФП, которые уже находятся на терапии ОАК или у кого таковая только обсуждается.
С другой стороны, у пациентов с ФП, в отличие от риска ТЭО, риск развития тромбоза стента в коронарных артериях при ИБС с течением времени снижается. Это справедливо при использовании стентов с лекарственным покрытием (DES) 2-го и 3-го поколений. Риск тромбоза стента максимален в течение первой недели после процедуры ЧКВ, затем он снижается в течение последующих месяцев[49].
Данный факт подтверждают результаты реальной клинической практики. В шведском регистре ангиографических исследований и лечебных вмешательств из 882 случаев тромбоза стентов при выполнении 73 798 их имплантаций при ЧКВ 49% развились в течение первых 30 дней после процедуры[50].
Похожие данные приводят исследователи из Дании[51]. Указанные различия в риске развития ТЭО, связанных с ФП и тромбозом стента, дают возможность регулировать временны’е отрезки использования тройной (двойной) АТТ. Действительно, в раннем периоде после проведения стентирующей процедуры на коронарных артериях тромботический риск является максимальным, что требует применения более агрессивной АТТ. Когда же риск ишемических событий снижается, необходимо уменьшить («деэскалировать») интенсивность АТТ, обеспечивая бо’льшую ее безопасность.
Продолжительность применения тройной АТТ может быть минимальной (в период до завершения эффективного ЧКВ) или более продолжительной (6 месяцев) в зависимости от конкретной клинической ситуации.
В американских рекомендациях по ФП 2019 г.[28] и европейских рекомендациях по реваскуляризации миокарда 2018 г.[29], которые вышли в свет до завершения клинического исследования AUGUSTUS, позиционируется возможность использования двойной АТТ в качестве альтернативы тройной ААТ для снижения геморрагического риска (класс рекомендаций IIа). Однако в европейских рекомендациях такой подход определен только для пациентов с исходно высоким риском кровотечений[29].
Американские практикующие врачи по факту используют в основном двойную АТТ (клопидогрел + ОАК)[28]; АСК применяется только в перипроцедурный период и в течение непродолжительного времени нахождения пациента в стационаре. Обоснованием подхода к рутинному использованию двойной в ущерб тройной АТТ являются результаты клинических исследований, выявивших несомненное преимущество в отношении геморрагической безопасности двойной АТТ[39–43].
Постулат о безопасности ранней отмены АСК (еще до выписки пациента их стационара) основан на наблюдении, что максимальное число кровотечений развивается у пациентов с ФП и ИБС в течение первого месяца приема АТТ, в том числе из-за периоперационных осложнений[52]. Высокая частота геморрагических осложнений при совместном с ОАК приеме ДАТ (с АСК) подтверждена и в других, более поздних исследованиях[53].
Однако американские рекомендации допускают назначение тройной АТТ в сроки до 1 месяца при высоком риске ишемических событий, связанных с атеросклерозом, и низком риске кровотечений[28].
Европейские рекомендации разрешают использование такого подхода (тройная АТТ в течение 1 месяца) лишь у пациентов с высоким риском геморрагических событий, который превышает ишемический риск. Всем остальным больным необходимо назначать тройную АТТ на 1 месяц по умолчанию или в течение более длительного времени (от 3 до 6 месяцев) в случае, если риск ишемических событий превышает риск кровотечений (класс рекомендаций IIa)[29].
Такие отличия объясняются различной степенью влияния на эти документы результатов широко известных в настоящее время клинических исследований PIONEER-AF PCI и RE-DUAL PCI. Американцы проявляют бо’льшую приверженность результатам данных трайлов. Вполне вероятно, что опубликованные и обсужденные результаты исследования AUGUSTUS также окажут влияние и на американских, и на европейских экспертов в отношении необходимой продолжительности тройной АТТ и на выбор основных категорий пациентов для уменьшения или увеличения продолжительности приема АТТ. В настоящее время американские и европейские эксперты в основном расходятся в продолжительности приема тройной АТТ (табл.).
Таблица
Сравнение американского и европейского подходов к назначению антитромботической терапии при фибрилляции предсердий и чрескожном коронарном вмешательстве (ЧКВ)[2]
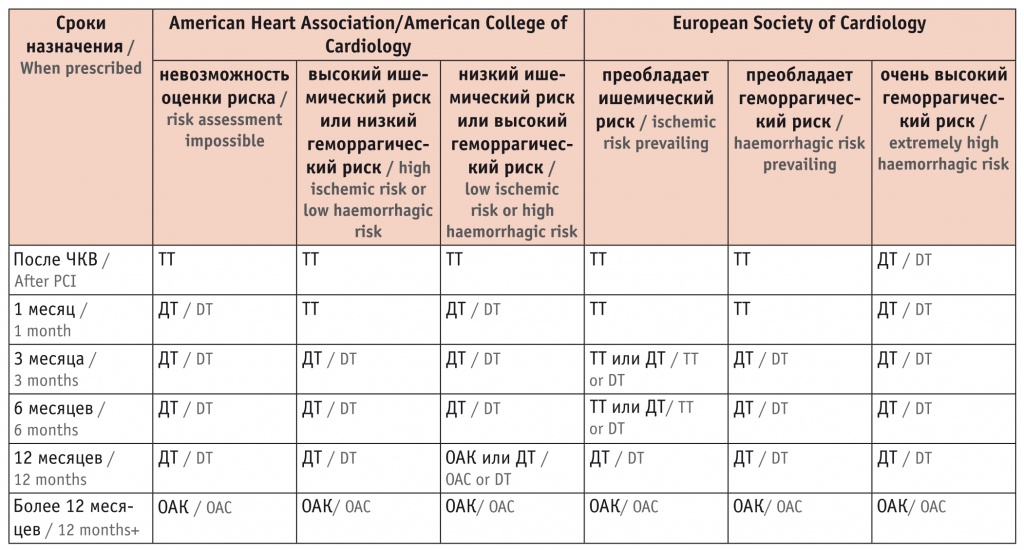
Примечание: ТТ — тройная терапия (оральный антикоагулянт (ОАК) + двойная антитромбоцитарная терапия), ДТ — двойная терапия (ОАК + ингибитор P2Y12).
Следует отметить, что эти рекомендации относятся в основном к пациентам с ФП, принимающим ПOAК. Именно они рекомендованы как препараты выбора при сочетании ФП и ИБС. Эффект отмены АСК у пациентов, принимающих АВК, изучен лишь в небольшом и досрочно закончившемся исследовании WOEST, оценивавшем эффективность и безопасность тройной АТТ[52].
Вместе с тем нужно признать, что ни одно из имеющихся в настоящее время исследований не может дать ясного ответа на вопрос о сравнительной эффективности тройной и двойной АТТ в отношении профилактики ишемических событий. Эти события оценивались в качестве вторичной конечной точки во всех цитируемых выше работах (PIONEER-AF PCI, RE-DUAL PCI, AUGUSTUS, ENTRUST-AF PCI).
Авторы метаанализа четырех рандомизированных исследований, сравнивающих эффективность и безопасность тройной и двойной АТТ у пациентов с ФП, подвергаемых ЧКВ, попытались преодолеть статистические ограничения каждого из исследований по оценке ишемических исходов[54]. Результаты такого сравнения не показали различий в частоте крупных кардиальных событий и других ишемических исходов, включая тромбозы стентов и инсульты, в группах двойной и тройной АТТ (10,4% и 10%, ОШ = 0,85; 95%-ный ДИ: 0,48–1,29). Но достаточно серьезным ограничением этого метаанализа были различия дизайнов включенных исследований, предполагающие разнообразие клинических характеристик пациентов, различные сроки отмены тройной АТТ.
В другом метаанализе показано, что тромбоз стента у пациентов на фоне назначения двойной АТТ (ПОАК + ингибитор P2Y12 тромбоцитов) встречался чаще, чем при тройной АТТ, однако разница не достигла статистической значимости (p = 0,06)[55].
Но в более позднем метаанализе (n = 11 542; включены исследования WOEST, PIONEER AF-PCI, RE-DUAL PCI, AUGUSTUS, ENTRUST-AF PCI) эти результаты не подтвердились и режим ПОАК + ингибитор P2Y12 тромбоцитов был признан оптимальным с позиции соотношения эффективности и безопасности[23].
Действительно, цитируемые выше исследования существенно различаются по срокам отмены АСК. Следует признать, что ни в одном из исследований не было немедленной рандомизации после проведения ЧКВ для выбора стратегии сохранения или отмены АСК. Задержка рандомизации максимально до 3 дней после ЧКВ допускалась в исследовании PIONEER AF, до 5 дней после ЧКВ — в RE-DUAL PCI и ENTRUST AF-PCI. В исследовании же AUGUSTUS среднее время для рандомизации после выполнения ЧКВ составило 6 дней[39, 40, 42, 43].
Таким образом, данные о безопасности отмены АСК в этих испытаниях разнятся вследствие разнообразия временны’х промежутков такой отмены. Эти ограничения очень важны из-за меняющегося даже в течение первой недели после ЧКВ риска тромбоза стента. Следует отметить также, что в исследовании AUGUSTUS частота возникновения тромбоза стента в группе плацебо (без использования АСК) была максимальной по сравнению с другими группами — 0,9%[42].
Приведенные факты должны стать основой для индивидуализации подходов к выбору различных временны́х стратегий использования тройной и двойной АТТ, основанному на тщательном анализе баланса рисков ишемических и геморрагических событий.
Еще один вопрос, который необходимо обсудить: какой именно антитромботический препарат необходимо отменить при переходе с тройной на двойную АТТ? Оба научных экспертных сообщества (американское и европейское) сходятся в том, что «пожертвовать» при переходе с тройной на двойную АТТ необходимо именно АСК, при этом оставив ингибитор P2Y12 рецепторов тромбоцитов (чаще всего клопидогрел), поскольку после ЧКВ использование препаратов данной группы предотвращает тромбоз стента[56–59].
Кроме того, необходимо учитывать, что у некоторых пациентов наблюдается значительная вариабельность эффекта клопидогрела, обусловленная носительством определенных генетических факторов, отвечающих за метаболизм этого пролекарства[60]. Однако при прямом сравнении клопидогрела с АСК первый показал высокую эффективность в снижении риска тромботических осложнений и характеризовался благоприятным профилем безопасности в отношении желудочно-кишечных кровотечений[61, 62]. Важно помнить, что в США традиционным считается использование «кардиологической» дозы — 325 мг.
Существует и вопрос дозирования ПОАК в составе комбинированной тройной или двойной АТТ. Оба научных кардиологических сообщества рекомендуют применять в составе тройной и двойной АТТ дозы, доказавшие свою эффективность в профилактике ТЭО при ФП. Снижение дозировок ПОАК осуществляется по показаниям (чаще всего из-за наличия почечной дисфункции различного генеза, пожилого возраста пациента и низкой массы тела).
Для дабигатрана американские эксперты признают только дозу 150 мг 2 раза в день (IIа В), поскольку доза 110 мг в США не зарегистрирована[28].
Европейские эксперты[29] предлагают дозу дабигатрана 110 мг 2 раза в день в составе тройной терапии (IIа С), 150 мг 2 раза в день — в составе двойной терапии (класс рекомендации IIb, уровень доказательности B) у пациентов с высоким риском ТЭО.
При использовании ривароксабана оптимальной считается доза 15 мг[29] 1 раз в день (но не 20 мг, которая была эффективна для профилактики ТЭО при ФП в исследовании ROCKET AF). Это обусловлено результатами исследования PIONEER-AF PCI (IIa B в американских рекомендациях 2019 г.; IIb B в европейских рекомендациях 2018 г.).
После отмены ингибитора P2Y12 необходимо продолжать прием ПОАК в дозах, показавших свою эффективность в профилактике ТЭО в «больших» регистрационных исследованиях всех ПОАК. После отмены ингибитора P2Y12 необходимо с 15 мг ривароксабана перейти на полную дозу 20 мг в сутки, а при наличии почечной дисфункции — с 10 мг на 15 мг в сутки[9].
У эдоксабана для профилактики ТЭО показана эффективность дозы 60 мг/сут и редуцированной дозы 30 мг/сут, если клиренс креатинина равен 30–50 мл/мин, масса тела пациента ≤ 60 кг, назначена сопутствующая терапия определенными ингибиторами гликопротеина P (хинидином, верапамилом, дронедароном). В исследовании ENTRUST AF-PCI применялась доза 60 мг/сут в сочетании с ингибитором P2Y12[43].
Следует отметить, что в вышедших в 2019 г. рекомендациях European Society of Cardiology по диагностике и лечению хронического коронарного синдрома[63] обозначена необходимость назначения полных доз ПОАК пациентам с ФП и ЧКВ в сочетании с дезагрегантами.
Таким образом, в проведенных многоцентровых рандомизированных исследованиях нет единства подходов к выбору дозы ПОАК в составе тройной и двойной АТТ. Нет единства и в экспертном мнении американского и европейского обществ кардиологов. В реальной клинической практике врачи больше опасаются развития кровотечений, чем новых тромботических событий, что отражается в назначении неадекватно редуцированных доз ПОАК. Этому способствует и дизайн исследований, оценивающих безопасность, но не эффективность ПОАК в составе тройной/двойной АТТ у пациентов с ФП, подвергаемых ЧКВ [39, 40, 42, 43].
Количество включенных пациентов и длительность наблюдения не были нацелены на оценку различия частоты ишемических событий при выборе того или иного подхода к АТТ. В российском исследовании показано, что сниженную дозу ПОАК после проведения планового ЧКВ при ФП назначают более чем 50% пациентов[31]. При этом уменьшение дозы ОАК ассоциируется с увеличением риска тромботических событий (0,79 против 0,93; Log-Rank p = 0,0292), а риск кровотечений (BARC 2–5) не снижается (0,78 против 0,75; Log-Rank p = 0,06742).
Далее следует обсудить вопрос выбора ингибитора P2Y12 в составе тройной АТТ. Можно считать клопидогрел препаратом выбора при сочетании с ОАК. «Новые» антиагреганты (празугрел и тикагрелор) имеют преимущества перед клопидогрелом у пациентов с ОКС, однако данные об их совместном с ОАК использовании очень ограничены, и имеются справедливые опасения о неоправданном повышении риска кровотечений[64]. Это подтверждается результатами использования празугрела вместе с АВК[65].
Европейские рекомендации 2018 г.[29] исключают применение празугрела и тикагрелора в сочетании с ОАК в составе тройной АТТ (III C). Американские эксперты в рекомендациях 2019 г.[28] допускают использование только клопидогрела в тройной ATТ (IIa B). Следует отметить, что в исследовании PIONEERAF-PCI назначение тикагрелора и празугрела разрешено, но доля пациентов, которые фактически получали их, была ничтожно мала (от 2% до 4%)[39]. В исследованиях AUGUSTUS и ENTRUST AF-PCI «новые» дезагреганты также применяли редко[42, 43].
В исследовании RE-DUAL PCI тикагрелор использовался у 12% пациентов, что позволяет получить некоторые данные о возможностях его совместного применения с ОАК, однако без статистической значимости[40]. Так, абсолютное число кровотечений было выше у пациентов, получающих тикагрелор в составе тройной АТТ, чем на фоне двойной АТТ. В свете этих данных при определенной клинической ситуации (молодой возраст пациента с ФП и ИБС, наличие ОКС, СД, сложной процедуре ЧКВ, множественного стентирования) может быть рассмотрено назначение тикагрелора вместе с ПОАК в составе двойной АТТ при исходно низком риске геморрагических осложнений[66].
Дополнительным аргументом в пользу применения «новых» дезагрегантов в составе двойной АТТ может быть известная резистентность пациента к клопидогрелу или появление его побочных эффектов, что случается крайне редко[67]. Использование различных ингибиторов P2Y12 в составе двойной/тройной АТТ должно рассматриваться как перспектива модулирования интенсивности антиагрегантного эффекта при различных клинических ситуациях. Для примера можно привести подход с допущением к использованию «новых» дезагрегантов у пациентов с ФП в исследовании PIONEERAF-PCI[39].
Нужно обсудить также вопрос об оптимальной схеме лечения пациента с ФП после завершения приема АТТ, продолжавшегося 12 месяцев. Пациенты должны далее получать только ОАК, поскольку без выявления дополнительных критериев для пролонгирования приема какого-либо из дезагрегантов они необоснованно повышают риск кровотечений[68, 69]. По мнению американских экспертов, решение вопроса, продолжать ли пациенту с ФП через 12 месяцев АТТ принимать какой-либо из антиагрегантов (АСК или клопидогрел) вместе с ОАК либо отменять, является прерогативой лечащего врача. Если из-за остаточного высокого риска атеротромботических событий врач оставляет пациенту с ФП какой-либо антиагрегант вместе с ПОАК, то чаще всего это бывает клопидогрел[6].
В заключение хотелось бы отметить наличие ряда процедурных аспектов выполнения ЧКВ при ФП.
В настоящее время процедура ЧКВ стала значительно более безопасной: риск перипроцедурных ишемических и геморрагических осложнений уменьшился за счет практически всеобщего использования стентов с лекарственным покрытием, радиального доступа, определения показаний к стентированию с помощью оценки фракционированного резерва кровотока и ультразвука[29]. Особенно актуально использование радиального доступа у пациентов с ФП при назначении агрессивной АТТ.
Необходимо отметить возможность выполнения срочных и неотложных вмешательств на фоне приема ПОАК. Для плановых вмешательств их нужно отменить за 24–48 часов в зависимости от операционного риска и сохранности функции почек[66].
Если пациент находится на лечении АВК, то американские специалисты предлагают использовать период «вымывания» для достижения МНО 2,0 для радиального доступа и 1,5 для бедренного[6]. Европейские эксперты говорят о возможности непрерывного приема АВК и выполнения вмешательства на фоне их действия, чтобы не переходить на гепарин («бриджинг») и избежать повышения риска кровотечений[9].
Американские эксперты допускают терапию «моста» («бриджинг») — назначение нефракционированного гепарина под контролем АЧТВ у пациентов с ОКС при проведении ЧКВ. При этом гепарин вводится внутривенно из расчета 70–100 Ед/кг при дооперационном использовании ПОАК и 30–50 Ед/кг при применении АВК.
Использование клопидогрела в нагрузочной дозе показано только тогда, когда принято решение об имплантации стента [64]. Важно напомнить, что АСК следует применять во время ЧКВ во всех случаях для уменьшения риска тромбоза стента[64].
ЗАКЛЮЧЕНИЕ
Выполнение чрескожного коронарного вмешательства у пациентов с фибрилляцией предсердий и ИБС и его медикаментозное сопровождение — актуальный вопрос современной кардиологии.
Рационально использование возможностей как тройной (оральный антикоагулянт (ОАК) + клопидогрел + ацетилсалициловая кислота), так и двойной антитромботической терапии (ОАК + ингибитор P2Y12 рецепторов тромбоцитов). При этом время применения тройной терапии должно быть максимально сокращено, во всех рекомендациях предпочтение отдается двойной терапии, а в ряде согласительных документов она является вариантом выбора у большинства пациентов.
Позиция американских экспертов заключается в том, что тройная терапия назначается только во время стационарного лечения, а после выписки из стационара пациента необходимо перевести на комбинацию прямого ОАК и одного из антиагрегантов (чаще всего клопидогрела) в течение 6–12 месяцев в зависимости от риска кровотечений.
Европейские специалисты говорят о том, что тройную терапию необходимо прекратить после индивидуальной оценки баланса ишемических/геморрагических рисков (через 1, 3 или 6 месяцев), однако и они допускают использование двойной терапии «по умолчанию» у пациентов с ОКС и очень высоким риском кровотечений. Результаты новых рандомизированных клинических исследований, несомненно, помогут сближению позиций этих ведущих мировых экспертных сообществ и, главное, оптимизируют рутинную клиническую практику врачей.
Поступила: 06.04.2020
Принята к публикации: 10.05.2020








