Ожирение — быстро распространяющаяся проблема, которая становится эпидемией мирового масштаба, затрагивая как детей, так и взрослых [1, 2]. Это состояние формируется в результате аномальных или чрезмерных жировых отложений, наносящих вред здоровью [3]. Важным фактором для понимания влияния на сердечно-сосудистую систему увеличенной массы жировой ткани (ЖТ) стало признание того факта, что адипоциты являются эндокринными и паракринными детерминантами сосудистой функции. При ожирении ЖТ может стать дисфункциональной, что сопровождается эктопическими отложениями жира в других тканях, регулирующими метаболический гомеостаз [4]. Экспансия ЖТ связана с многочисленными местными последствиями, включая активацию процессов воспаления [5], фиброза [6], гипоксию [7], дисрегулированную секрецию адипокинов [8] и нарушенную функцию митохондрий [9]. На биохимическом уровне дисфункция ЖТ включает аномальный метаболизм глюкозы и липидов, резистентность к инсулину, активацию ренин-ангиотензиновой системы, гиперкоагуляцию, воспаление и эндотелиальную дисфункцию, которые обеспечивают действие механизмов, связывающих ожирение с сердечно-сосудистыми заболеваниями (ССЗ).
Широкое внедрение лучевых методов диагностики позволило классифицировать ожирение на висцеральное (ВО) и подкожное в зависимости от локализации чрезмерных жировых отложений [10]. Множество научных и медицинских данных свидетельствуют, что именно ВО связано с повышенным риском заболеваемости и смертности от ССЗ, в т.ч. с риском инсульта, застойной сердечной недостаточности и инфаркта миокарда [11, 12]. Таким образом, несмотря на схожесть строения, региональное расположение жирового депо оказывает существенное влияние на его работу и свойства.
Накопление жира в висцеральной области не является единственным метаболически активным отложением, по меньшей мере еще 6 регионарных депо характеризуются схожими нарушениями на фоне хронического воспаления. Появляется все больше данных о влиянии ЖТ эпикардиальной (ЭЖТ) и периваскулярной (ПВЖТ) локализации на риск развития сердечно-сосудистой патологии [13, 14]. Изучение взаимосвязи толщины ЭЖТ и ПВЖТ и адипокиново-цитокинового профиля пациентов с ИБС может иметь существенное значение для прогнозирования течения ССЗ.
Цель исследования: изучение взаимосвязи толщины ЭЖТ и ПЖТ и адипокиново-цитокинового профиля у пациентов с ИБС в зависимости от наличия ВО.
Дизайн: контролируемое рандомизированное одномоментное исследование.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на базе Федерального государственного бюджетного научного учреждения «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний», руководитель — чл.-корр. РАН, д. м. н., проф. О.Л. Барбараш, в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен локальным Этическим комитетом. Обязательным условием включения пациента в исследование явилось подписанное им информированное согласие на участие в нем.
В период с 2016 по 2017 г. в исследование включены 84 пациента (65 мужчин и 19 женщин) с ИБС в возрасте 58,7 (52,2; 63,5) года, с ИМТ, равным 27,3 (17,1; 39,1) кг/м2. Клинико-анамнестическая характеристика участников представлена в таблице 1. Больные получали стандартную антиангинальную и антиагрегационную терапию. Критерий включения: подписанное информированное согласие на комплексное обследование и лечение. Критерии исключения: возраст моложе 50 и старше 80 лет, наличие в анамнезе СД, уровень гликозилированного гемоглобина (HbA1c) более 6,0%, тяжелая сопутствующая патология: онкологические, инфекционные, психические заболевания, ХОБЛ, болезни соединительной ткани, почечная и гепатоцеллюлярная недостаточность.
Таблица 1
Основные клинико-анамнестические характеристики обследованных больных (n = 84)
| Параметры | Абс. | % |
|
Отягощенная наследственность
|
||
| По сердечнососудистой патологии | 52 | 61,9 |
| По сахарному диабету 2 типа | 17 | 20,2 |
|
Данные анамнеза
|
||
| Курение | 45 | 53,6 |
| Артериальная гипертензия | 83 | 98,8 |
| Дислипидемия | 63 | 75,0 |
| Клиническая картина стенокардии | 67 | 79,8 |
| Инфаркт миокарда | 17 | 20,2 |
| Мерцательная аритмия | 3 | 3,6 |
| Инсульт | 7 | 8,3 |
| Чрескожное коронарное вмешательство | 17 | 20,2 |
| Аортокоронарное шунтирование | 2 | 2,4 |
|
Стадии хронической сердечной недостаточности
|
||
| I | 23 | 27,4 |
| IIА–Б | 10 | 11,9 |
| III | 0 | 0 |
|
Характеристика распространенности атеросклеротического поражения
|
||
| Атеросклероз одной коронарной артерии | 16 | 19,1 |
| Атеросклероз двух коронарных артерий | 18 | 21,4 |
| Атеросклероз трех коронарных артерий | 50 | 59,5 |
| Изолированное поражение коронарных артерий | 21 | 25,0 |
| Поражение нескольких бассейнов со стенозами менее 30% | 34 | 40,5 |
| Поражение нескольких бассейнов со стенозами от 30% до 50% | 20 | 23,8 |
| Поражение нескольких бассейнов со стенозами более 50% | 9 | 10,7 |
|
Сопутствующая патология
|
||
| Хронический бронхит, ремиссия | 9 | 10,7 |
| Бронхиальная астма | 2 | 2,4 |
| Подагра | 2 | 2,4 |
| Язвенная болезнь в стадии ремиссии | 6 | 7,1 |
| Хронический холецистит, ремиссия | 14 | 16,7 |
| Хронический пиелонефрит, ремиссия | 18 | 21,4 |
| Варикозная болезнь нижних конечностей | 19 | 22,6 |
|
Получаемая терапия
|
||
| βадреноблокаторы | 84 | 100,0 |
| Ингибиторы ангиотензинпревращающего фермента | 74 | 88,1 |
| Блокаторы Са2+каналов | 83 | 98,8 |
| Диуретики | 37 | 44,0 |
| Нитраты | 17 | 20,2 |
| Ацетилсалициловая кислота | 84 | 100,0 |
| Клопидогрел | 17 | 20,2 |
| Статины | 63 | 75,0 |
У пациентов верифицировали наличие ВО путем измерения площади висцеральной жировой ткани (ВЖТ) и подкожной жировой ткани (ПЖТ) с помощью МСКТ на компьютерном томографе Siemens Somatom 64 (Siemens, Германия). Критериями ВО являются площадь ВЖТ более 130 см2 и коэффициент отношения площади ВЖТ к площади ПЖТ, более или равный 0,4 [9].
Толщину ЭЖТ определяли с помощью МРТ на МР-томографе Exelart Atlas 1.5 (Toshiba, Япония) с напряженностью магнитного поля 1,5 Тесла. Измерение толщины ЭЖТ осуществлялось на изображениях, ориентированных по короткой оси сердца. По передней стенке правого желудочка измерялась толщина ЭЖТ в трех точках, далее вычислялось среднее значение (рис. 1). Кроме того, по аналогичной методике измеряли толщину ЭЖТ по задней стенке ЛЖ с последующим вычислением среднего значения (рис. 2).
Рис. 1. Количественная оценка толщины эпикардиальной жировой ткани по передней стенке правого желудочка, а также толщины эпикардиальной жировой ткани по задней стенке левого желудочка. Измерение площади эпикардиальной жировой ткани на уровне венечной борозды. Здесь и далее в статье фото авторов
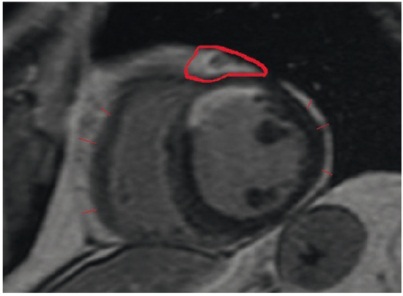
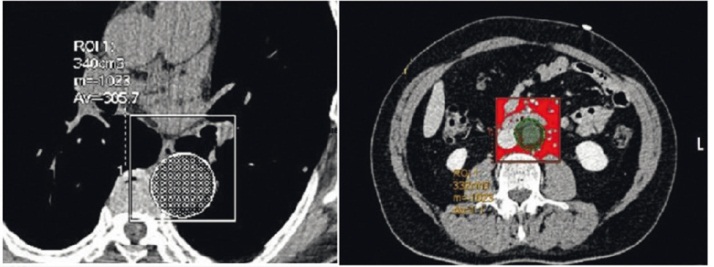
Рис. 2. Количественная оценка объема парааортальной жировой ткани на уровне грудного и брюшного отдела аорты (аксиальное изображение)
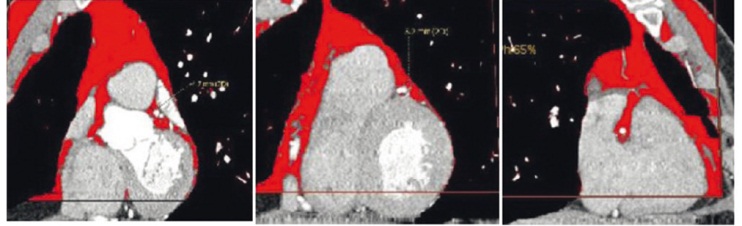
Определение объема и толщины ПВЖТ различной локализации выполнено методом МСКТ на 64-срезовом томографе Siemens Somatom 64 (Siemens, Германия) со следующими параметрами: толщина среза — 1 мм, матрица изображения — 512 × 512, напряжение на трубке — 120 кВ, сила тока — 100 мА, исследование выполнено с болюсным контрастированием, с последующей количественной оценкой. Объем парааортальной ЖТ на уровне грудной аорты оценивали на уровне бифуркации ствола легочной артерии на 70 ± 1 мм в каудальном направлении; объем брюшного отдела аорты — на уровне LII–LV позвонков на протяжении 70 ± 1 мм от бифуркации брюшной аорты в краниальном направлении. Кроме того, проводилась оценка толщины паракоронарных сосудов на постконтрастных изображениях на уровне ствола левой коронарной артерии, а также на уровне проксимального и среднего сегментов передней нисходящей, огибающей и правой коронарной артерий (рис. 3).
Рис. 3. Количественная оценка паракоронарной жировой ткани на уровне проксимального сегмента передней нисходящей артерии, средней трети передней нисходящей артерии и проксимального сегмента правой коронарной артерии
Концентрации общего холестерола, триацилглицеролов (ТАГ), липопротеинов очень низкой, низкой и высокой плотности (ХС-ЛПОНП, ХС-ЛПНП, ХС-ЛПВП), Апо-А1 и Апо-В, свободных жирных кислот (СЖК), глюкозы и НbА1с измеряли на автоматическом биохимическом анализаторе Konelab 30i фирмы Thermo Fisher Scientific (Финляндия). Уровни инсулина и С-пептида в сыворотке крови определяли методом иммуноферментного анализа с использованием тест-системы Monobind Insulin ELISA (США). Чувствительность тканей к инсулину оценивали с помощью индекса чувствительности к инсулину Homeostasis Model Assessment of Insulin Resistance (НОМА-IR) как отношение концентраций инсулина и глюкозы натощак по формуле:[инсулин × глюкоза]/22,5.
Инсулинорезистентность (ИР) фиксировали при значениях индекса HOMA-IR > 2,77.
Содержание лептина, его растворимого рецептора (SOB-R), адипонектина в сыворотке крови определяли иммуноферментным методом с использованием тест-систем фирмы BioVendor (США) и eBioscience (Австрия). Концентрации цитокинов — ИЛ-1β, ИЛ-6, ИЛ-10 и ФНО-α — измеряли с помощью твердофазного иммуноферментного анализа (ELISA) диагностическими наборами фирмы Monobind (США). Чувствительность тканей к лептину оценивали по индексу свободного лептина (FLI) — отношению концентрации лептина (нг/мл) к концентрации растворимого рецептора к лептину (нг/мл). Лептинорезистентность фиксировали при FLI > 25 по показателям сыворотки крови.
Статистическую обработку результатов осуществляли c использованием пакета прикладных программ STATISTICA 10.0. Для оценки вида распределения использовали тест Колмогорова — Смирнова. Для сравнения независимых групп с распределением признаков, отличных от нормального, применяли U-критерий Манна — Уитни. Для исследования зависимостей между переменными использовались коэффициент ранговой корреляции Спирмена, а также линейный регрессионный анализ. Результаты представлены в виде медианы (Mе) и значений 25-го и 75-го квартилей (Me: Q1; Q3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По факту наличия ВО пациенты были поделены на две группы. В 1-ю группу вошли 54 пациента с ВО, во 2-ю группу — 30 человек без ВО (табл. 2). Пациенты исследуемых групп были сопоставимы по возрасту, наличию факторов риска ССЗ, таких как АГ, курение, стенокардия, дислипопротеинемия, застойная ХСН и инфаркт миокарда в анамнезе (р > 0,05).
Таблица 2
Клинико-анамнестическая характеристика пациентов с ишемической болезнью сердца в зависимости от наличия висцерального ожирения
| Показатели |
Пациенты с
висцеральным ожирением, n = 54 |
Пациенты без
висцерального ожирения, n = 30 | Р |
| Возраст, годы | 58,5 (53,0; 63,0) | 56,0 (51,5; 63,5) | 0,710 |
| Мужской пол, n (%) | 45 (83,3) | 20 (66,7) | 0,613 |
| Индекс массы тела, кг/м2 | 28,7 (17,1; 39,1) | 25,9 (18,3; 38,4) | 0,005 |
|
Характеристика распределения жировой ткани по данным МСКТ
| |||
| Общая площадь абдоминального жира, см2 | 541 (381; 725) | 357 (253; 623) | 0,00 |
|
Площадь висцерального жира (ВЖТ), см2 | 197 (145; 301) | 108 (64; 124) | 0,00 |
| Площадь подкожного жира (ПЖТ), см2 | 316 (201; 501) | 253 (159; 498) | 0,00 |
| ВЖТ/ПЖТ | 0,62 (0,60; 0,72) | 0,43 (0,24; 0,50) | 0,00 |
|
Отягощенная наследственность, n (%)
| |||
|
По сердечно сосудистой патологии | 36 (66,7) | 16 (53,3) | 0,36 |
| По сахарному диабету 2 типа | 12 (22,2) | 5 (16,7) | 0,13 |
|
Факторы риска, n (%)
| |||
| Курение | 33 (61,1) | 12 (40,0) | 0,109 |
| Артериальная гипертензия | 54 (100,0) | 29 (96,7) | 0,207 |
| Дислипидемия | 43 (79,6) | 20 (66,7) | 0,25 |
| Клиническая картина стенокардии | 45 (83,3) | 22 (73,3) | 0,23 |
| Инфаркт миокарда в анамнезе | 11 (20,4) | 6 (20,0) | 0,21 |
| Мерцательная аритмия | 2 (3,7) | 1 (3,3) | 0,169 |
| Инсульт в анамнезе | 5 (9,3) | 2 (6,7) | |
| Чрескожное коронарное вмешательство в анамнезе | 11 (20,4) | 6 (20,0) | 0,12 |
| Аортокоронарное шунтирование в анамнезе | 2 (3,7) | 0 | – |
|
Стадии хронической сердечной недостаточности, n (%)
| |||
| I | 14 (25,9) | 9 (30,0) | 0,17 |
| IIА–Б | 6 (11,1) | 4 (13,3) | 0,13 |
| III | 0 | 0 | – |
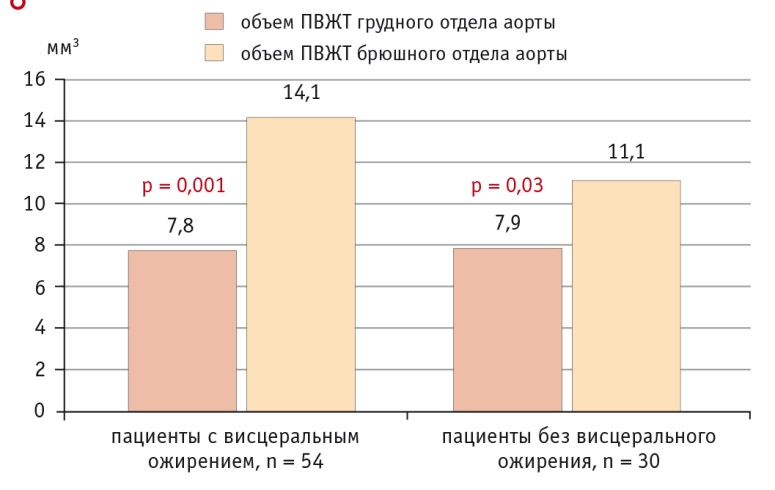
По данным МРТ и МСКТ, у пациентов с ВО накопление жира в эпикардиальных и периваскулярных адипоцитах было более выражено по сравнению с больными без ВО. При ВО толщина эпикардиального депо ЛЖ (ЭЖТл) была в 1,75 раза, а правого (ЭЖТп) — в 1,43 раза больше, чем у больных без ВО (рис. 4). Схожая картина наблюдалась при визуализации ПВЖТ брюшного отдела аорты, так, объем жирового депо у пациентов с ВО в 1,3 раза превышал объем ПВЖТ у лиц без ВО (рис. 5). В то же время разница в объеме парааортальной ЖТ грудного отдела аорты практически отсутствовала.
Рис. 4. Количественная оценка эпикардиальной жировой ткани и периваскулярной жировой ткани в исследуемых группах.
Примечание: н/3 — нижняя треть, ПВЖТ — периваскулярная жировая ткань, с/3 — средняя треть, ЭЖТл — эпикардиальное депо левого желудочка, ЭЖТп — эпикардиальное депо правого желудочка
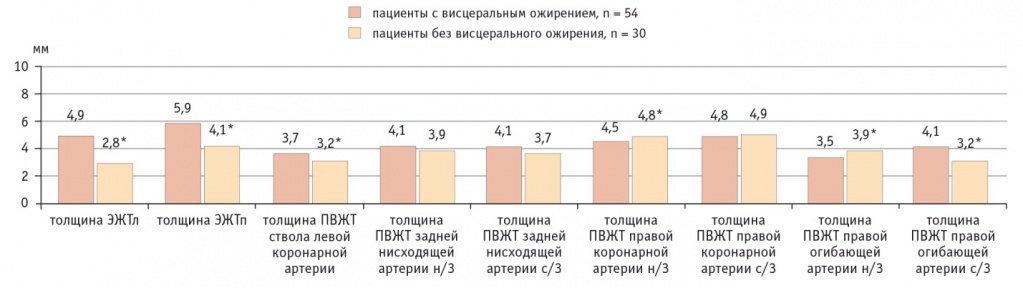
Рис. 5. Объем периваскулярной жировой ткани (ПВЖТ) в исследуемых группах
У больных с ВО ПВЖТ ствола левой коронарной артерии на всем протяжении была на 10% толще, чем у участников без ВО, а ПВЖТ средней трети огибающей артерии — на 28% толще. У пациентов без ВО жировые отложения вокруг правой коронарной артерии и нижней трети огибающей артерии были больше на 6,7% и 11,4% соответственно по сравнению с таковыми у больных с ВО.
В группе ВО установлено наличие прямой корреляционной связи между величиной площади ВЖТ и ЭЖТл (r = 0,26, p = 0,02), ЭЖТп (r = 0,26, p = 0,01) и объемом ПВЖТ грудного (r = 0,51, p = 0,00) и брюшного (r = 0,62, p = 0,00) отдела аорты. Объем жировых отложений паракоронарных артерий не зависел от величины ВЖТ и объема ПВЖТ аорты. Однако для ПВЖТ левой передней нисходящей артерии прослеживалась прямая связь с величиной ЭЖТл (r = 0,64, p = 0,00), для ПВЖТ правой коронарной артерии — с ЭЖТп (r = 0,26, p = 0,02).
Обнаружено, что в сыворотке крови больных ИБС на фоне ВО статистически значимо возрастали концентрации атерогенных показателей липидного обмена (ХС-ЛПНП, ХС-ЛПОНП, Апо-В, ТАГ, Апо-В/Апо-A, ИА, СЖК) и снижалось содержание антиатерогенных фракций ХС-ЛПВП и Апо-А1 по сравнению с таковыми у пациентов без ВО (табл. 3). При ВО были более выражены изменения углеводного обмена, в частности имела место ИР и индекс НОМА-IR был увеличен в 1,5 раза по сравнению с показателем участников без ВО (табл. 4). Кроме того, для пациентов с ВО характерны гиперинсулинемия, возрастание концентрации С-пептида. Концентрации глюкозы и HbA1c в группах существенно не различались (р > 0,05).
Таблица 3
Показатели липидного обмена больных в зависимости от наличия висцерального ожирения, Me (25%; 75%)
| Параметры |
Пациенты с висцеральным ожирением, n = 54 |
Пациенты без висцерального ожирения, n = 30 |
Р |
|
Общий холестерол,
ммоль/л |
4,4 (4,3;
5,0) |
4,0 (3,7;
4,4) |
0,04 |
|
Липопротеины
очень низкой плотности, ммоль/л |
0,95 (0,65;
1,26) |
0,65 (0,49
;0,92) |
0,02 |
|
Липопротеины
низкой плотности, ммоль/л |
2,59 (1,61;
3,35) |
2,05 (1,64;
2,4) |
0,06 |
|
АпоВ, г/л |
1,37 (1,1;
1,89) |
1,15 (0,92;
1,62) |
0,03 |
|
АпоА1, г/л |
1,16 (0,99; 1,36) |
1,22 (1,1; 1,47) |
0,02 |
|
АпоВ/АпоА1 |
1,18 (1,1;
1,38) |
0,94 (0,8;
1,05) |
0,04 |
|
Триацилглицеролы,
ммоль/л |
1,98 (1,43;
2,69) |
1,59 (1,21;
1,9) |
0,01 |
|
Свободные жирные кислоты, ммоль/л |
0,73 (0,59;
1,11) |
0,45 (0,35;
0,61) |
0,01 |
Показатели углеводного обмена больных в зависимости от наличия висцерального ожирения, Me (25%; 75%)
| Параметры |
Пациенты с висцеральным ожирением, n = 54 |
Пациенты без висцерального ожирения, n = 30 | Р |
| HOMAIR | 3,1 (1,96; 4,2) | 2,1 (1,72; 2,9) | 0,02 |
| Инсулин, мкМЕд/мл | 12,67 (9,64; 15,7) | 9,62 (7,6; 12,2) | 0,02 |
| Спептид, нг/мл | 2,29 (1,72; 3,98) | 1,97 (1,47; 2,34) | 0,02 |
| Глюкоза, ммоль/л | 5,5 (4,6; 6,0) | 5,05 (4,9; 5,4) | 0,72 |
| Гликированный гемоглобин, % | 5,6 (5,2; 5,7) | 5,3 (4,9; 5,4) | 0,76 |
Наличие атерогенной дислипидемии и ИР сопровождалось формированием распространенного атеросклеротического поражения сосудов у пациентов с ИБС и ВО. По результатам проведенного ангиографического исследования и цветового дуплексного сканирования, изолированное поражение коронарных артерий зарегистрировано у 18,5% (n = 10) пациентов с ВО и 33,3% (n = 11) без ВО (р = 0,04). Поражение нескольких бассейнов со стенозами менее 30% обнаружено у 44,4% (n = 24) пациентов с ВО и 30,0% (n = 10) без ВО (р = 0,04), от 30% до 50% — у 27,8% (n = 15) и 16,7% (n = 5) соответственно (р = 0,04). Поражение более 50% регистрировалось у 9,3% (n = 5) пациентов с ВО и 13,3% (n = 4) пациентов без ВО (р = 0,26). Кроме того, при ВО преобладало поражение трех и более коронарных сосудов, которое встречалось у 66,7% (n = 36) пациентов с ВО против 46,7% (n = 14) без ВО (р = 0,03).
При выполнении исследования предполагалось, что адипокины и цитокины, синтезируемые в кровь адипоцитами локальных жировых депо на фоне ВО, обладают не только местными, но и системными эффектами и являются факторами риска развития сердечно-сосудистой патологии. В результате оценки параметров адипокинового баланса в сыворотке крови больных с ИБС (табл. 5) выявлено, что при ВО уровень лептина был в 1,67 раза выше, а концентрация SOB-R — на 32,5% ниже по сравнению с таковыми в группе без ВО. Факт наличия лептинорезистентности подтверждался FLI, который при ВО был в 2,5 раза выше, чем у пациентов без ВО. Концентрация адипонектина в сыворотке крови больных с ВО, напротив, была на 27,7% ниже, чем у пациентов без ВО. При оценке воспалительного статуса установлено, что концентрации ФНО-α и ИЛ-1β в сыворотке крови у лиц с ВО превышали соответствующие значения у лиц без ВО в 1,5 и 2,0 раза, в то же время уровень провоспалительного ИЛ-10 был в 2,2 раза ниже у пациентов с ВО по сравнению с больными без ВО.
Таблица 5
Содержание адипокинов и цитокинов в сыворотке крови больных в зависимости от наличия висцерального ожирения, Me (25%; 75%)
| Параметры |
Пациенты с висцеральным ожирением,
n = 54 |
Пациенты без висцерального ожирения,
n = 30 | Р |
| Лептин, нг/мл | 14,6 (11,2; 18,9) | 8,7 (6,4; 9,9) | 0,02 |
| Растворимый рецептор лептина, нг/мл | 18,1 (16,8; 24,7) | 26,8 (20,4; 34,7) | 0,02 |
|
Индекс свободного
лептина | 0,81 (0,67; 0,96) | 0,32 (0,29; 0,36) | 0,01 |
| Адипонектин, мг/мл | 8,1 (6,3; 10,8) | 11,2 (8,7; 14,2) | 0,01 |
| ФНОα, пкг/мл | 1,5 (1,0; 2,3) | 1,0 (0,8; 2,1) | 0,03 |
| ИЛ1β, пкг/мл | 4,9 (2,7; 6,6) | 2,4 (1,1; 5,4) | 0,01 |
| ИЛ10, пкг/мл | 3,7 (1,1; 4,8) | 8,3 (6,8; 9,7) | 0,01 |
| ИЛ1β/ИЛ10 | 1,32 (1,1; 2,4) | 0,28 (0,16; 0,56) | 0,01 |
Данные корреляционного анализа подтвердили наличие взаимосвязи между толщиной ЭЖТ и сывороточными концентрациями адипокинов. Так, у пациентов с ВО концентрация лептина находилась в отрицательной зависимости от толщины ЭЖТ левого и правого желудочков (r = –0,28; p = 0,02 и r = –0,33; p = 0,02). Отрицательная зависимость с толщиной ЭЖТ установлена и для FLI (r = –0,28; p = 0,03). В то же время площадь ВЖТ находилась в прямой зависимости от концентрации лептина (у пациентов с ВО r = 0,48, p = 0,02 и у пациентов без ВО r = 0,33, p = 0,02). Аналогичная зависимость найдена и для FLI (при ВО r = 0,28, p = 0,03 и без ВО r = 0,22, p = 0,04).
Уровень адипонектина находился в обратной зависимости от величины ВЖТ (при ВО r = –0,43, р = 0,00; без ВО r = –0,18, р = 0,03). Общей закономерностью для участников с ВО и без него явилась положительная корреляция концентрации ФНО-α, а также ИЛ-1β с площадью ВЖТ (при ВО r = 0,24, p = 0,05; r = 0,46, p = 0,04; без ВО r = 0,33, p = 0,01; r = 0,34, p = 0,02). Полученные результаты указывают на отсутствие тождественности метаболических процессов в ЭЖТ и ВЖТ, несмотря на прямую корреляционную зависимость толщины ЭЖТ от количества ВЖТ.
Следует отметить, что ПВЖТ брюшного отдела аорты близка по свойствам к ВЖТ. Анализ возможной связи между периваскулярными адипоцитами и показателями адипокинового обмена продемонстрировал наличие прямой связи между объемом ПВЖТ аорты брюшного отдела и уровнем лептина (r = 0,44; p = 0,01), а также FLI (r = 0,56; p = 0,03). Была обнаружена связь и с показателями липидного обмена, а именно с СЖК (r = 0,48; p = 0,02). Выявлена прямая связь между толщиной ЖТ ствола левой коронарной артерии и содержанием ФНО-α (r = 0,88; p = 0,01), ЖТ огибающей артерии (r = 0,88; p = 0,01) и уровнем глюкозы (r = 0,49; p = 0,03). У пациентов без ВО такие связи не установлены.
С помощью логистического регрессионного анализа выявлено, что из всех изучаемых переменных наиболее тесной связью с увеличением толщины ЭЖТ обладали ВО (OШ = 1,9; 95%-ный ДИ: 1,6–2,8), гипертрофия ЛЖ (ОШ = 1,3; 95%-ный ДИ: 1,1–1,8), индекс НОМA-IR (ОШ = 0,8; 95%-ный ДИ: 0,6–1,1), содержание СЖК (OШ = 1,2; 95%-ный ДИ: 1,1–1,8). Наиболее значимыми факторами увеличения объема ПВЖТ коронарных сосудов были уровни ФНО-α (OШ = 1,5; 95%-ный ДИ: 1,1–1,9), адипонектина (OШ = 0,9; 95%-ный ДИ: 0,6–1,1), лептина (OШ = 1,2; 95%-ный ДИ: 1,1–1,3). В ходе проведенного анализа не обнаружено связи между величиной ВЖТ и толщиной ПВЖТ коронарных сосудов.
По данным литературы, ЭЖТ представляет собой вид висцеральной ЖТ, локализованной в непосредственной близости к миокарду и вокруг коронарных артерий [15]. ВЖТ и ЭЖТ имеют одинаковое эмбриологическое происхождение, и увеличение размера обоих жировых депо связано с кальцификацией коронарных артерий [16, 17] и развитием ИБС [18]. Некоторые авторы считают, что рост толщины ЭЖТ свидетельствует о наличии ВО и служит прогностическим маркером ИБС и ее осложнений [19]. Полученные нами результаты показали, что толщина ЭЖТ находится в прямой зависимости от величины ВЖТ, что не противоречит результатам предыдущих исследований [20, 21]. Показано и наличие прямой связи между увеличением толщины ЭЖТ и гипертрофией ЛЖ, а также ИР. Схожими свойствами обладает и ВЖТ [16, 22].
Несмотря на наличие этой связи, эпикардиальные адипоциты имеют уникальные свойства, которые отличают их от жировых клеток других депо. ЭЖТ у здоровых лиц представлена преимущественно бурой ЖТ, тогда как ВЖТ — белой [17]. Клетки белой и бурой ЖТ значительно отличаются друг от друга: клетка белой ЖТ имеет внутри себя один большой жировой пузырек. Он занимает практически всю клетку и оттесняет на периферию ее ядро, которое становится сплюснутым. В адипоцитах бурой ЖТ имеется несколько небольших жировых капель и множество митохондрий, содержащих железо (в цитохромах) и обусловливающих бурый цвет ткани. В физиологических условиях адипоциты ЭЖТ выполняют ряд важных для миокарда функций: метаболическую (абсорбируют избыток СЖК и выступают в качестве источника энергии в условиях ишемии), термогенную (защищают миокард от перегрева), механическую, а также синтезируют адипонектин и адреномедуллин, обладающие кардиопротективными свойствами [18]. Однако на фоне ожирения и прогрессирования коронарного атеросклероза фенотип бурых адипоцитов ЭЖТ трансформируется в фенотип белых благодаря активации ИЛ-6 сигнального пути JAK-STAT3 [23]. Для белых адипоцитов ВЖТ на фоне ожирения характерны интенсивный липолиз с образованием СЖК, а также усиление продукции провоспалительных факторов (ИЛ-1β, ИЛ-6, ФНО-α) и лептина, которые поступают в кровоток, вызывая необратимые изменения в организме — дислипидемию и ИР. Так, для больных ИБС на фоне ВО было характерно наличие ИР и гиперинсулинемии (которых не было у пациентов без ВО), а также атерогенной дислипидемии с повышением концентраций СЖК, ТГ и ХС-ЛПОНП. Также у пациентов с ИБС на фоне ВО регистрировались гиперлептинемия, лептинорезистентность и снижение концентрации адипонектина.
Однако метаболические процессы, сопровождающие гипертрофию и изменение фенотипа адипоцитов ЭЖТ, отличаются от таковых в висцеральных адипоцитах. Так, нами продемонстрировано, что увеличение ВЖТ сопряжено с гиперпродукцией лептина на фоне адипозопатии с развитием лептинорезистентности. В то же время величина ЭЖТ находилась в прямой зависимости от концентрации лептина и FLI (один из основных маркеров лептинорезистентности).
ПВЖТ расположена вокруг сосудов различного калибра, не имеет барьеров, отделяющих ее от адвентиции сосуда [24], в связи с чем синтезируемые цитокины и хемокины могут воздействовать непосредственно на сосудистую стенку, потенцируя спазм сосудов, эндотелиальную дисфункцию, пролиферацию гладкомышечных клеток, миграцию лейкоцитов в интиму и фиброз [25]. Большой объем данных свидетельствует о региональных, фенотипических и функциональных различиях между депо ПВЖТ различной локализации [26]. Полученные нами результаты подтвердили это предположение. Нами не обнаружена связь между величиной ВЖТ и толщиной ПВЖТ коронарных артерий, в то время как для толщины ЭЖТ такая связь регистрировалась и носила прямой характер. Интересно, что ПВЖТ коронарных сосудов немного аномальна, поскольку схожа по фенотипу с белой ЖТ, но включает адипоциты разного размера и дифференцированного состояния подобно бурой ЖТ [27]. ЭЖТ и ПВЖТ коронарных артерий различаются фенотипически, но наличие общей сети микроциркуляции и непосредственная анатомическая близость позволяют этим тканям взаимодействовать и влиять друг на друга. Так, толщина периваскулярного депо левой коронарной артерии зависела только от толщины ЭЖТл (с которой непосредственно контактирует), а сосудов правой половины сердца — от толщины ЭЖТп. Оценка объема парааортальной ЖТ показала отсутствие разницы в грудном отделе в зависимости от наличия ВО. Возможно, это связано с тем, что грудной отдел аорты окружен бурыми адипоцитами, количество и объем которых не меняются в течение жизни и не зависят от развития ожирения. В то же время объем брюшного отдела, представленный белой ЖТ, находился в прямой зависимости от ВЖТ и был больше у пациентов с ВО.
Гетерогенность ПВЖТ того или иного сосуда может иметь значение для реализации ее протективной или проатерогенной функции. В ходе нашего исследования было показано, что метаболический потенциал ПВЖТ брюшного отдела аорты схож с таковым ВЖТ, о чем свидетельствует наличие корреляционных связей с концентрациями СЖК, лептина и FLI, в то время как для грудного отдела такие связи не обнаружены. Помимо наличия традиционных корреляций для висцеральных депо с уровнями ФНО-α и лептина, толщина ПВЖТ ствола левой коронарной артерии зависела от концентрации адипонектина. Ранее подобные связи демонстрировала только подкожная жировая ткань, тогда как для других висцеральных депо такие связи не характерны.
ЗАКЛЮЧЕНИЕ
Полученная информация позволяет рассматривать увеличение эпикардиальной (ЭЖТ) и периваскулярной (ПВЖТ) жировой ткани как самостоятельный маркер риска сердечно-сосудистых заболеваний (ССЗ) и возможную модель для оценки эффективности медикаментозного воздействия. Изучение молекулярных основ функционирования ПВЖТ и ЭЖТ может позволить наиболее полно расшифровать этиопатогенетические механизмы ССЗ и разработать эффективную стратегию их профилактики и контроля.








