Проведение современных хирургических вмешательств невозможно без участия врача анестезиолога-реаниматолога. Анестезиология, зародившаяся в конце XIX века как наука об обезболивании, в дальнейшем трансформировалась в анестезиологию-реаниматологию и способствовала бурному развитию хирургии и переходу ее на качественно новый уровень.
По современным представлениям хирургическая операция для пациента — это не только боль, но и агрессия в отношении организма больного, вызывающая комплекс компенсаторно-приспособительных реакций. Организм пациента реагирует на хирургическое вмешательство в виде стресс-ответа — совокупности патофизиологических изменений, вызванных метаболическими и воспалительными (иммунными) реакциями, индуцированными операционной травмой. К основным компонентам развития операционного стресса можно отнести: психоэмоциональное возбуждение, боль, рефлексы неболевого характера, кровопотерю, нарушение водно-электролитного баланса, повреждение внутренних органов. Современные способы обезболивания предусматривают не только устранение (предупреждение) боли, но и управление функциями организма во время хирургической операции.
Однако лечение хирургического больного нельзя сводить к выполнению оперативного вмешательства и послеоперационному ведению. Значимым этапом является подготовка к операции, когда оценивается переносимость пациентом хирургического вмешательства и проводится коррекция сопутствующей патологии. Важен также психоэмоциональный настрой больного, который во многом формируется лечащим врачом.
Целью работы явилась оценка эффективности внедрения программы ускоренного выздоровления (ПУВ) при автономной и командной работе хирурга и анестезиолога-реаниматолога.
При традиционном подходе хирург и анестезиолог-реаниматолог сосуществовали параллельно, каждый выполнял определенный объем работы. Взаимодействие этих специалистов можно было описать как вечный спор о том, кто из них более важен для пациента. Разногласия возникали на всем протяжении периоперационного периода: до операции, во время ее проведения и на послеоперационном этапе. Эти разногласия зачастую препятствовали конструктивному сотрудничеству и, конечно, не шли на пользу больному.
Противоречия между хирургами и анестезиологами-реаниматологами зародились в то время, когда для многих операций (грыжесечение, аппендэктомия и др.) существовала дилемма: местное обезболивание или наркоз. Со временем были выработаны показания к проведению хирургических вмешательств под наркозом, которые не имели двойственной трактовки.
Другая ситуация, при которой возникали конфликты, — подготовка больного к операции. Хирург считал, что больной достаточно обследован, подготовлен и его можно оперировать, анестезиолог-реаниматолог же по ряду причин придерживался другой точки зрения, или наоборот. В случаях, когда консенсуса достичь не удавалось, проводилcя консилиум с участием хирургов, анестезиологов и, при необходимости, врачей других специальностей (терапевт, кардиолог, эндокринолог и пр.). Во многих лечебных учреждениях для принятия решений привлекался административный ресурс, при этом перевес чаще был на стороне хирургов.
Согласно устоявшейся практике во время операции анестезиолог-реаниматолог в полном объеме отвечает за анестезию, состояние больного и лечебные мероприятия при возникновении различных нарушений, тогда как хирург ответственен за тактику и техническое выполнение оперативного вмешательства. В задачи анестезиолога-реаниматолога входят также наблюдение за больным и обеспечение его стабильного состояния до выхода из анестезии, восстановления адекватного самостоятельного дыхания, глотания, мышечного тонуса и нормальных показателей гемодинамики. Во время пребывания пациента в отделении реанимации ответственность за него несет анестезиолог-реаниматолог, а хирург отвечает за действия, относящиеся к его компетенции.
В настоящее время оказание хирургической помощи претерпело существенные изменения, что связано с совершенствованием подготовки больных к операции, а также с развитием технологий хирургических вмешательств и ведения больных в послеоперационном периоде. В немалой степени улучшению результатов хирургического лечения способствовало появление эндовидеохирургии. Времена, когда филигранное мастерство хирурга определяло результат операции, прошли: симуляционные центры, новые шовные материалы, эндовидеохирургическая аппаратура и т. д. в известной мере уравнивают хирургов в их мастерстве. Активно развивается стандартизация подходов к хирургическим вмешательствам. Статистика убедительно свидетельствует, что количество случаев несостоятельности швов анастомоза, интраоперационных кровотечений и других осложнений хирургических вмешательств снижается, а значит, качество оперирования в целом растет. Сейчас априори считается, что квалификация хирурга находится на достаточно высоком уровне, чтобы исключить ее влияние на исход операции (в противном случае дальнейшее обсуждение проблемы оказания помощи хирургическим больным утратило бы смысл, вместо этого следовало бы остановиться на образовании и подготовке кадров).
В условиях безупречной техники оперативных вмешательств улучшение результатов стационарного лечения может быть достигнуто за счет внедрения и развития командного (междисциплинарного) взаимодействия медицинских специалистов, особенно в российских медицинских реалиях.
Это положение блестяще подтвердил датский профессор H. Kehlet — автор новой концепции Fast-Track Surgery (быстрый путь в хирургии), в русскоязычных публикациях используется эквивалентный термин «программа ускоренного выздоровления» [2]. Опираясь на данные патофизиологического анализа осложнений после плановых хирургических вмешательств, H. Kehlet предложил программу, направленную на уменьшение стрессовой реакции организма больного на хирургическую агрессию, в основе которой лежит мультимодальный подход ко всем этапам периоперационного периода. Концепция возникла в условиях становления доказательной медицины и отказа от многих неэффективных компонентов периоперационного ведения хирургических больных. Реализация ПУВ стала возможной на основе мультидисциплинарного сотрудничества хирургов, анестезиологов-реаниматологов, клинических фармакологов, реабилитологов, среднего медицинского персонала, а также администрации учреждения. Таким образом, H. Kehlet ответил на вопрос «кто более важен для больного: хирург или анестезиолог-реаниматолог?» — важнее команда единомышленников [2].
ПУВ подразумевает тесное взаимодействие между членами медицинского коллектива и представляет в новом свете курацию больного в периоперационном периоде. Реализация ПУВ предусматривает наличие администратора во главе команды, обычно это заместитель главного врача по хирургии и/или анестезиологии и реаниматологии. Важно, что компоненты лечения утрачивают свою специфичность и фрагментарность относительно конкретных специалистов и приобретают черты единого лечебного процесса, в успехе которого заинтересована вся команда, а не отдельные ее участники [1].
В качестве примера приведем отдельные составляющие периоперационного ведения: нутриционную подготовку до операции, использование мышечных релаксантов во время хирургического вмешательства и послеоперационное обезболивание.
Согласно ПУВ до операции больной должен быть проконсультирован хирургом (обычно это лечащий врач) и анестезиологом-реаниматологом. В задачи первого входит установление показаний к операции, второй отвечает за выявление и коррекцию сопутствующей патологии. Однако есть пункт, который находится в компетенции обоих специалистов, — нутритивный статус пациента. Пренебрежение оценкой риска белково-энергетической недостаточности (БЭН) до операции может обернуться серьезными проблемами в послеоперационном периоде. В литературе представлена обширная доказательная база, свидетельствующая о необходимости выявления пациентов с БЭН и ее коррекции.
Для скрининга БЭН разработаны надежные инструменты, которые позволяют и хирургу, и анестезиологу своевременно обнаружить это состояние. Они включают сбор анамнеза, определение антропометрических и лабораторных показателей. Наиболее распространенный инструмент — скрининговый протокол Nutritional Risk Screening 2002 (NRS-2002) [8]. Для использования протокола NRS-2002 не требуется проходить специальное обучение, его можно применять на догоспитальном этапе.
Доказано, что при исходной БЭН ухудшаются результаты хирургического лечения: увеличиваются количество послеоперационных и инфекционных осложнений, длительность госпитализации и показатели летальности [14]. Однако не во всех лечебных учреждениях уделяют пристальное внимание вопросам коррекции питательной недостаточности. Удивительно, но факт: затраты на должное лечебное питание хирургических больных не превышают 2% стоимости лечения, при этом доказанными являются конечное улучшение исходов заболевания и снижение стоимости лечения [6, 10].
Подтверждение эффективности нутриционной поддержки для улучшения исходов лечения содержится в современных работах иностранных и отечественных авторов [4, 7]. В исследование B. Jie и соавт. были включены 1085 пациентов, оперированных на органах брюшной полости [7]. До операции у 512 больных были выявлены признаки нутриционной недостаточности, причем 120 из них по шкале NRS-2002 набрали 5 баллов и более. Проведение нутриционной поддержки в этой подгруппе сопровождалось уменьшением числа послеоперационных осложнений в 2 раза (p = 0,008) и статистически значимым снижением длительности госпитализации (р = 0,018) в сравнении с пациентами, которые не получали дополнительного питания. В отечественной работе на примере геронтологических пациентов с раком толстой кишки показаны уменьшение количества послеоперационных осложнений и сроков пребывания в реанимации и стационаре после операции, а также улучшение качества жизни соматически отягощенных больных [4]. Таким образом, в интересах хирурга, анестезиолога-реаниматолога, а главное, пациента — выявить и скорригировать отклонения в трофологическом статусе до операции. Взаимодействие соответствующих специалистов позволяет решить проблему и уменьшить количество послеоперационных осложнений.
Другой аспект, на который хочется обратить внимание, — нейромышечная блокада (НМБ) во время операции, являющаяся неотъемлемым компонентом анестезии. На первый взгляд кажется, что это чисто анестезиологическая проблема [9]. Адекватная миорелаксация нужна для создания оптимальных условий интубации трахеи и проведения ИВЛ во время анестезии. Однако при ближайшем рассмотрении это не совсем так. Значительная часть современных операций выполняется лапароскопическим доступом в условиях карбоксиперитонеума. И здесь мы сталкиваемся с двумя взаимоисключающими составляющими. С одной стороны, необходимо обеспечить хороший обзор операционного поля хирургу, для чего в брюшную полость вводится углекислый газ. С другой стороны, желательно не превышать референсных значений внутрибрюшного давления (ВБД, обычно 12–14 мм рт. ст.) и критического времени непрерывного карбоксиперитонеума (6 часов), особенно у больных пожилого и старческого возраста, отягощенных соматически, число которых постоянно растет. Возникает конфликт интересов хирурга и анестезиолога-реаниматолога. Для проведения ИВЛ хватает неглубокой НМБ. Но при такой релаксации передняя брюшная стенка пациента расслаблена недостаточно, что создает трудности при лапароскопических манипуляциях, увеличивает время вмешательства, повышает опасность неконтролируемых движений у больного и заставляет хирурга увеличивать ВБД при карбоксиперитонеуме. Вместе с тем создать комфортные условия для оперирования можно при низких цифрах ВБД, но в условиях глубокой НМБ [12]. Однако ее достижение сопровождается замедленным выходом пациента из наркоза и остаточными явлениями НМБ, которые могут приводить к дыхательным нарушениям в постнаркозном периоде, в том числе фатальным, а также к развитию осложнений в ближайшем послеоперационном периоде. Как же решается эта проблема?
В стандарты проведения общей анестезии наряду с субъективной оценкой НМБ на основании клинических признаков входит объективный аппаратный мониторинг (к сожалению, последний используется не во всех лечебных учреждениях). В основе объективного нейромышечного мониторинга лежат электрическая стимуляция нерва и оценка ответа мышцы на стимуляцию. Мышечный ответ чаще всего оценивают посредством акселеромиографии — метод основан на определении ответа мышцы по силе ускорения (акселерации).
Для оценки нейромышечной функции обычно используют стимуляцию периферических нервов (локтевого, большеберцового, лицевого). Восстановление нейромышечной проводимости в мускулатуре конечностей происходит позже, чем в центрально расположенных мышцах, ответственных за дыхание и проходимость дыхательных путей.
Из способов стимуляции в большинстве портативных и встроенных мониторов используются четырехразрядная стимуляция (Train of Four, TOF) и посттетанический счет (Post-Tetanic Count, PTC). При этом наиболее распространенным и универсальным методом, применяемым во всех фазах анестезии и в раннем послеоперационном периоде, является TOF [3].
TOF представляет собой пакеты из четырех последовательных электрических стимулов с частотой 2 Гц. Обычно рассчитывается отношение амплитуды четвертого ответа к амплитуде первого, выражаемое в процентах или долях (например, TOF 50% или 0,5). При исходном состоянии в отсутствие миорелаксации TOF составляет 100% (1,0), при глубоком блоке — 0. Важное информационное значение имеет количество ответов на стимулы от 0 до 4 (Т0, Т1, Т2, Т3, Т4).
РТС — режим, предназначенный для оценки глубокой НМБ. Он используется только по достижении Т0 при стимуляции TOF. В основе метода лежит подсчет ответов на 15 одиночных стимулов с частотой 1 Гц, подаваемых через 3 секунды после пятисекундной тетанической (50 Гц) стимуляции. Чем меньше число ответов, тем больше глубина миорелаксации. РТС менее 5 соответствует интенсивной НМБ.
Для проведения ИВЛ и при операциях, выполняемых из лапаротомного доступа, обычно достаточно поддерживать НМБ от Т0 до Т2. Однако при лапароскопических вмешательствах требуется достижение уровня НМБ Т0 или Т0, РТС менее 5, т. е. речь идет о глубокой или интенсивной НМБ. Таким образом достигаются более комфортные условия для работы хирургов, сокращается время операции, уменьшается выраженность хирургического стресса.
В качестве примера приводим фотографии одного и того же операционного поля при различных уровнях НМБ (рис.). При TOF 0 рабочее пространство для манипуляций больше, что создает хорошие условия для выполнения хирургического вмешательства. Глубокая НМБ повышает податливость брюшной стенки и позволяет избежать увеличения ВБД.
Рис. Вид операционного поля при различныхпоказателях четырехразрядной стимуляции(Train of Four, TOF). Фото авторов
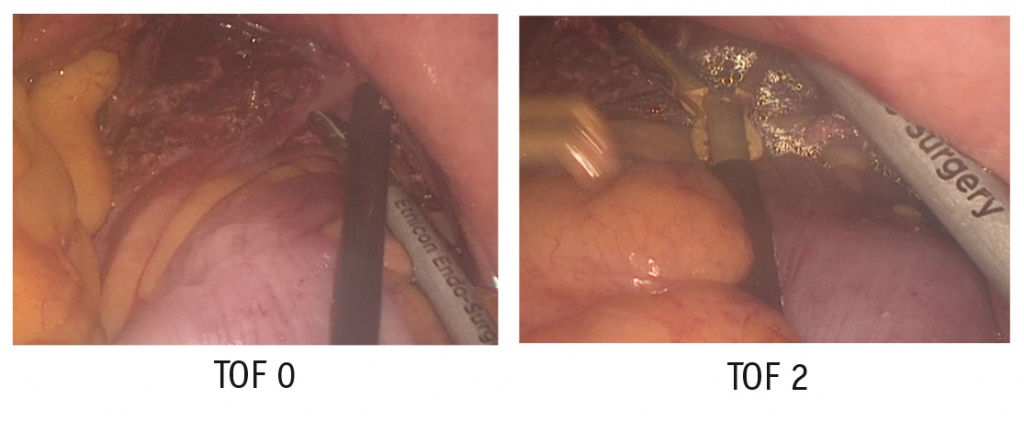
Развитие внутрибрюшной гипертензии в условиях инсуффляции газа может сопровождаться патофизиологическими изменениями в системах дыхания и кровообращения. Вследствие повышения ВБД купол диафрагмы оттесняется в грудную полость, внутригрудное давление возрастает и наблюдается снижение функциональной остаточной емкости легких. Это приводит к нарушению вентиляционно-перфузионных отношений, увеличению внутрилегочного шунтирования крови и угрозе возникновения гипоксемии, возникновению послеоперационных ателектазов и/или пневмонии. Кроме того, при возрастании ВБД наблюдается компрессия нижней полой вены и сосудов ее бассейна, возникает венозный стаз в нижних конечностях, снижается преднагрузка сердца. Сдавлению подвергаются также артериальные сосуды со снижением спланхнического кровотока, нарастает общее периферическое сопротивление, а следовательно, и постнагрузка. Одновременно увеличивается церебральный кровоток, растет внутричерепное давление, что повышает риск развития когнитивных нарушений, церебральных и сердечно-сосудистых осложнений после операции. Наиболее демонстративны эти изменения у больных пожилого и старческого возраста, которые составляют основной контингент оперируемых больных.
В настоящее время имеются рекомендации поддерживать НМБ под контролем аппаратного мониторинга с целевыми значениями TOF 0 или глубже (РТС менее 5) на протяжении всей лапароскопической операции до момента десуффляции [11]. Однако при этом хирургической бригаде приходится сталкиваться с другой проблемой: после окончания операции отпадает потребность в миоплегии. Этот момент необходимо учитывать для быстрого перевода больного на самостоятельное дыхание. Наиболее управляемой миорелаксации удается добиться при использовании рокурония в сочетании с сугаммадексом. Применение рокурония позволяет в комфортных условиях проводить интубацию трахеи, так как он характеризуется самой высокой скоростью развития миоплегии среди недеполяризующих релаксантов. Имея среднюю продолжительность действия и низкую токсичность, рокуроний делает миоплегию управляемой и предсказуемой. А наличие специфического антидота — сугаммадекса позволяет быстро выполнить реверсию НМБ, перевести больного на самостоятельное дыхание и, как следствие, начать раннюю реабилитацию уже в условиях операционной и отделения интенсивной терапии. Особенно важен такой подход при лапароскопических операциях у больных группы высокого риска, в частности пожилого и старческого возраста [5].
Таким образом, поддержание миоплегии во время наркоза — часть междисциплинарной проблемы, одинаково интересной как анестезиологу-реаниматологу, так и хирургу.
В послеоперационном периоде важным компонентом ПУВ является обезболивание. Именно в это время болевые ощущения могут в значительной степени нивелировать успех оперативного вмешательства и создать проблемы для реабилитации. Кроме того, боль чаще всего остается в памяти пациента о пребывании в хирургической клинике. Общепризнанным является тот факт, что послеоперационный болевой синдром ухудшает результаты лечения, однако до сих пор эта проблема не решена. Значительная часть хирургических больных не получает должного обезболивания [13].
Адекватность обезболивания после хирургического вмешательства в значительной степени зависит от консенсуса между хирургом и анестезиологом-реаниматологом. Схема обезболивания во многом влияет на результаты реабилитации. Действительно, назначение наркотических анальгетиков позволяет уменьшить выраженность болевого синдрома, но вместе с тем сопровождается сонливостью и адинамичностью больных, парезом кишечника, эпизодами тошноты и рвоты, что замедляет сроки реабилитации и создает у пациентов негативный настрой по отношению к стационарному лечению. При использовании перидуральной анальгезии для послеоперационного обезболивания достигается удовлетворительный обезболивающий эффект, уменьшается число случаев тошноты и рвоты, а также количество послеоперационных осложнений. Однако применение этой методики возможно не во всех областях хирургии.
При современном уровне развития фармакологии оптимальным становится мультимодальный подход к послеоперационному обезболиванию, т. е. одновременное применение нескольких препаратов, различающихся по механизму действия и точкам приложения. Такие схемы обезболивания разрабатывают с целью достижения максимального анальгетического эффекта при меньших дозировках отдельных лекарственных средств. Одновременно снижаются частота и выраженность известных побочных эффектов препаратов. Многоуровневая антиноцицепция позволяет достичь максимального анальгетического эффекта нескольких препаратов за счет синергизма действия. Классическая схема мультимодальной анальгезии в послеоперационном периоде включает опиоиды, НПВС, нефопам, парацетамол и адъювантные препараты. Использование мультимодальной анестезии позволяет добиться опиоидсберегающего эффекта и минимизировать побочные действия наркотических анальгетиков.
ЗАКЛЮЧЕНИЕ
Широкое и эффективное внедрение программы ускоренного выздоровления и повышение качества оказания помощи хирургическим больным во многом основаны на тесном взаимодействии хирургов и анестезиологов-реаниматологов на всех этапах периоперационного периода. Формирование единой команды со специалистами смежных областей и средним медицинским персоналом помогает предотвратить фрагментацию лечебного процесса и выработать единые эффективные подходы к лечению хирургических больных.








