ВВЕДЕНИЕ
Геморрагический инсульт является вторым по распространенности типом инсульта, что составляет 10–50% случаев в зависимости от населения, расы и региона. Диапазон летальности — от 35% через 7 дней до 59% через год; 50% смертельных случаев происходят в первые 48 часов после появления первых клинических симптомов [1, 2]. Оставшиеся в живых часто остаются с тяжелой инвалидностью, и лишь менее 40% пациентов восстанавливают функциональную независимость [3].
Оценка нейрофизиологических показателей в остром периоде геморрагического инсульта позволяет использовать дополнительные предикторы дальнейшего течения заболевания наряду с клиническими и нейровизуализационными данными [4–6].
В целом худший прогноз ассоциирован с замедлением или редукцией альфа-ритма как основного коркового ритма, нарастанием индекса и мощности медленно-волновой активности, избыточной активацией симпатического контура автономной нервной системы. Исследование когнитивных вызванных потенциалов позволяет дополнительно оценить нейрофизиологические корреляты степени выраженности расстройства сознания [7, 8].
Целью исследования является выявление различий физиологических показателей в группах пациентов в остром периоде геморрагического паренхиматозного инсульта (супратенториальных полушарных гематом) с благоприятным прогнозом и летальным исходом.
МАТЕРИАЛЫ И МЕТОДЫ
С целью изучения исходной сопоставимости групп проанализированы анамнестические данные, показатели клинического, инструментального и лабораторного обследований 96 пациентов. Исследование проводилось в Областной клинической больнице Рязани с 2018 по 2021 г. Среди участников было несколько больше мужчин (n = 52; 54,2%). Сопоставление больных по возрасту выявило преобладание возрастной категории 50–59 лет среди мужчин (n = 16; 30,8%) и 70–79 лет среди женщин (n = 12; 27,3%). Средний возраст женщин составил 73,5 года, мужчин — 66,1 года.
Рентгеновская КТ выполнялась на аппарате Toshiba Aquilion 64 (Toshiba, Япония).
Диагноз геморрагического инсульта определялся на основе данных нейровизуализации, клинической синдромологии и анамнеза (особенностей начала и течения заболевания), клинико-лабораторных данных.
Критерии включения в исследование:
1) нетравматическая полушарная гематома супратенториальной локализации, верифицированная в день поступления, что подтверждено рентгеновской КТ;
2) отсутствие у пациентов показаний для хирургического лечения.
Критерии исключения: субарахноидальные кровоизлияния, кровоизлияния аневризматического характера, только вентрикулярные кровоизлияния.
Для оценки динамики состояния пациентов с геморрагическим инсультом определяли показатели Cerebrolysin and recovery after stroke, а также шкалы комы Глазго на 1-е (день поступления), 3-и и 21-е сутки.
На основе кластерного анализа и экспертных оценок выделены две группы: 49 пациентов с летальным исходом острого периода геморрагического инсульта и 47 человек с благоприятным прогнозом.
Первично выделение группы пациентов с летальным исходом основывалось на их гибели вследствие отека-набухания головного мозга.
Регистрация ЭЭГ осуществлялась при помощи программного комплекса «Нейрон-Спектр.Net» по схеме 10–20 при 19-канальной записи с анализом спектральных показателей ЭЭГ в парадигме oddball (при невозможности реакции пациента на стимул производилась подача различающихся стимулов без нажатия на кнопку). Потенциал Р300 регистрировали в рамках вероятностной парадигмы появления значимого стимула (тон 2000 Гц) и незначимого стимула (тон 1000 Гц). Вероятность появления значимого стимула составила 30%, незначимого — 70%, длительность стимула была 50 мс интенсивность — 70 Дб SPL, использовались наушники [9, 10].
Для регистрации вариабельности сердечного ритма (ВСР) применялись прибор «Варикард 2.5» (фирма «Рамена», Рязань) и программа ИСКИМ (версия 6.0). Оценивались ЧСС, среднее квадратичное отклонение, коэффициент вариации, индекс напряжения регуляторных систем.
Выполнен анализ мощности спектральных составляющих динамического ряда кардиоинтервалов с определением мощности медленных волн 1-го (LF) и 2-го порядка (VLF) [11].
Оценка статистической значимости различий между группами проводилась методами непараметрической статистики с применением критерия Манна — Уитни U (Z), описание данных предполагало выделение медианы (Me), нижнего (LQ) и верхнего квартилей (UQ). Искусственные нейронные сети создавались, обучались и тестировались при помощи программы Statistica 10.0 Ru.
В качестве контрольной группы (для оценки валидности используемых нейрофизиологических показателей) обследованы 28 пациентов с дорсопатией шейного отдела позвоночника (умеренным мышечно-тоническим синдромом) вне стадии обострения и без неврологических нарушений, указаний на эпизоды нарушения мозгового кровообращения в анамнезе и признаков компрессии и гемодинамически значимых стенозов магистральных сосудов шеи, по данным ультразвуковой доплерографии.
Потенциал, связанный с событием: интенсивность обоих видов стимулов — порядка 60–80 дБ (иногда до 100 дБ); частота низкого тона — 1000 Гц, высокого — 2000 Гц. Появление значимого стимула выставляется с вероятностью 20–30% от общего количества стимулов. Длительность стимула — 50 мс. Межимпульсный интервал — 1–2 с.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В таблице 1 представлены показатели частоты альфа-колебаний в выделенных группах.
Таблица 1
Частота альфа-колебаний в группах с благоприятным прогнозом и летальным исходом инсульта, Гц
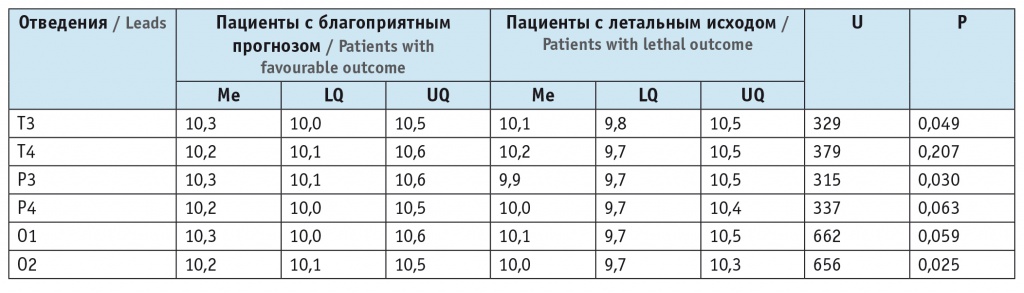
Паттерны спонтанной ЭЭГ значимо не различались в параметрах распределения ритмизированной альфа-активности по уровню амплитуды. В группе с летальным исходом фоновая активность была представлена так называемым медленным вариантом альфа-ритма. В группе с благоприятным прогнозом доминирующая активности составила 10,1–10,5 Гц против 10,0–10,3 Гц в группе летального исхода.
Генерация альфа-ритма связана с реверберацией импульсной активности по интеркортикальным и таламо-кортикальным нейронным сетям, а выраженность обусловливает синхронизацию функциональной активности различных мозговых систем, например определяет связь получаемой от афферентной системы организма информации с механизмами оперативной памяти, регулируя адаптационные процессы.
В таблице 2 представлены показатели амплитуды альфа-колебаний.
Таблица 2
Амплитуда альфа-колебаний в выделенных группах с благоприятным прогнозом и летальным исходом инсульта, мкВ
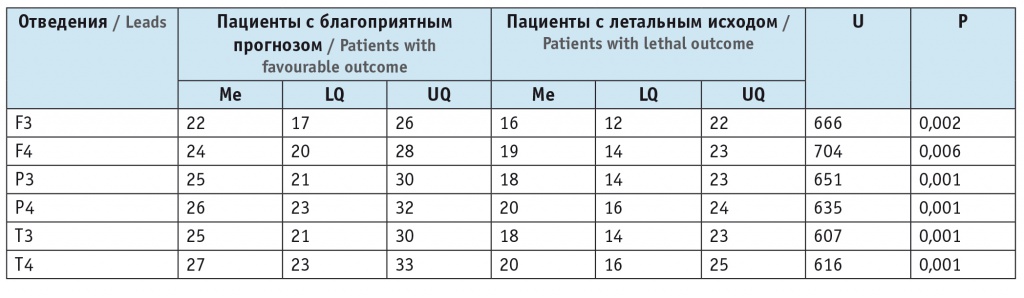
У больных с благоприятным прогнозом полная амплитуда спектра ЭЭГ была выше в сравнении с таковой у лиц с летальным исходом (статистически значимые результаты представлены во всех отведениях).
Выявлено значимое увеличение средней частоты тета-колебаний в обеих группах, особенно в группе летального исхода (табл. 3).
Таблица 3
Мощность тета-колебаний электроэнцефалограммы в группах с благоприятным прогнозом и летальным исходом инсульта в фоновом режиме, мкВ2/с2
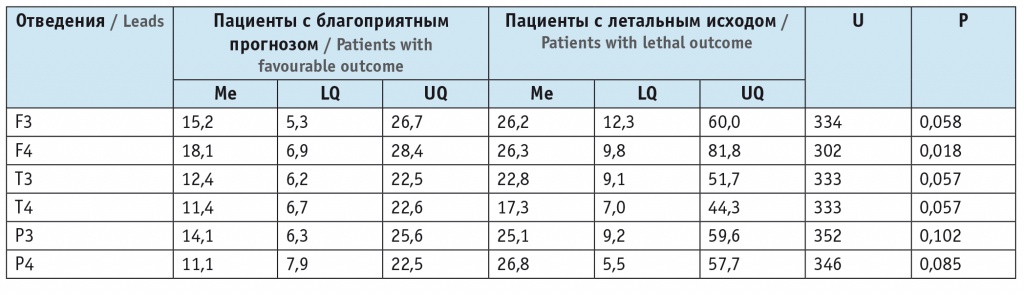
Таким образом, данные анализа ЭЭГ отражают редукцию основного коркового ритма, увеличение синхронизирующих стволовых влияний с нарастанием медленно-волновой активности, предшествующие летальном исходу геморрагического инсульта.
При исследовании Р300 у пациентов с летальном исходом заболевания выявлена значимо меньшая амплитуда P2N2 в Fz, чем при благоприятном прогнозе: 5,1 (2,6; 9,1) мкВ против 8,9 (5,6; 20,4) мкВ (U = 148; p = 0,021).
По мнению некоторых авторов, генерируют компонент Р300 таламус, гиппокамп, лобные доли, теменная область коры головного мозга, подкорковые структуры [12, 13]. Предполагают, что компонент N2 (негативная фаза) отражает процессы, происходящие в височной области. У наших пациентов с благоприятным прогнозом можно сделать вывод о более высокой активации лобных долей по сравнению с показателем больных из группы летального исхода.
При сравнительном анализе ВСР значимые различия выявлены только по ЧСС (среднему интервалу R-R): она была ниже в группе пациентов с летальным исходом острого периода геморрагического инсульта: 696 (608; 836) мс против 806 (743; 911) мс (U = 181; p = 0,033).
Существенные различия по другим показателям ВСР отсутствовали. Однако параметры ВСР применены нами для определения взаимосвязи между физиологическими показателями методом корреляционного анализа (рис. 1, 2).
Рис. 1. Графическое отражение (корреляционная плеяда) линейных корреляций (Rs) физиологических показателей в группе пациентов с благоприятным прогнозом острого периода геморрагического инсульта: сплошные линии — положительные корреляции, штриховая линия — отрицательная корреляция
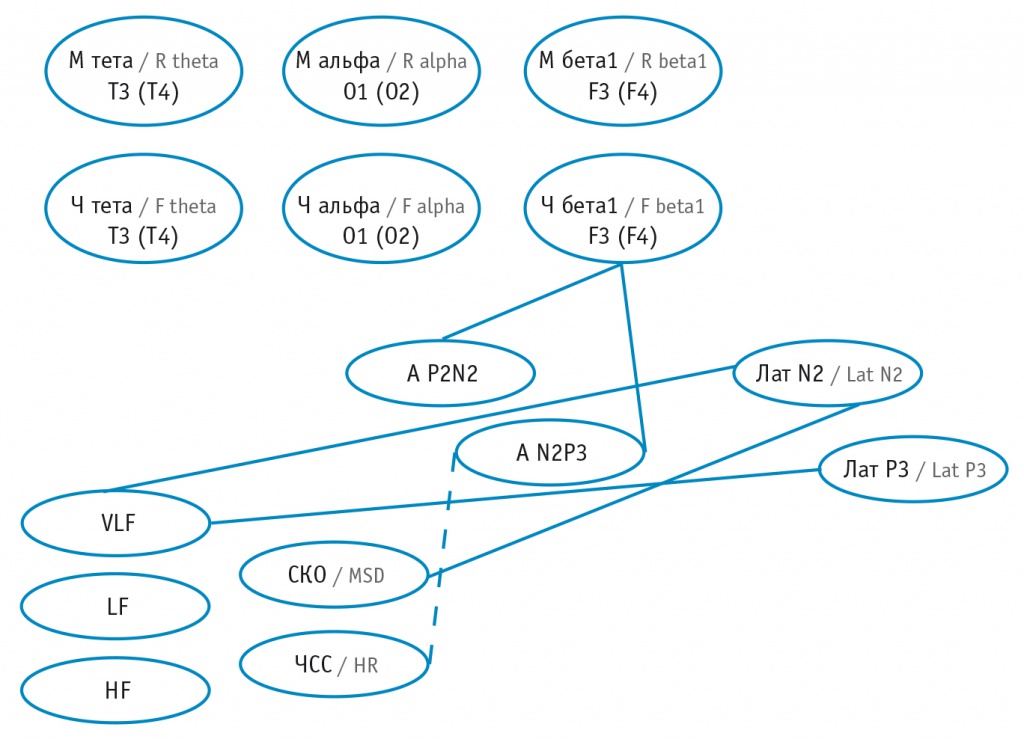
Рис. 2. Графическое отражение (корреляционная плеяда) линейных корреляций (Rs) физиологических показателей в группе пациентов с летальным исходом острого периода геморрагического инсульта: сплошные линии — положительные корреляции, штриховые линии — отрицательные корреляции; толщина линий отражает силу корреляций (тонкая линия — слабая корреляция).
Примечание. Здесь и в рисунке 1: М тета T3 (T4) — мощность тета—колебаний электроэнцефалограммы (ЭЭГ) в отведении Т3 (или Т4), М альфа О1 (О2) — мощность альфа-колебаний ЭЭГ в отведении О1 (или О2), М бета1 F3 (F4) — мощность бета1-колебаний ЭЭГ в отведении F3 (или F4), Ч тета Т3 (T4) — частота тета-колебаний ЭЭГ в отведении Т3 (или Т4), Ч альфа О1 (О2) — частота альфа-колебаний ЭЭГ в отведении O1 (или O2), Ч бета1 F3(F4) — частота бета1-колебаний ЭЭГ в отведении F3 (или F4), А P2N2 — амплитуда P2N2 P300 (Fz, Cz, Pz), А N2P3 — амплитуда N2P3 P300 (Fz, Cz, Pz), Лат N2 — латентность N2 P300 (Fz, Cz, Pz), Лат P3 — латентность P3 P300 (Fz, Cz, Pz), VLF — мощность очень низкочастотной составляющей спектра ВСР, LF — мощность низкочастотной составляющей спектра ВСР, HF — мощность высокочастотной составляющей спектра ВСР, СКО — среднее квадратичное отклонение ВСР, ЧСС — частота сердечных сокращений
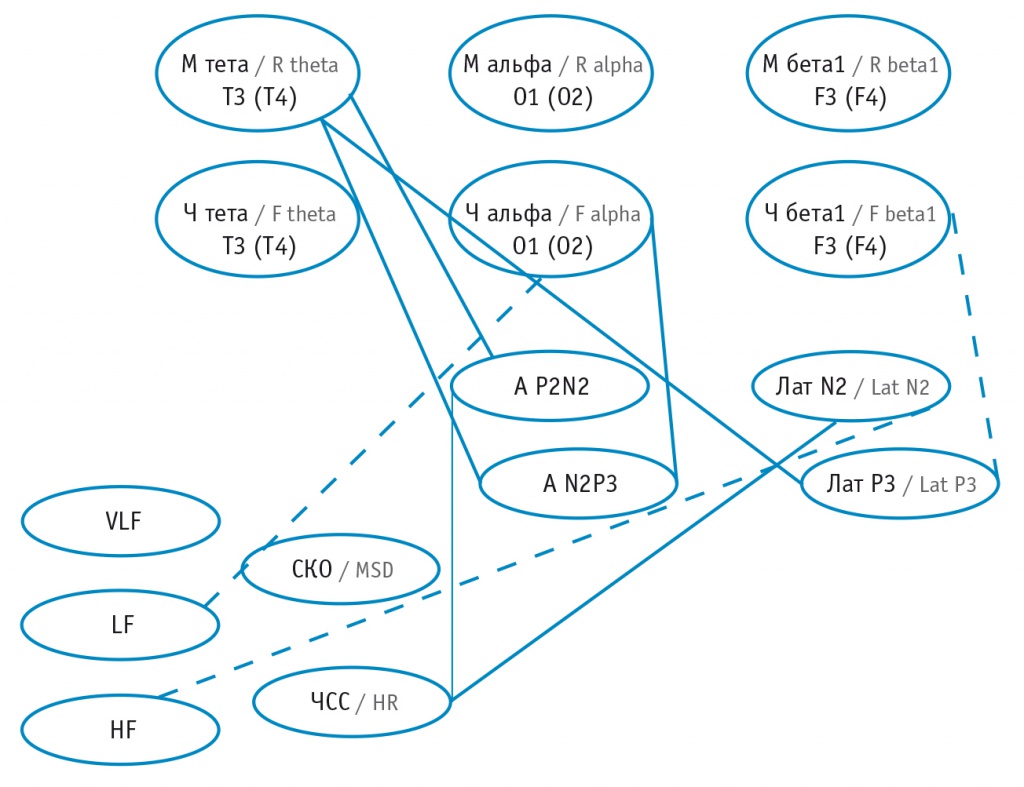
Как следует из представленных графических моделей в виде корреляционных плеяд, у пациентов группы летального исхода определяется увеличение числа линейных корреляций по сравнению с таковым у больных с благоприятным прогнозом. Данные феномены отражают увеличение сопряжения в функционировании физиологических механизмов и, следовательно, ограничение функциональных резервов в этой группе.
ЗАКЛЮЧЕНИЕ
Неоднородность прогноза острого периода геморрагического инсульта имеет определенные физиологические корреляты. Летальному исходу предшествуют редукция основного коркового ритма, нарастание медленно-волновой активности, по результатам ЭЭГ, снижение активации механизмов опознания стимула, по данным когнитивных вызванных потенциалов Р300.
Анализ степени сопряжения физиологических механизмов регуляции уровня функциональной активности головного мозга (ЭЭГ), нейрофизиологических коррелятов опознания стимула и принятия решения по отношению к нему (Р300), а также механизмов вегетативной регуляции (вариабельности сердечного ритма) указывает на ограничение функциональных резервов у больных с летальным исходом заболевания.
Поступила: 13.05.2021
Принята к публикации: 06.09.2021








