В настоящее время является актуальным поиск биологических маркеров, которые отражают характер течения заболеваний, степень злокачественности новообразования, длительность безрецидивного периода и продолжительность жизни. Один из крайне немногочисленных методов прижизненного исследования химических процессов, протекающих в органах и тканях человека, — магнитно-резонансная спектроскопия[1]. МР-спектроскопия при первичных опухолях головного мозга используется для дифференциальной диагностики с неопухолевыми образованиями[2], а также между лучевым некрозом и продолженным ростом опухоли[3, 4], для оценки степени злокачественности[5, 6].
Цель исследования: изучить прогностическую значимость метаболических изменений в определении степени злокачественности опухоли у больных с глиомами головного мозга, длительности безрецидивного периода и продолжительности жизни по результатам МР-спектроскопии.
Задачи нашего исследования:
1) изучить значение метаболических маркеров в ткани опухолей головного мозга в определении степени злокачественности на основании результатов многовоксельной МР-спектроскопии;
2) сопоставить метаболические изменения с длительностью безрецидивного периода и продолжительностью жизни у больных с глиальными опухолями головного мозга.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование вошли 39 пациентов с новообразованиями головного мозга: 17 — с диффузными астроцитомами, 13 — с анапластическими астроцитомами, 9 — с глиобластомами. Средний возраст пациентов — 44,26 ± 14,66 года. Контрольную группу составили 9 здоровых лиц в возрасте 25,6 ± 2,07 года.
Оценка безрецидивного периода и продолжительности жизни была выполнена у 26 из 39 пациентов: 10 — с диффузными астроцитомами, 9 — с анапластическими астроцитомами, 7 — с глиобластомами.
Критериями включения в исследование являлись возраст старше 18 лет, выявленное объемное образование головного мозга по результатам МРТ. Критерии исключения: неподтвержденный диагноз глиомы головного мозга по результатам гистологического исследования, наличие оперативного вмешательства по поводу выявленного образования в анамнезе.
Все больные находились на амбулаторном и стационарном обследовании и лечении в клиниках Военно-медицинской академии им. С. М. Кирова в 2004–2017 гг. У всех участников были собраны и уточнены клинико-анамнестические данные, проведены неврологический осмотр и оценка результатов структурной нейровизуализации.
Всем больным на базе кафедры рентгенологии и радиологии Военно-медицинской академии им. С. М. Кирова выполнили МРТ и МР-спектроскопию по водороду головного мозга на томографе Magnetom Symphony (Siemens, Германия) с напряженностью магнитного поля 1,5 Тесла. Был осуществлен анализ спектрограмм. Для получения спектров использовали следующие параметры: время эхо — 135 мс, размер исследуемого вокселя — 1,3 см3 (10 × 10 × 13 мм), время повторения — 1500 мс, количество вокселей — 48. На всех спектрах определялись метаболиты: холин (Cho), креатин (Cr), N-ацетиласпартат (NAA), лактат (Lac). Величина химического сдвига пиков составляла: Cho — 3,24 ppm, Cr — 3,94; 3,03 ppm, NAA — 2,02 ppm, Lac — 1,33 ppm. В работе приведены абсолютные показатели метаболитов, а также их соотношения.
Для статистической обработки результатов применяли непараметрический метод, модуль ANOVA, анализ выживания Каплана — Майера. Статистический анализ выполнен в системе Statistica for Windows v. 10. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Общая характеристика метаболических изменений в ткани опухоли в зависимости от ее гистологической характеристики и степени злокачественности
Результаты исследования метаболитов в ткани опухоли в зависимости от гистологической характеристики представлены в таблицах 1, 2. Измерение их уровней проводили во всех вокселях, содержащих опухолевую ткань, и вычисляли среднее арифметическое значение в каждом отдельном случае. Это позволяло оценить нарушение метаболизма по всей ткани опухоли при ее неоднородности.
Таблица 1
Уровни основных метаболитов в ткани опухоли в зависимости от ее гистологической характеристики (M ± SD)
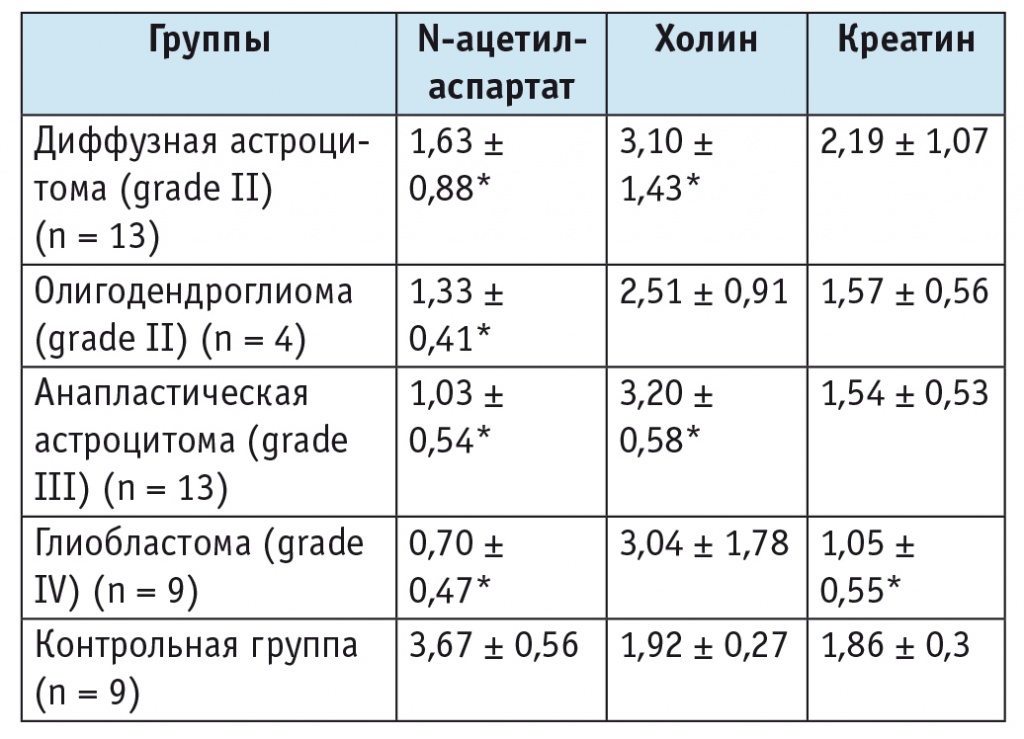
* Отличие от контрольной группы статистически значимо (p < 0,05; статистический анализ выполнен непараметрическим методом, модуль ANOVA).
Таблица 2
Соотношения метаболитов в ткани опухоли в зависимости от ее гистологической характеристики (M ± SD)
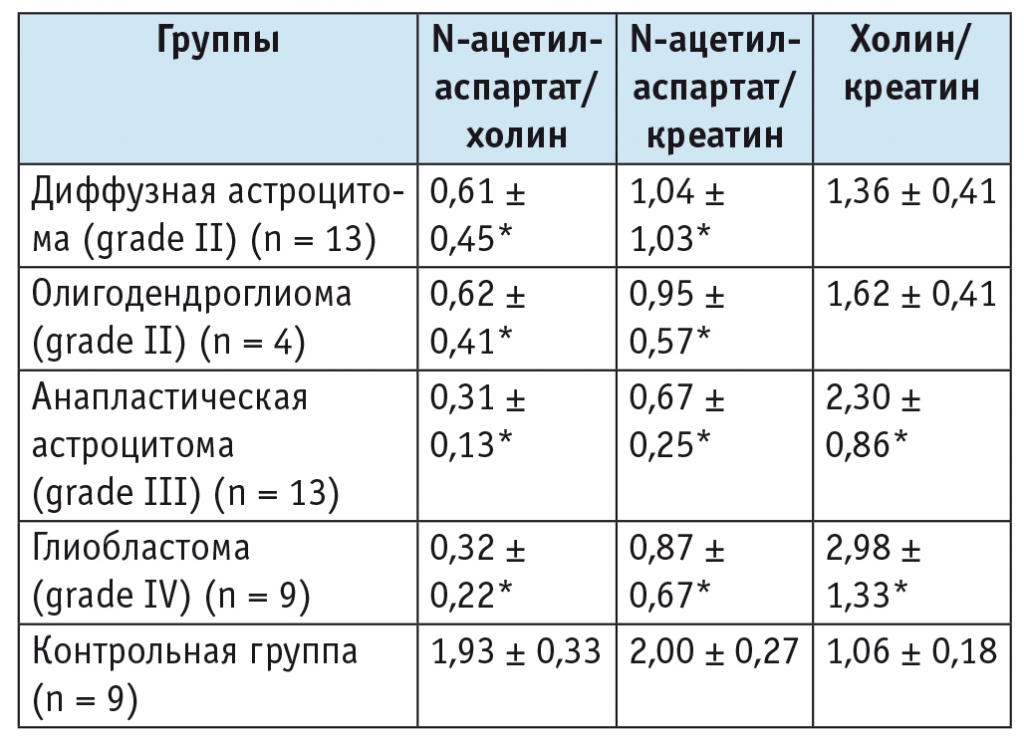
* Отличие от контрольной группы статистически значимо (p < 0,05; статистический анализ выполнен непараметрическим методом, модуль ANOVA).
Общей характеристикой опухолей стало существенное снижение уровней NAA и Cr и повышение уровня Cho (рис. 1). Уменьшение содержания NAA связано с непосредственным повреждением аксонов, дендритов и гибелью нейронов[5, 6]. Как показано в таблице 1, снижение концентрации NAA усиливалось с увеличением степени злокачественности опухоли (grade), что свидетельствует о росте пула поврежденных нейронов. С повышением степени злокачественности уменьшение уровня Cr становилось все более выраженным, что свидетельствовало о нарастании «энергетического дефицита» клеток.
Рис. 1. Больной Б., 41 год. Диагноз: диффузная астроцитома (grade II) левой лобной доли головного мозга. Магнитно-резонансная спектроскопия: А — в ткани опухоли; Б — в лобной доле противоположного полушария. Фото Лыткина М. В., Прокудина М. Ю. (2018)
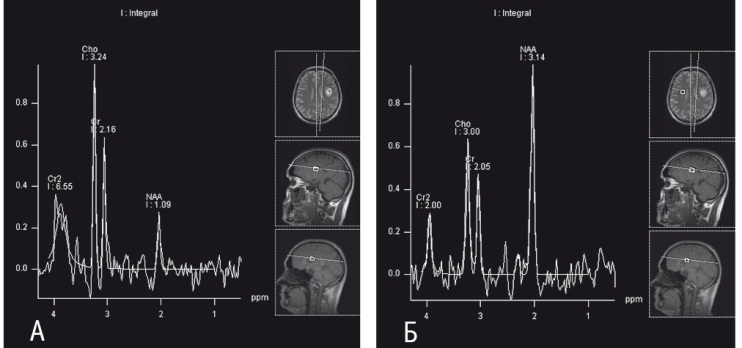
При астроцитомах с низкой (диффузные астроцитомы) и высокой (анапластические астроцитомы) степенью злокачественности в ткани опухоли наблюдается значительное увеличение содержания Cho. Это связано с повышенной проницаемостью мембраны клетки из-за пролиферации опухолевых клеток, разрушением клеточных мембран, высвобождением медиаторного пула Cho[7].
Помимо указанных нарушений, при опухолях наблюдается изменение соотношений изучаемых метаболитов (см. табл. 2). В частности, происходит статистически значимое уменьшение соотношений NAA/Cho и NAA/Cr у больных со всеми типами опухолей головного мозга в сравнении с участниками контрольной группы. Соотношение Cho/Cr значимо повышалось у больных с анапластическими астроцитомами и глиобластомами по сравнению со здоровыми людьми.
Степень злокачественности опухоли значимо нарастала с увеличением соотношения Cho/Cr, что согласуется с результатами А. В. [5, 6] и других авторов[8]. В группе больных с низко злокачественными глиомами (grade II) соотношение Cho/Cr составляло 1,42 ± 0,42. При возрастании степени злокачественности, в частности при анапластических астроцитомах (grade III), наблюдалось статистически значимое (по модулю ANOVA) увеличение соотношения Cho/Cr до 2,3 ± 0,86. Соотношения метаболитов у больных с глиомами разной степени злокачественности представлены в таблице 3. Получена тенденция к значимому различию между grade III и grade IV (табл. 4).
Таблица 3 Соотношения метаболитов у больных с глиомами разной степени злокачественности (M ± SD)
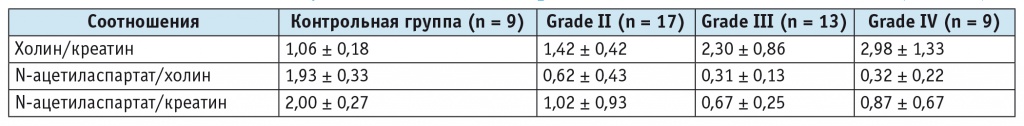
Таблица 4
Статистические показатели (значение p, непараметрическая статистика, модуль ANOVA) при опухолях различной степени злокачественности к соотношению холина и креатина
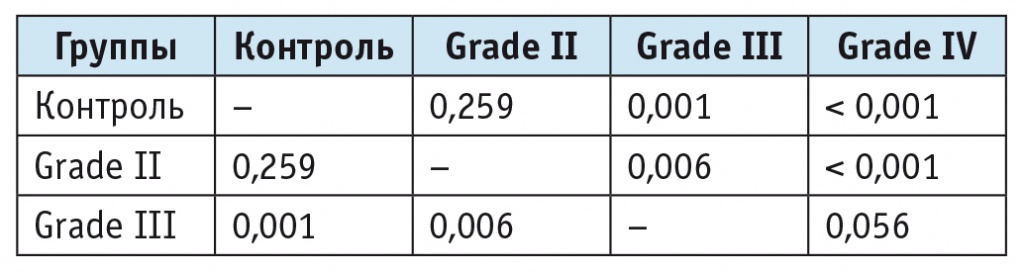
Соотношение NAA/Cho статистически значимо различалось у лиц с опухолями с низкой (grade II) и высокой (grade III, grade IV) степенями злокачественности. При этом существенных различий между grade III и grade IV не было (табл. 5).
Таблица 5
Статистические показатели (значение p, непараметрическая статистика, модуль ANOVA) при опухолях различной степени злокачественности к соотношению N-ацетиласпартата и холина
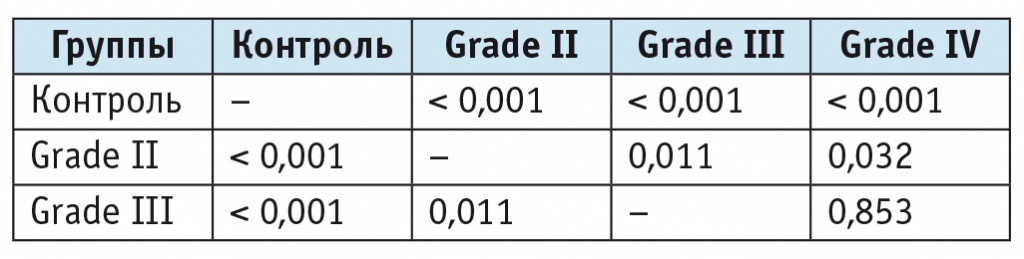
Соотношение NAA/Cr не имело значимых различий у пациентов с опухолями разной степени злокачественности.
Оценка связи между показателями метаболизма в ткани опухоли и длительностью безрецидивного периода и продолжительностью жизни
Нами оценены связи между показателями метаболизма в ткани опухоли и длительностью безрецидивного периода, а также продолжительностью жизни пациентов. В качестве неинвазивного биологического маркера рассматривалось соотношение метаболитов Cho/Cr. Больные были распределены на две группы — по верхнему квартилю Cho/Cr (UQ = 2,67).
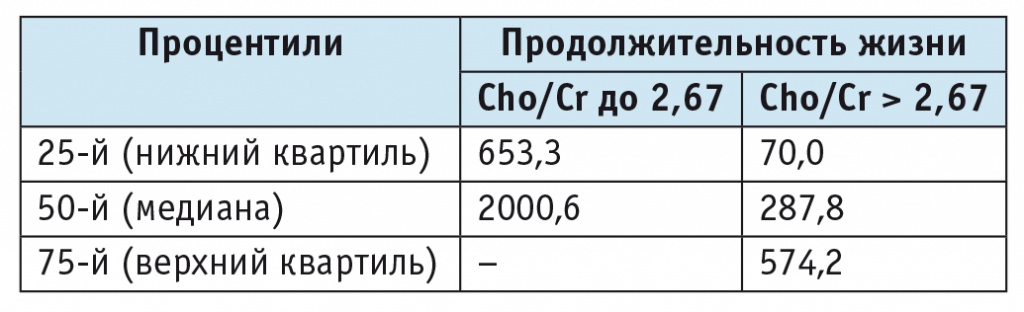
Получено статистически значимое (p < 0,05) различие в продолжительности жизни больных в зависимости от соотношения Cho/Cr (деление по верхнему квартилю) (рис. 2). Медиана выживаемости (50-й процентиль) в группе с Cho/Cr до 2,67 составила 2000,6 дня, с Cho/Cr, превышающим 2,67, — 287,8 дня (табл. 6).
Рис. 2. Продолжительность жизни у больных с глиомами головного мозга в зависимости от соотношения холина и креатина (UQ = 2,67)
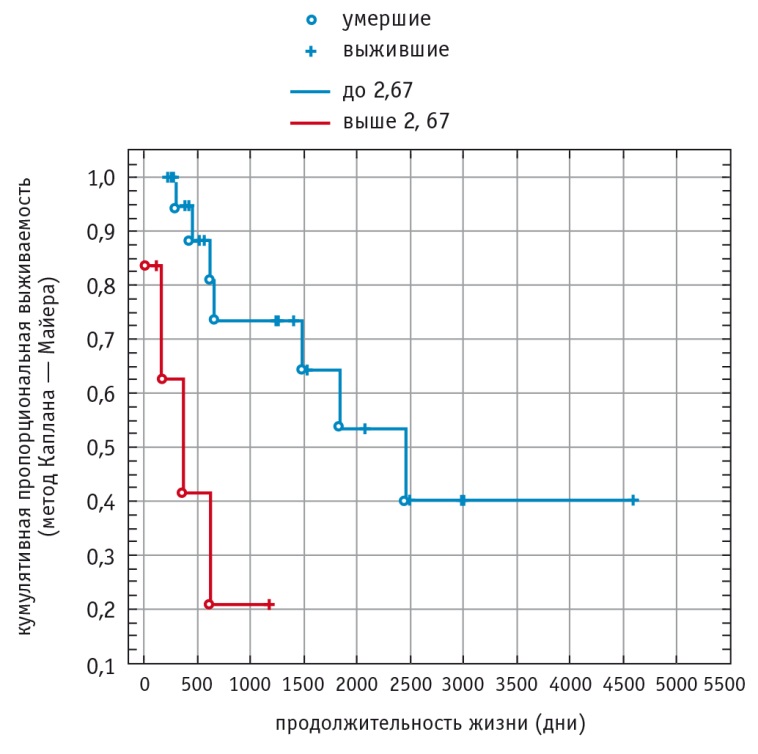
Таблица 6
Продолжительность жизни у больных с глиомами головного мозга в зависимости от соотношения холина и креатина (Cho/Cr) (UQ = 2,67), дни
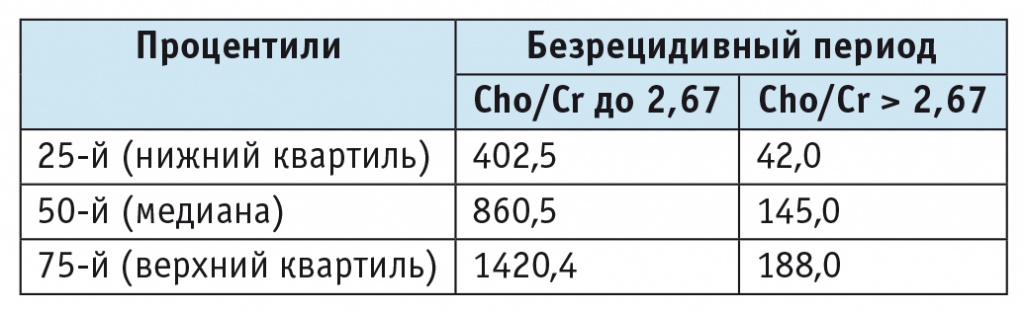
Обнаружено также значимое (p < 0,05) различие в длительности безрецидивного периода в зависимости от соотношения Cho/Cr (деление по верхнему квартилю) (рис. 3). Длительность безрецидивного периода (50-й процентиль) в группе с Cho/Cr до 2,67 составила 860,5 дня, с Cho/Cr, превышающим верхний квартиль, — 145 дней (табл. 7).
Рис. 3. Продолжительность безрецидивного периода у больных с глиомами головного мозга в зависимости от соотношения холина и креатина (UQ = 2,67)
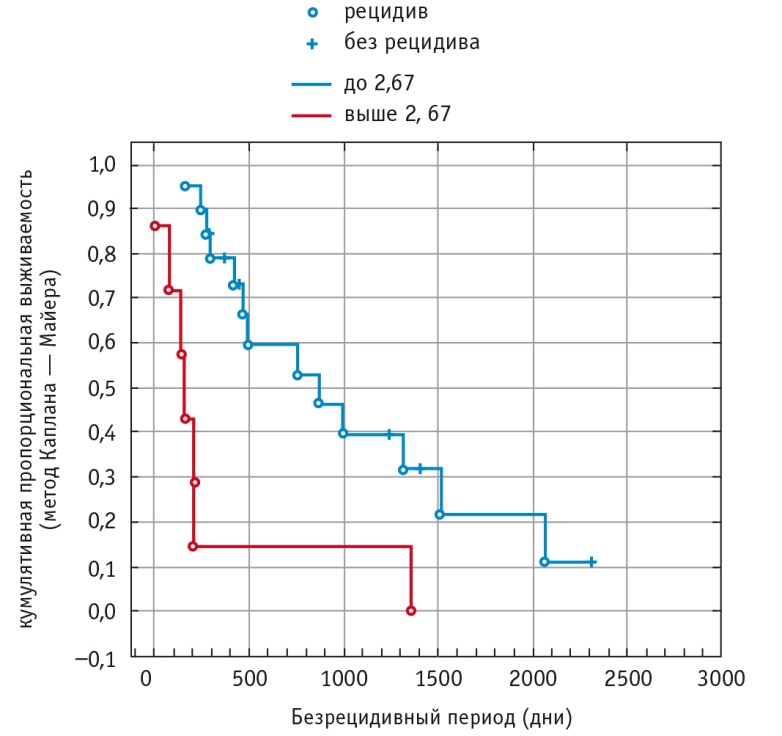
Таблица 7
Продолжительность безрецидивного периода у больных с глиомами головного мозга в зависимости от соотношения холина и креатина (Cho/Cr) (UQ = 2,67), дни
ОБСУЖДЕНИЕ
Проведение МР-спектроскопии и исследование метаболического профиля опухоли позволили выделить ряд неинвазивных биологических маркеров. Первая группа отражает степень злокачественности опухоли, вторая позволяет косвенным образом судить о длительности безрецидивного периода и продолжительности жизни.
Общими характеристиками опухолей головного мозга являются существенное снижение уровней NAA и Cr, повышение уровня Cho, изменение их соотношений (уменьшение NAA/Cho и NAA/Cr, рост Cho/Cr). Полученные результаты хорошо согласуются как с отечественными[7], так и с зарубежными литературными данными[9]. Проведение МР-спектроскопии позволяет провести дифференциальную диагностику между опухолевыми и неопухолевыми образованиями головного мозга: внутричерепными туберкулемами и высоко злокачественными глиомами[10], абсцессами и глиомами головного мозга[11, 12], лимфомами и высоко злокачественными глиомами головного мозга[13], процедивом и лучевым некрозом[14, 15].
Исследование метаболического профиля дает возможность дифференцировать опухоли головного мозга c разной степенью злокачественности. Низко злокачественные глиомы характеризуются относительно высоким содержанием NAA в сравнении с высоко злокачественными, что совпадает с результатами M. Bulik и соавт. (2013)[16]. При нарастании степени злокачественности снижаются уровни NAA и Cr.
Результаты наших исследований согласуются с работой А. В. Окользина (2007)[6], в которой показана возможность применения МР-спектроскопии для дифференциальной диагностики опухолей головного мозга с различной степенью злокачественности. Получена тесная статистически значимая связь между степенью анаплазии глиальной опухоли головного мозга (Grade II–IV) и соотношением Cho/Cr. С повышением степени анаплазии данное соотношение возрастает. При этом NAA/Cho статистически значимо различается при опухолях с низкой (grade II) и высокой (grade II, grade III) степенями злокачественности. Схожие результаты были получены L. Porto и соавт. (2011)[17].
Поиск прогностических факторов, определяющих продолжительность жизни и длительность безрецидивного периода, является актуальным. В работе Ю. Е. Анохиной и соавт. (2014)[18] была выявлена прямая связь между объемом резекции опухоли и длительностью безрецидивного периода и общей продолжительностью жизни у больных со злокачественными глиомами головного мозга. Симптомно-синдромальный анализ позволил оценить прогностическое значение неврологических симптомов у больных с глиальными опухолями[19]. Наименьшая продолжительность жизни отмечена в группе пациентов с речевыми нарушениями старше 60 лет вне зависимости от размера новообразования, наибольшая — в группе больных с судорожным синдромом в возрасте около 40 лет.
Работы, освещающие вопросы продолжительности жизни в зависимости от метаболических изменений в ткани опухоли и перитуморозной области, единичны. E. Roldan-Valadez и соавт. (2016)[20] получили статистически значимую связь (р < 0,028) между соотношением Cho/NAA и продолжительностью жизни. В нашем исследовании получена связь между Cho/Cr и длительностью безрецидивного периода и продолжительностью жизни пациентов.
ЗАКЛЮЧЕНИЕ
Установлено, что соотношение холина и креатина позволяет предположить степень злокачественности глиальных опухолей головного мозга. Оно может выступать также неинвазивным биологическим маркером, отражающим длительность безрецидивного периода и продолжительность жизни пациентов.








