ВВЕДЕНИЕ
Мигрень является тяжелым хроническим заболеванием и характеризуется приступами головной боли, которую отличают пульсирующий характер, выраженная интенсивность, усиливающаяся от стресса, усталости, физической нагрузки, и часто сопровождают тошнота, рвота, свето- и звукобоязнь[1–5].
Известно, что различные триггеры могут влиять на инициацию мигрени, а также обусловливать тяжесть течения разных фаз приступа[6]. Многие продукты и напитки провоцируют приступы мигрени, наиболее распространенными из них являются шоколад, сыр, цитрусовые и алкоголь[7]. По представленным данным, среди 500 лиц, страдающих мигренью, которые прошли анкетирование по поводу чувствительности к еде, 75% в качестве провоцирующего приступы фактора указали на шоколад, 48% — на сыр, 30% — на цитрусовые и 25% — на алкогольные напитки. У детей основными пищевыми триггерами были сыр, шоколад и цитрусовые[8–10].
Дети, как и взрослые, часто связывают головную боль со стрессом, при этом подростки, особенно девочки, являются более восприимчивыми к нему[11, 12]. Стресс и другие триггеры могут быть тесно связаны с приступами мигрени у восприимчивых пациентов, а тревога влияет на тяжесть, порог возникновения и частоту головных болей[13–15].
Мигрень часто встречается в детском возрасте, среди 10-летних детей ее распространенность достигает 5%[1]. До 11–12 лет мигрень чаще наблюдается у мальчиков, однако в пубертатном возрасте нарастает ее представленность у девочек, причем к 15 годам ее в 3 раза чаще выявляют в женской популяции[1].
С клинической точки зрения отличительными особенностями мигренозного приступа у детей являются малая длительность (от 30 минут до нескольких часов) и двусторонняя локализация головной боли. В критериях диагностики мигрени у детей продолжительность приступов определена в границах от 1 до 72 часов[1]. Характерный односторонний паттерн цефалгии в большей степени свойственен подросткам. У детей младшего возраста (5–10 лет) чаще отмечаются двусторонние боли в области лба (60,9%), в височной (38,67%) и периорбитальной зоне (53,17%). Часто у детей боль имеет сжимающий, сдавливающий характер с элементами пульсации[2].
Выявление особенностей мигрени в клинической практике у детей осложнено тем, что детям трудно описать характер, локализацию боли и наличие сопровождающих симптомов. Поэтому у пациентов детского возраста часто используют методы визуализации субъективных ощущений с помощью рисунков, шаблонов с градуированными оценками интенсивности боли и сопровождающих симптомов[4, 5]. Результаты исследований показывают также, что детские рисунки головной боли имеют высокую прогностическую ценность и помогают отграничить педиатрические головные боли немигренозного характера от головных болей, связанных с мигренью[16–18]. Полезность анализа детских рисунков в качестве дополнительного диагностического метода подтверждена несколькими сериями исследований в разных группах населения различных стран[19, 20].
Показано, что плохое психологическое здоровье опосредует связь между наличием хронических соматических заболеваний в детском возрасте и развитием депрессии позднее, — это указывает на необходимость выявления психологических особенностей на ранней стадии заболевания у ребенка[20, 21].
Наряду с изучением эпидемиологических, генетических характеристик мигрени у детей особую актуальность приобретает анализ аспектов, которые связаны с ее клинико-психологическими особенностями, вызывающими наиболее выраженные нарушения адаптации[22, 23]. Как показывает повседневная практика, приоритетным подходом в профилактике и лечении мигренозных цефалгий остается применение лекарственных средств, а поведенческая терапия ввиду недостаточной изученности остается вспомогательным лечебным методом.
Целью исследования явилось выявление особенностей психоэмоциональных характеристик пациентов детского и подросткового возраста с мигренью.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на базе Тамбовской областной детской клинической больницы с ноября 2019 по апрель 2020 г. За этот период из числа проходивших обследование и лечение в педиатрическом и психоневрологическом отделениях методом случайной выборки было отобрано 160 пациентов четырех возрастных групп: дошкольного (5–6 лет), младшего школьного (7–10 лет), среднего школьного (11–14 лет) и старшего школьного возраста (15–18 лет).
С учетом вариабельности профиля заболевания участников исследования разделили на две группы. В основную (I) группу были включены 80 детей и подростков, которые получали лечение в психоневрологическом отделении с жалобами на головную боль, отвечавшую критериям мигрени (G43.0, 43.1, 43.3, 43.8 по МКБ-10 в качестве основного или сопутствующего диагноза). Среди других патологий у участников этой группы отмечались невропатия лицевого нерва, головные боли напряжения, вегетативная дисфункция пубертатного периода и др. Группу сравнения (II) составили 80 пациентов детского и подросткового возраста, которые проходили лечение в педиатрическом отделении в связи с различными соматическими и неврологическими заболеваниями (сахарным диабетом I и II типа, гастритом, тахикардией, анемией, желудочковой экстрасистолией и т. д.) и не имели диагноза «мигрень».
Перед анкетированием родители или сами испытуемые, если они были старше 15 лет, подписывали форму информированного согласия на участие в исследовании. На вопросы анкеты отвечали родители, при анкетировании участников старше 15 лет — совместно подростки (в части описания головной боли) и родители. В рамках анкетирования в том числе осуществлялся сбор жалоб, анамнеза заболевания и жизни, семейного анамнеза, данных об особенностях течения раннего периода жизни ребенка.
Все испытуемые прошли комплексное клиническое и клинико-лабораторное обследование, стандартный неврологический и соматический осмотр. Во всех случаях были проведены ЭКГ, ЭЭГ, УЗИ органов брюшной полости, клинический и биохимический анализ крови (выбор показателей определялся индивидуально, в минимальный перечень входили уровни АСТ, АЛТ и глюкозы), общие анализы мочи и кала. По показаниям дополнительно проводились МРТ головного мозга, осмотр окулистом, консультация психолога.
В дальнейшем в рамках анкетирования участники исследования, получавшие лечение по поводу головной боли, под контролем клинического психолога прошли психодиагностическое обследование, при котором использовались:
– анализ рисунков, отражающих самочувствие испытуемого до, во время и после мигренозного приступа[19–22];
– шкала оценки влияния мигрени на повседневную активность (англ. Migraine Disability Assessment Scale — MIDAS) в адаптированном варианте для детского тестирования[22–24];
– визуально-аналоговая шкала (ВАШ) для оценки интенсивности боли — традиционная и со смайликами (у каждого участника применялись оба варианта шкалы)[25, 26];
– шкала Т.И. Балашовой для дифференциальной диагностики депрессивных состояний и других эмоциональных нарушений, а также оценки степени их выраженности (тестировались подростки старше 11 лет)[27];
– шкала ситуативной и личностной тревожности по тесту Спилбергера[28–30].
Для получения рисунков клинический психолог на начальном этапе предоставлял пациенту чистый, неразлинованный лист белой бумаги размера А4 и набор из 12 цветных карандашей. Затем ему предлагали нарисовать (спроецировать на рисунок) свои ощущения до, во время и после приступа мигрени, локализацию боли, что он делает при головной боли. Такие рисунки позволяют детальнее оценить психоэмоциональный статус детей с мигренью, свести к минимуму предвзятость и применение наводящих вопросов.
Шкала тревоги Спилбергера — Ханина (англ. State-Trait Anxiety Inventory — STAI) является способом самооценки уровней ситуативной, или реактивной, тревожности как состояния в данный момент и личностной тревожности как устойчивой характеристики человека. Результаты STAI оцениваются по суммарному количеству баллов: до 30 баллов — низкий уровень тревожности; 31–44 балла — умеренный уровень; 45 и более — высокий уровень тревожности[28–30].
Статистическая обработка данных проводилась в программном пакете STATISTICA 12.0 (США). Категориальные данные описывали с указанием абсолютных значений и процентных долей. Процентные доли при анализе четырехпольных таблиц сопряженности сравнивали с помощью критерия хи-квадрат (χ2) Пирсона (при значениях ожидаемого явления более 10). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критериев Шапиро — Уилка (при числе исследуемых до 50 включительно) и Колмогорова — Смирнова (при числе исследуемых более 50). Количественные показатели имели распределение, отличное от нормального, и описывались с помощью медианы и квартилей (Me [Q1; Q3]), в качестве статистического метода для оценки значимости их различий в исследуемых группах использовали критерий Манна — Уитни.
Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
В рамках исследования на базе психоневрологического и педиатрического отделений Тамбовской областной детской клинической больницы было обследовано 160 детей и подростков в возрасте от 5 до 18 лет, общая характеристика которых представлена в таблице 1.
Таблица 1
Общая характеристика участников исследования (n = 160)
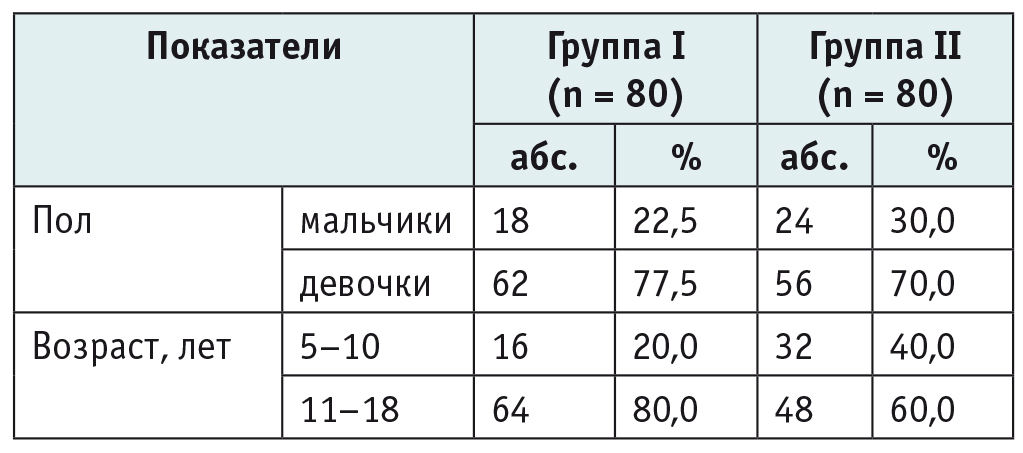
Примечание. I — основная группа, II — группа сравнения.
Как видно из этой таблицы, в обеих группах девочки превалировали над мальчиками и преобладали подростки в возрасте от 11 до 18 лет. Статистически значимых различий по возрасту и полу пациентов исследуемые группы не имели (p = 0,41).
По результатам анкетирования у участников I группы были обнаружены пищевые триггеры, которые могли влиять на патофизиологию мигрени, а также на течение одной или нескольких фаз мигренозного приступа: 8,75% (n = 7) указали на шоколад как на провоцирующий фактор; 7,5% (n = 6) — на голод; 5,0% (n = 4) — на кофе; 3,75% (n = 3) — на орехи; 2,5% (n = 2) — на сыр и 1,25% (n = 1) — на цитрусовые.
Полученные рисунки интерпретировались клиническим психологом индивидуально под каждого пациента, с учетом эмоционального состояния и особенностей рисования (таких как нажим карандаша, штриховка, цветовая гамма) (рис. 1). В данном тесте не имел значения уровень художественных навыков испытуемых — анализировалась именно субъективная оценка ими своих переживаний.
Рис. 1. Рисунки пациентов I группы с отражением ощущений до, во время и после приступа мигрени. Из архива авторов

Обработка рисунков позволяет заключить, что во время мигренозного приступа дети и подростки испытывают напряжение, связанное с болью. Участники исследования рисовали цветы, солнце, которое закрывает туча при приступе головной боли, себя, и во всех рисунках четко прослеживались негативные ощущения во время приступа мигрени. При этом в цветовой гамме отмечались скудные цвета — в основном серые, черные, синие, — что отражает подавленность, отверженность, эмоциональную отгороженность. Чрезмерная штриховка рисунков указывала на повышенную тревожность во время приступа мигрени. Рисунки, отражавшие ощущения после приступа, говорили о расслаблении, радости, приподнятом настроении, а одна девочка подписала, что после приступа она «очень расслаблена и хочет спать».
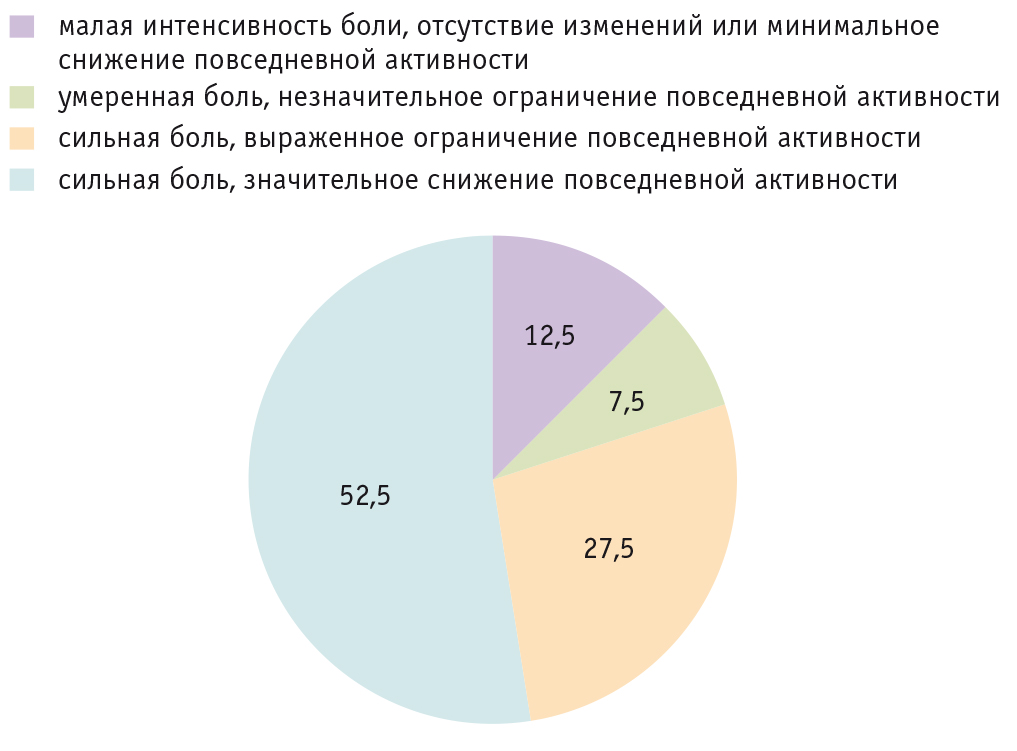
Далее для изучения влияния мигрени на повседневную активность пациентов использовали опросник MIDAS [22–24]. Степень влияния мигрени определяли путем подсчета баллов и оценки дезадаптации на основе их ранжирования. По полученным данным, большинство детей и подростков с мигренью (80%, n = 64) ощущают во время приступов сильную боль, что у 1/3 из них (n = 22) приводит к выраженному ограничению повседневной активности и у 2/3 (n = 42) значительно снижает повседневную активность (рис. 2).
Рис. 2. Результаты обследования пациентов I группы по опроснику MIDAS, %
Хорошо известно, что детям сложно вербализировать свои жалобы, а также оценить интенсивность боли с помощью обычной ВАШ от 0 до 10 баллов[25, 26]. Поэтому в рамках проведенного исследования для оценки интенсивности, локализации и характеристик головной боли участникам было предложено оценить испытываемую ими боль по двум вариантам ВАШ: традиционной шкале и шкале со смайликами — лицами с выражением различных эмоций. Смайлики варьировались от улыбающихся («нет боли») до грустных, со слезами на глазах («выраженная боль»). Чаще всего испытуемые выбирали смайлик, ассоциирующийся с болью средней интенсивности. Средняя оценка боли составила 5,9 балла (5 [4; 6]; min — 2 балла, max — 9 баллов).
Основным этапом исследования была оценка результатов психологического тестирования подростков старше 11 лет по шкале Т.И. Балашовой, позволявшая определить уровни депрессии в сравниваемых группах[27]. В анализ результатов тестирования вошли данные 64 пациентов основной группы и 37 пациентов группы сравнения. В ходе работы у 12 (18,7%) подростков I группы и 5 (13,5%) подростков II группы суммарные оценки составили от 50 до 59 баллов, что позволяло говорить о наличии у этих пациентов легкой депрессии ситуационного или невротического генеза. Статистически значимых различий по средним значениям шкалы Т.И. Балашовой в сравниваемых группах не выявлено (χ2 Пирсона, p = 0,783). Случаев клинически значимой депрессии в обеих группах не обнаружено.
Анализ по шкале STAI позволяет говорить о том, что в основной группе преобладала умеренная, а в группе сравнения — низкая ситуативная тревожность (табл. 2).
Таблица 2
Сравнительная характеристика уровней ситуативной и личностной тревожности
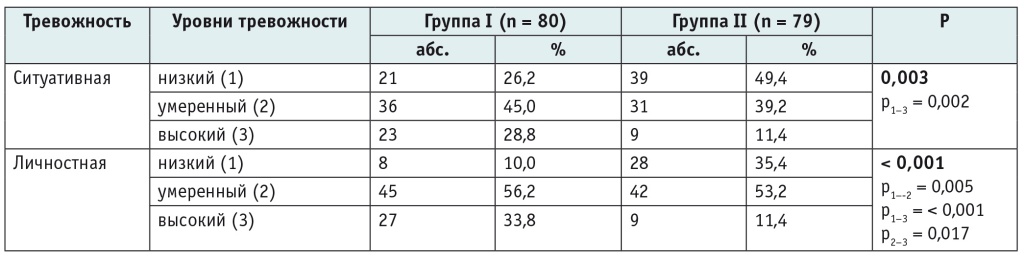
Реактивная (ситуативная) тревога, возникающая в условиях актуальной стрессовой ситуации, характеризуется субъективным дискомфортом, напряженностью, беспокойством и вегетативным возбуждением. Это состояние отличается неустойчивостью во времени и различной интенсивностью в зависимости от силы воздействия стрессовой ситуации. Таким образом, значение итогового показателя по данной подшкале позволяет не только оценить уровень актуальной тревоги испытуемого, но и определить, находится ли он под воздействием стрессовой ситуации и если да, то какова интенсивность этого воздействия на него. В основной группе количество пациентов с выявленной высокой ситуативной тревожностью (28,8%, n = 23) в 2,5 раза превышало данный показатель в группе сравнения (11,4%, n = 9) (p < 0,003). Кроме того, 33,8% (n = 27) участников I группы имели высокую личностную тревожность, тогда как среди обследованных II группы доля лиц с высоким уровнем личностной тревожности составила 11,4% (n = 9) (см. табл. 2).
В результате сопоставления показателей ситуативной и личностной тревожности в сравниваемых группах были выявлены статистически значимые различия (χ2 Пирсона, p = 0,003 и p < 0,001 соответственно) (см. табл. 2).
В ходе статистического анализа в I группе установлены статистически значимые различия между уровнем реактивной тревожности и оценкой интенсивности боли по ВАШ (p < 0,05), которые говорят о том, что при оценке уровня головной боли ребенок опирается на свое внутреннее психоэмоциональное состояние. В I группе достоверно коррелировали между собой влияние мигрени на повседневную активность, оцененное по шкале MIDAS, и уровень депрессии, определенный по методике Т.И. Балашовой (p < 0,05), что свидетельствует о значимости психоэмоциональных нарушений для симптомообразования мигрени у детей. При этом достоверной корреляции между результатами, полученными по шкалам MIDAS и ВАШ, выявлено не было[22–26].
Результаты психологического обследования показали, что тяжесть течения болезни оказывает существенное влияние на эмоциональное состояние ребенка, его представление о себе и самооценку, общительность и мотивационно-личностную сферу. Клинический анализ и динамическое наблюдение за пациентами I группы в отделении, а также оценка рисунков позволили выявить особенности их психоэмоциональной сферы, которые носят стойкий характер и коррелируют с характеристиками и тяжестью головной боли. В целом детей и подростков с мигренью характеризуют сужение мотивационно-потребностной сферы, чрезмерная фиксация внимания на вопросах лечения и выздоровления, что постепенно приводит к недостатку активности, отказам от деятельности и формированию безынициативности и бездеятельности. Это принципиально отличает их от лиц того же пола и возраста, не страдающих мигренью.
Психоэмоциональные нарушения у пациентов с мигренью оказывают значимое влияние на повседневную активность, что обусловливает необходимость их выявления и включения соответствующих терапевтических подходов в общую стратегию лечения заболевания.
ОБСУЖДЕНИЕ
В исследовании участвовали 160 детей и подростков в возрасте 5–18 лет. Основную группу составили 80 испытуемых с мигренью, группу сравнения — 80 испытуемых без жалоб на головную боль. В обеих группах преобладали девочки и было больше подростков в возрасте 11–18 лет, что соответствует данным эпидемиологических исследований[25, 28, 29].
В психоэмоциональном состоянии пациентов, которые находились на стационарном лечении по поводу головной боли, отмечены изменения в сравнении с группой без мигрени.
Рисунки участников основной группы свидетельствовали о негативных сдвигах в их эмоциональном состоянии во время приступа мигрени. Наши результаты показывают, что анализ детских рисунков — это простой, недорогой и неинвазивный метод, который может применяться в клинических условиях с целью дополнительной оценки психоэмоционального состояния детей.
По данным опросника MIDAS, большинство детей и подростков с мигренью (80,0%, n = 60) ощущают во время приступов сильную боль, что существенно сказывается на их повседневной активности[22–24].
Учитывая, что у 12 и 5 подростков I и II группы соответственно суммарные оценки составили от 50 до 59 баллов, можно говорить о наличии у этих пациентов легкой депрессии ситуационного или невротического генеза, статистически значимых различий сравниваемых групп по средним значениям шкалы Т.И. Балашовой не выявлено (χ2 Пирсона, p = 0,783). Подростков с клинически значимой депрессией в обеих группах не обнаружено[27].
Средняя оценка боли с применением традиционной ВАШ составила 5,9 балла, что соответствует боли средней интенсивности. Статистически значимые различия между результатами, полученными по MIDAS и ВАШ, отсутствовали[22–26].
Оценка уровня тревоги по шкале STAI свидетельствовала о низкой реактивной тревожности у 49,4% (n = 39) пациентов II группы в сравнении с 26,2% (n = 21) в I группе[28–30]. Высокая реактивная тревожность в I группе присутствовала у 28,8% (n = 23) обследованных, во II группе — у 11,4% (n = 9). Наряду с этим в основной группе почти в 3 раза чаще отмечалась высокая личностная тревожность: в 33,8% случаев (n = 27) против 11,4% (n = 9) в группе сравнения.
Результаты психологического обследования показали существенное влияние приступов мигрени на психоэмоциональное состояние испытуемых, что подтверждает необходимость комплексного подхода к лечению мигрени у детей и подростков с обязательным включением психологического обследования и анализа его результатов.
Данные настоящего исследования подтверждают роль поведенческих методов в лечении мигрени. Притом что профилактическое фармакологическое лечение является приоритетной стратегией при мигрени, у детей его эффективность остается низкой, применение же различных немедикаментозных методов, прежде всего поведенческой терапии, значительно повышает возможности лечения этих пациентов[31–41]. Поэтому поведенческие методы лечения, включающие в себя обучающие программы, техники контроля боли, глубокое диафрагмальное дыхание, прогрессивную мышечную релаксацию, программы управляемых образов, биологическую обратную связь, являются важной составляющей лечения детей и подростков[42–46]. Для разработки эффективных индивидуализированных стратегий нефармакологического лечения мигрени у пациентов детского и подросткового возраста требуется тщательный анализ особенностей их психоэмоциональной сферы.
ЗАКЛЮЧЕНИЕ
Результаты представленного исследования свидетельствуют, что приступы мигрени оказывают существенное влияние на психоэмоциональное состояние пациентов детского и подросткового возраста. Это обусловливает необходимость психологической поддержки детей и подростков с мигренью, особенно при наличии депрессии и тревоги.
Поступила: 14.09.2022
Принята к публикации: 03.10.2022








