ВВЕДЕНИЕ
Одними из осложнений бронхолегочной дисплазии (БЛД), которые определяют продолжительность жизни пациентов, являются легочная гипертензия, ассоциированная с БЛД (ЛГ-БЛД), и легочное сердце, вызывающие диагностические и терапевтические трудности.
Диагностическими критериями БЛД являются:
– недоношенность: гестационный возраст менее 32 недель;
– стойкое паренхиматозное поражение легких, подтверждаемое при исследовании газов крови (гипоксемия, гиперкапния) и проведении рентгенографии органов грудной клетки (снижение пневматизации, эмфизема, лентообразные уплотнения);
– потребность в инвазивной/неинвазивной ИВЛ, респираторной поддержке с CPAP, дотации кислорода через назальные канюли в 28 суток жизни и/или 36 недель постконцептуального возраста (ПКВ) с FiO2 > 0,21 в течение более чем трех последовательных дней для поддержания SpO2 в диапазоне 90–95% (исключая новорожденных, которым ИВЛ проводится по поводу первичного заболевания дыхательных путей или заболеваний, связанных с поражением дыхательного центра).
Диагноз БЛД может быть установлен на аутопсии у детей в возрасте с 14 дней жизни до 36 недель ПКВ в случае летального исхода, обусловленного стойким паренхиматозным поражением легких и дыхательной недостаточностью, которую нельзя объяснить другими неонатальными осложнениями[1, 2]. При морфологическом исследовании, помимо паренхиматозного поражения, фиброза и гипоплазии легких, могут быть обнаружены признаки ЛГ, например гипертрофия мышечного слоя сосудов. Изменения в сосудах легких при ЛГ-БЛД описаны в классификации D. Heath и J.E. Edwards, включающей шесть стадий[3]. По нашим данным, изменения, типичные для III–IV стадии ЛГ по этой классификации, у погибших новорожденных с БЛД, диагностированной на основании морфологических критериев заболевания, обнаруживаются уже в возрасте 14–21 суток.
В настоящее время БЛД рассматривают как гетерогенное заболевание, что обусловливает выделение его фенотипов, характеризующихся паренхиматозным поражением легких, заболеванием дыхательных путей, ЛГ[1, 2, 4]. В свою очередь, ЛГ при БЛД относится к варианту хронической ЛГ младенцев (ХЛГМ), который необходимо отличать от острой (персистирующей) ЛГ новорожденных (табл. 1).
Таблица 1
Патогенетическая классификация заболеваний, сопровождающихся хронической легочной гипертензией младенцев (по[5], с изменениями и дополнениями)
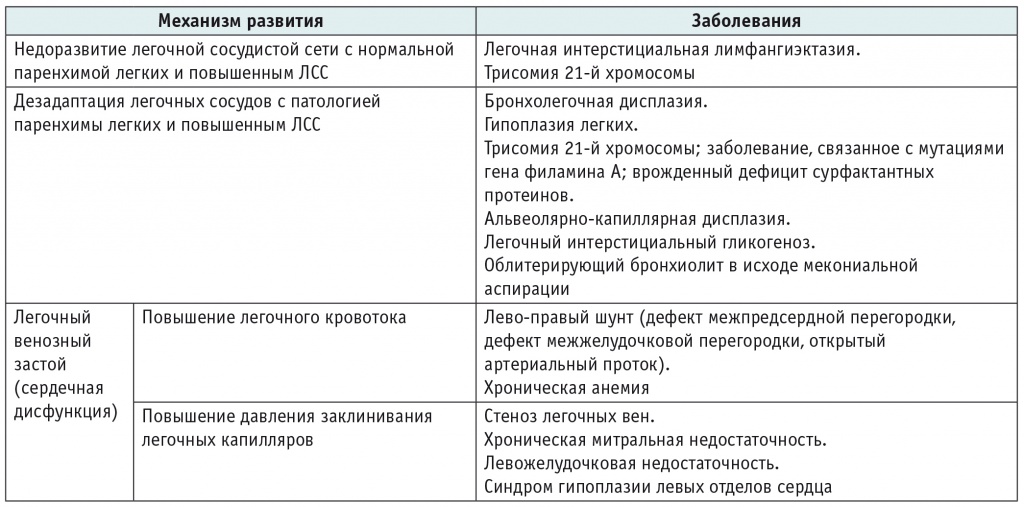
Примечание. ЛСС — легочное сосудистое сопротивление.
В соответствии с патогенетической классификацией гипертензивной сосудистой болезни легких у детей (Панама, 2011) ЛГ-БЛД расценивается как многофакторное заболевание: ее патогенез включает такие механизмы, как гипоплазия легочных сосудов, стеноз легочных вен, диастолическая дисфункция левого желудочка (ЛЖ), системно-легочные шунты (аортолегочные коллатерали, дефект межпредсердной и межжелудочковой перегородки, открытый артериальный проток), значительная гиперкапния и/или гипоксия[6]. По нашим наблюдениям, возможен вклад генетических факторов в развитие тяжелой ЛГ-БЛД, в ряде случаев фенотипически и гемодинамически сходной с изолированной (прежние названия: первичная, идиопатическая) легочной артериальной гипертензией (ЛАГ).
Цель статьи — приведение актуальной информации о легочной гипертензии, ассоциированной с бронхолегочной дисплазией, на основании отечественных и зарубежных согласительных документов, а также результатов собственных исследований.
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ
ЛГ определяется как среднее давление в легочной артерии (срДЛА) ≥ 25 мм рт. ст. у детей старше 3 месяцев (на уровне моря). Диагностическими критериями ЛАГ по результатам катетеризации правых отделов сердца (КПОС) служат срДЛА ≥ 25 мм рт. ст., давление заклинивания в легочной артерии ниже 15 мм рт. ст., индекс легочного сосудистого сопротивления более 2 единиц Вуда / м2.
Заболевания, сопровождающиеся ЛГ у детей, являются следствием поражения легочных сосудов и включают ЛГ, связанную с заболеваниями сердца, легких и системными заболеваниями, а также изолированную ЛАГ, которая диагностируется при отсутствии заболеваний левых отделов сердца или клапанов, паренхимы легких, тромбоэмболии либо других причин[7].
По тяжести ЛГ можно классифицировать, исходя из отношения систолического давления в легочной артерии (СДЛА) к системному систолическому артериальному давлению (ССАД): от 1/3 до 1/2 — легкая ЛГ; более 1/2 — 2/3 — среднетяжелая; более 2/3 — менее 1 — тяжелая (субсистемная); 1 — системная; более 1 — супрасистемная[8, 9].
Снижение SpO2 ниже 90–92% неминуемо ведет к спазму легочных сосудов, повышению легочного сосудистого сопротивления и развитию ЛГ. ЛГ при хронических заболеваниях легких считается основным патогенетическим фактором развития хронического легочного сердца. Легочное сердце (лат. cor pulmonale) — это ЛАГ, являющаяся следствием заболеваний, которые нарушают функцию и/или структуру легких, и приводящая к развитию гипертрофии и дилатации правого желудочка (ПЖ), со временем — к правожелудочковой сердечной недостаточности. Наиболее частой причиной cor pulmonale у младенцев является БЛД[10]. Поскольку гипертрофия и дилатация ПЖ при БЛД по мере роста ребенка в ряде случаев обратимы (в особенности на фоне терапии), употребление термина «хроническое легочное сердце» у пациентов с БЛД некорректно.
ХЛГМ — патологический процесс, характеризующийся ростом срДЛА выше 20 мм рт. ст., что обусловливает длительную повышенную постнагрузку на ПЖ с его последовательной гипертрофией и дилатацией[5].
ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА
Частота ЛГ у детей с БЛД составляет 21–52%[10–14], смертность при данном осложнении может достигать 20–50%[11, 15]. Заболевание чаще встречается при тяжелой БЛД. Как показали серии ЭхоКГ, распространенность ЛГ-БЛД снижается с 28,5% в 4–6 недель жизни до 17% в 40 недель ПКВ[13]. Согласно исследованиям, у 2–20% младенцев без БЛД, родившихся с гестационным возрастом менее 30 недель, развивается ЛГ, которая диагностируется в ходе ЭхоКГ в неонатальном периоде[11].
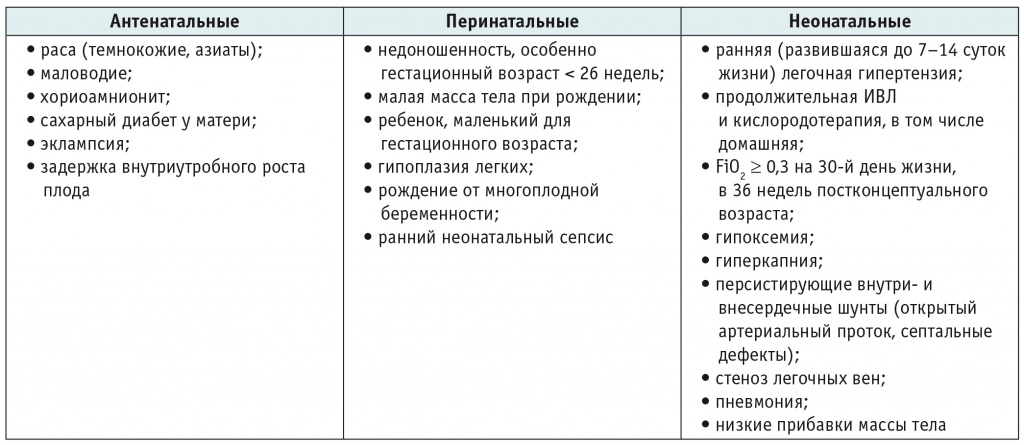
ЛГ-БЛД характеризуется замедлением и остановкой роста сосудов легких, облитерирующим ремоделированием прекапилляров[16]. Факторы риска ХЛГМ, наличие которых должно стать основанием для углубленного обследования, активного поиска ЛГ, представлены в таблице 2.
Таблица 2
Факторы риска развития легочной гипертензии у младенцев с бронхолегочной дисплазией[8, 10, 12, 13, 17]
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Клинические проявления ЛГ-БЛД включают тахипноэ, одышку, цианоз, кислородную зависимость и бронхообструктивный синдром, что трудно отличить от признаков основного заболевания легких. Дисфункция ПЖ в результате длительного воздействия повышенной постнагрузки проявляется симптомами правожелудочковой недостаточности (гепатомегалия, отеки, чрезмерное увеличение массы тела, трудности энтерального питания).
Оценка пациентов с ЛГ-БЛД должна начинаться с тщательного сбора анамнеза для выявления факторов риска (см. табл. 2). Идентификация ЛГ основывается на изучении клинических, биохимических (N-терминальный фрагмент прогормона мозгового натрийуретического пептида — NT-proBNP) маркеров, а также использовании инструментальных диагностических методов. Золотым стандартом диагностики ХЛГМ является катетеризация сердца, но инвазивный характер исследования не позволяет использовать его в целях скрининга и мониторинга ЛГ[5, 8, 10]. Показано, что дети первого полугодия жизни имеют наибольший риск осложнений[18]. В исследовании M.L. O'Byrne и соавт. в 1,4% случаев выполнение катетеризации сердца приводило к летальному исходу[19]; по другим данным, частота летального исхода или необходимости в экстракорпоральной мембранной оксигенации после проведения этой процедуры составила 3,5%, при этом у недоношенных детей риск был в 4,95 раза выше[20].
Катетеризация сердца, которая позволяет проводить прямое измерение давления в ПЖ и оценку легочной гемодинамики как исходно, так и в ответ на быстрые вазодилататоры, должна выполняться по строгим показаниям, обычно в тех случаях, когда эхокардиографических данных, подтверждающих ЛГ, нет, но клиническая картина указывает на ее возможность[1, 8, 10]. Проведение катетеризации сердца и теста на вазореактивность рекомендуется пациентам с БЛД для оценки возможного влияния на развитие ЛГ шунтов (дефект межпредсердной или межжелудочковой перегородки, открытый артериальный проток), стеноза легочных вен, диастолической дисфункции ЛЖ, аортолегочных коллатералей; с целью определения необходимости в дополнительной комбинированной медикаментозной терапии, особенно в системном применении простаноидов; в условиях клинического ухудшения и эхокардиографических признаков усугубления ЛГ или ухудшения функции желудочков[8].
Кислород является «препаратом выбора» для оценки реактивности сосудов легких. Если после 5–10-минутной ингаляции кислорода с FiO2 > 0,8 отмечается положительная (вазодилатационная) реакция, то никаких дальнейших медикаментозных тестов на вазореактивность не требуется[10]. Пробу с кислородом, как показал наш опыт, можно проводить и во время ЭхоКГ.
ЭхоКГ служит наиболее распространенным инструментом скрининга, используемым для первоначальной оценки недоношенных детей с риском развития ЛГ, а также долгосрочного наблюдения пациентов с ЛГ-БЛД. С его помощью можно выявить прямые и косвенные признаки ЛГ. К прямым признакам относятся повышения СДЛА и срДЛА.
При отсутствии обструкции выводного отдела ПЖ, стеноза клапана легочной артерии СДЛА рассчитывается по формуле:
СДЛА = 4 × TRJV2 + ДПП,
где TRJV — пиковая скорость трикуспидальной регургитации (максимальный систолический транстрикуспидальный градиент давления); ДПП — давление в правом предсердии.
Согласно данной формуле, к полученным значениям желудочково-предсердного градиента давления нужно прибавить показатель ДПП, который в норме равен 5 мм рт. ст., но при дилатированной нижней полой вене, коллабирующей на вдохе менее чем на 50%, составляет 10 мм рт. ст.[21, 22].
У многих грудных детей регургитация на трехстворчатом клапане недостаточна для точных и воспроизводимых измерений TRJV методом доплерографии и полученное значение не всегда позволяет надежно оценить давление в ПЖ. Так, в работе P.M. Mourani и соавт. при эхокардиографическом исследовании значение СДЛА удалось определить только в 61% случаев, при этом была отмечена слабовыраженная корреляция между результатами ЭхоКГ и катетеризации сердца[23]. В более позднем исследовании J.M. O'Leary и соавт. с участием 1262 больных, которым в течение 2 дней после КПОС проводилась ЭхоКГ, инвазивно подтвержденная ЛГ имелась у 47% пациентов без зарегистрированной TRJV против 68% — с зарегистрированной TRJV (p < 0,001)[24].
Наши собственные результаты КПОС у 7 больных с БЛД, которым до этого была проведена ЭхоКГ, подтверждают выводы о различиях в показателе СДЛА, измеренном разными методами. В отсутствие легочного стеноза или обструкции выводного тракта ПЖ СДЛА обычно равно систолическому давлению в ПЖ. При выраженной дилатации правых отделов сердца и недостаточности трикуспидального клапана давление между правым предсердием и ПЖ может выравниваться, при этом градиент давления между правыми отделами сердца снижается. В то же время СДЛА возрастает, однако это не определяется на ЭхоКГ. Таким образом, наши данные коррелируют с результатами исследований, показавших, что отсутствие трикуспидальной регургитации при легочном сердце не исключает даже выраженной ЛГ[22].
На основании эхокардиографических критериев определения СДЛА ЛГ, согласно рекомендациям Европейского общества кардиологов (англ. European Society of Cardiology) и Европейского респираторного общества (англ. European Respiratory Society) по диагностике и лечению ЛГ (2009), подразделяется на маловероятную, возможную и вероятную (табл. 3)[25].
Таблица 3
Критерии для оценки вероятности наличия легочной гипертензии[25]
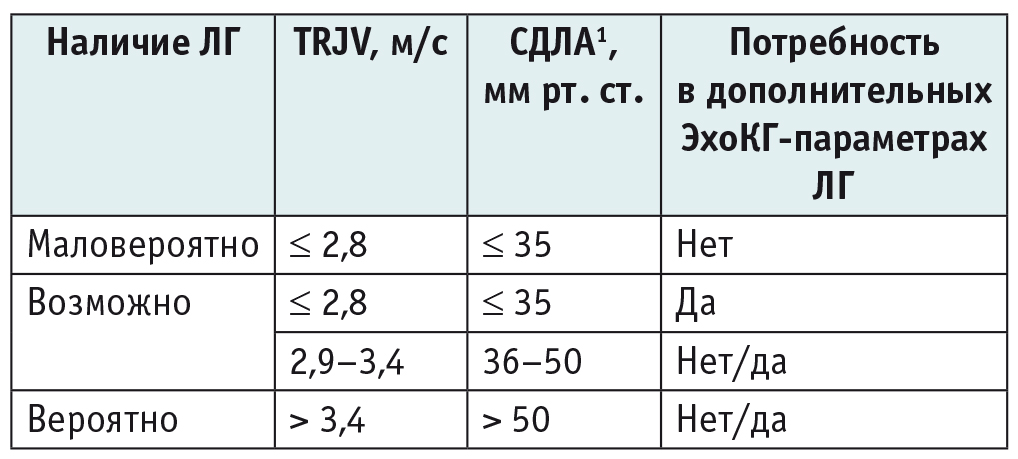
1 Приблизительные величины СДЛА (при условии, что давление в правом предсердии составляет около 5 мм рт. ст.).
Примечание. ЛГ — легочная гипертензия; СДЛА — систолическое давление в легочной артерии; TRJV — пиковая скорость трикуспидальной регургитации.
СрДЛА обычно выше 25 мм рт. ст. при СДЛА ≥ 40 мм рт. ст. Расчет срДЛА возможен на основании определения временны́х параметров систолического потока в легочной артерии и осуществляется по формуле A. Kitabatake[22]:
Lg(срДЛА) = –2,8 × (AT/ET) + 2,4,
где AT (англ. acceleration time) — время ускорения потока в выносящем тракте ПЖ; ET (англ. ejection time) — время выброса.
Вместе с тем достоверные данные о диагностической ценности описанного метода с измерением отношения AT/ET для выявления ЛГ-БЛД отсутствуют, показатель AT может различаться даже при проведении исследования одним специалистом, поэтому применение этого метода не рекомендуется[26]. Определение срДЛА данным способом у обследованных нами пациентов с БЛД было неинформативным в связи с большой погрешностью при плаче, беспокойстве ребенка во время проведения исследования.
К дополнительным (косвенным) эхокардиографическим признакам ЛГ относятся:
-
повышение скорости регургитации через клапан легочной артерии;
-
короткое время ускорения выброса из ПЖ в легочную артерию;
-
дилатация правых отделов сердца;
-
искривление и дискинезия межжелудочковой перегородки, что характеризует систолическую перегрузку ПЖ;
-
недостаточность легочного и трехстворчатого клапанов;
-
дилатация ствола легочной артерии;
-
наличие потока с низкой скоростью, двунаправленный или право-левый сброс крови через овальное окно, внутрисердечные шунты, открытый артериальный проток;
-
гипертрофия стенки ПЖ, межжелудочковой перегородки;
-
повышение индекса эксцентричности ЛЖ — соотношения перпендикулярного и параллельного перегородке диаметров ЛЖ;
-
повышение соотношения длительности систолы и диастолы над трехстворчатым клапаном.
Ряд перечисленных признаков носит субъективный характер, появляется на поздних стадиях заболевания, при тяжелой ЛГ, легочном сердце[13, 21, 22].
Наряду с функциональной оценкой ПЖ важна оценка систолической и диастолической функции ЛЖ. До 25% детей с ЛГ-БЛД могут иметь признаки диастолической дисфункции ЛЖ по данным катетеризации[27]. В условиях высокой потребности в назначении диуретиков в связи с отеком легких или при недостаточном ответе на ЛАГ-специфическую терапию необходима специальная оценка маркеров диастолической дисфункции ЛЖ, которая может явиться причиной посткапиллярной ЛГ[8].
По заключению экспертов по ЛГ-БЛД Сети по ЛГ у детей США и Канады (англ. Pediatric Pulmonary Hypertension Network — PPHNet) (2017), всестороннее эхокардиографическое исследование для скрининга ЛГ у недоношенных грудных детей должно включать как минимум: 1) полную оценку анатомических структур с целью выявления аномалий, шунтов и легочных вен; 2) оценку размеров ПЖ, ЛЖ, гипертрофии, систолической и диастолической функции; 3) изучение положения межжелудочковой перегородки в систолу и диастолу; 4) определение скоростей регургитационных потоков на трехстворчатом клапане и клапане легочной артерии; 5) одновременную регистрацию ССАД[8]. Наличие сброса крови справа налево указывает на супрасистемную ЛГ, в то время как двунаправленный шунт свидетельствует о системной ЛГ[17].
Ангиография в ряде случаев необходима для оценки анатомии и легочной гемодинамики, нарушения которой могут выражаться в повышении СДЛА как без увеличения, так и с ростом легочного сосудистого сопротивления[17]. ЭхоКГ не всегда позволяет установить наличие стеноза легочных вен[28].
Дифференциальная диагностика ЛГ-БЛД проводится с острой ЛГ новорожденных и ХЛГМ, не связанной с БЛД (см. табл. 1). При проведении КТ органов грудной клетки у длительно кислородо- или ИВЛ-зависимых младенцев за БЛД могут быть приняты дефицит филамина А и альвеолярно-капиллярная дисплазия, сопровождающиеся высокой ХЛГМ. Для их исключения целесообразно проведение генетического исследования, биопсии легких[29–32]. При подозрении на альвеолярно-капиллярную дисплазию, характеризующуюся ранним наступлением летального исхода, важно рано установить диагноз, чтобы избежать бессмысленного проведения экстракорпоральной мембранной оксигенации[33].
СКРИНИНГ
Существует ряд экспертных мнений о том, когда необходимо проводить скрининг ЛГ-БЛД[34].
Согласно заключению экспертов PPHNet, эхокардиографическое исследование с целью скрининга ЛГ должно выполняться: 1) при развитии тяжелой гипоксемической дыхательной недостаточности вскоре после рождения, обусловленной преимущественно персистирующей ЛГ новорожденных, несмотря на оптимальную терапию основного заболевания легких; 2) при сохраняющейся необходимости в ИВЛ на 7-й день жизни (фактор риска БЛД); 3) при сохраняющейся необходимости в респираторной поддержке в любом возрасте; 4) в 36 недель ПКВ[8].
Рекомендация проводить ЭхоКГ в 36 недель ПКВ (возраст установления диагноза или определения тяжести БЛД) присутствует во всех согласительных документах[1, 4, 7, 8, 34]. Однако к этому возрасту частота ЛГ-БЛД достаточно высока и составляет 9–29%[13, 17]. Поэтому у глубоко недоношенных детей с факторами риска может быть целесообразен скрининг ЛГ до 36 недель ПКВ[5]. Предлагается проводить первоначальный скрининг ЛГ в 32 недели ПКВ или 2 месяца жизни (в зависимости от того, что наступит раньше) у младенцев, родившихся с гестационным возрастом менее 28 недель, а также младенцев, все еще нуждающихся в ИВЛ/CPAP в возрасте 1–2 месяцев или с потребностью в FiO2 > 0,3[35].
Кроме того, младенцы без признаков заболевания легких в 36 недель ПКВ, но родившиеся с гестационным возрастом менее 28 недель или имеющие диагноз задержки внутриутробного роста плода, должны пройти скрининг в 36 недель ПКВ. При подтверждении ЛГ-БЛД ее последующая оценка будет определяться степенью и тяжестью фенотипа заболевания. Младенцы, у которых ЛГ-БЛД в 36 недель ПКВ не диагностируют, должны будут пройти повторную ЭхоКГ через 1–2 месяца при наличии персистирующих респираторных симптомов, постоянной потребности в кислороде, нарушении роста и/или питания, отсутствии улучшения состояния[17]. Безусловным основанием для проведения скрининга ЛГ-БЛД являются легочные гипертензионные кризы[9, 10, 36].
ТЕРАПИЯ
Лечение ЛГ-БЛД требует адекватной респираторной поддержки и назначения легочных вазодилататоров, смягчающих последствия повышенной постнагрузки на ПЖ. У младенцев с тяжелой ЛГ-БЛД, которым требуется ИВЛ, целесообразно использовать стратегию «открытых» легких, которая направлена на предотвращение несоответствия вентиляции и перфузии и обычно включает применение высоких дыхательных объемов (8–12 мл/кг) с длительными временны́ми паттернами (частота дыхания < 20 в минуту, время вдоха > 0,5 с.), чтобы преодолеть физиологическое мертвое пространство и улучшить вентиляцию областей с высоким сопротивлением в легких[4, 37].
Необходимо помнить, что к гипоксемии приводят гастроэзофагеальная рефлюксная болезнь, аспирация и/или трахеобронхомаляция. Последняя может встречаться у 60% недоношенных детей с ЛГ-БЛД[38]. Особое внимание должно уделяться профилактике респираторно-синцитиальной вирусной инфекции и гриппа, исключению воздействия табачного дыма. У младенцев, выписанных на дополнительной дотации кислорода, следует дождаться разрешения ЛГ по данным ЭхоКГ, а затем полностью отказаться от кислородотерапии[1, 8].
Терапия ЛГ основана на клеточных механизмах регуляции тонуса сосудов. В них участвуют: 1) оксид азота (NO) — растворимая гуанилатциклаза — циклический гуанилмонофосфат (цГМФ); 2) эндотелин; 3) простациклин. Отправной точкой для всех путей является введение кислорода — известного мощного легочного вазодилататора[10]. Кислородотерапию необходимо использовать для профилактики эпизодов или стойкой гипоксемии с целью поддержания SpO2 на уровне выше 92% при подозрении на ЛГ и выше 94–95% при подтвержденной ЛГ-БЛД[1, 8, 36, 39]. Тяжелая ЛГ может потребовать применения ИВЛ и наложения трахеостомы для профилактики тяжелой десатурации[4].
Фармакологическую терапию необходимо начинать у пациентов с признаками выраженного повышения легочного сосудистого сопротивления и правожелудочковой недостаточности (при выявлении гипертрофии и дисфункции ПЖ), которые не связаны с патологией левых отделов сердца или со стенозом легочных вен, венозной ЛГ[8]. Венозная ЛГ — противопоказание для ЛАГ-специфической терапии[10].
Согласно рекомендациям Европейской сети по педиатрическим легочным сосудистым заболеваниям (англ. European Paediatric Pulmonary Vascular Disease Network) 2016 г., лекарственная терапия ЛГ должна носить ступенчатый характер[36]. В качестве препарата первого выбора рекомендуется использовать силденафил — мощный селективный ингибитор цГМФ-специфической фосфодиэстеразы 5-го типа. Вопрос о его назначении может рассматриваться в случае, если 4-недельная кислородотерапия для целевого SpO2 более 95% при подтвержденной ЛГ не приводит к снижению СДЛА при контрольном измерении или, в соответствии с рекомендациями экспертов по ЛГ-БЛД PPHNet (2017), если СДЛА превышает 2/3 от ССАД[8, 36]. Силденафил применяется в стартовой дозе 1–1,2 мг/кг/сут в 3–4 введения per os. При отсутствии побочных эффектов (системная артериальная гипотензия, приапизм) доза силденафила под контролем ЭхоКГ может быть постепенно увеличена до достижения желаемых значений СДЛА; максимальная доза препарата, в соответствии с отечественными рекомендациями, составляет 8 мг/кг/сут[39].
При назначении силденафила рекомендуется постоянный контроль ССАД и уровня оксигенации, эффективность лечения позволяет оценить ЭхоКГ с определением СДЛА. Поскольку эффект от применения силденафила наступает уже через 15 минут после его приема, ЭхоКГ и коррекция дозы могут проводиться ежедневно. Терапия силденафилом приводит к улучшению SpO2 и эхокардиографических параметров у 80–88% пациентов с ЛГ-БЛД[12, 40].
При определенной по данным Эхо-КГ неэффективности терапии силденафилом в максимальной дозе через 4 недели от начала приема препарата, развитии побочных эффектов, повышении сывороточного уровня NT-proBNP рекомендуется применение ингибитора эндотелиновых рецепторов А и В бозентана. Препарат следует назначать в начальной дозе 2 мг/кг/сут в два приема на 4 недели с целью уменьшения риска нежелательного воздействия на печень. В последующем при отсутствии значимого (более чем троекратного) повышения уровня печеночных трансаминаз бозентан может применяться в постоянной поддерживающей дозе 4 мг/кг/сут в два приема в качестве монотерапии или в комбинации с силденафилом[1, 39]. Принципиальным является использование оригинальных препаратов. При трактовке повышения уровня NT-proBNP в сыворотке крови необходимо соблюдать осторожность, поскольку концентрация данного пептида может повышаться также при растяжении объемом крови левых отделов сердца, вызванном большим открытым артериальным протоком, и почечной недостаточности[17].
Через 4–6 недель применения бозентана при ухудшении состояния или отсутствии положительной динамики, подтвержденном результатами КПОС и вазореактивного теста, следующим шагом терапии является назначение ингаляций NO (iNO) в дозе 10–20 ppm[36]. iNO необходимо использовать при кризах ЛГ и отменять после стабилизации состояния. При отмене iNO может быть полезным проведение терапии силденафилом. После прекращения iNO выполняется мониторинг SpO2[8].
Cведения о применении у младенцев с ЛГ-БЛД агониста простациклина трепростинила ограниченны[41]. При клинической картине ХЛГМ до 36 недель ПКВ, когда артериальный проток все еще может оставаться открытым, может быть оправданным поддержание его проходимости при развивающейся недостаточности ПЖ[17].
При ведении пациентов с ЛГ-БЛД чрезвычайно важен междисциплинарный подход. Показано, что лечение ЛГ-БЛД многопрофильной командой неонатологов, пульмонологов, кардиологов, диетологов и специалистов по респираторной поддержке улучшает результаты, включая показатели выживаемости до выписки, койко-дня и увеличения массы тела у младенцев с БЛД[42].
Необходимо помнить, что младенцы с тяжелой ЛГ-БЛД имеют высокий риск регоспитализации в первые два года жизни, более высокую частоту таких респираторных заболеваний, как бронхиальная астма, бронхиолит или пневмония[43], отставание в физическом и когнитивном развитии[44].
ЗАКЛЮЧЕНИЕ
Представленный подход к ведению пациентов с легочной гипертензией, ассоциированной с бронхолегочной дисплазией (ЛГ-БЛД), основанный на принципах доказательной медицины и собственном опыте, может позволить улучшить диагностику и терапию рассматриваемого осложнения бронхолегочной дисплазии. Вместе с тем необходимы дальнейшие исследования, направленные на изучение естественного течения и влияния вмешательств для профилактики и лечения ЛГ-БЛД, а также накопление и анализ опыта реализации изложенного подхода в отечественном здравоохранении.
Поступила: 16.08.2022
Принята к публикации: 14.09.2022








