Cемейная средиземноморская лихорадка (CCЛ, периодическая болезнь) — наследственное аутосомно-рецессивное заболевание, характеризующееся периодически рецидивирующим серозитом и частым развитием амилоидоза. Ген, ответственный за развитие ССЛ (ген MEFV), локализован на коротком плече 16-й хромосомы. Подавляющее большинство мутаций расположено в экзоне 10, а также в экзонах 2 и 5. На сегодняшний день известно более 300 вариантов последовательностей гена MEFV[1].
ССЛ относится к орфанным заболеваниям, в мире им страдают более 100 тысяч человек, в основном представители народов средиземноморского бассейна (евреи-сефарды, турки, армяне, арабы). Частота носительства мутантных вариантов гена MEFV колеблется от 1 : 56 у арабов до 1 : 50 у евреев-сефардов и турок [2]. Последними тенденциями являются рост заболеваемости среди армянских детей [3] и увеличение количества случаев ССЛ по всей Европе (в частности, во Франции, Греции, Италии, Бельгии) из-за исторических и недавних миграций [4]. Фиксируется рост заболеваемости в Японии и странах Юго-Восточной Азии [2]. В Российской Федерации также наблюдается рост заболеваемости и носительства генетических мутаций [5].
Наиболее частыми клиническими проявлениями ССЛ у детей являются приступы лихорадки в сочетании с абдоминальными болями и артралгиями [3].
Некоторые исследования показали, что у взрослых пациентов с ССЛ абдоминальный болевой синдром сопровождается различными жалобами со стороны ЖКТ [3, 6]. Частым осложнением ССЛ является амилоидоз почек, ЖКТ и поджелудочной железы [6].
Цель исследования: изучить функциональное состояние поджелудочной железы во время и вне приступов семейной средиземноморской лихорадки, разработать терапевтический алгоритм коррекции нарушения функции поджелудочной железы при этом заболевании.
МАТЕРИАЛЫ И МЕТОДЫ
В гастроэнтерологическом отделении Университетской детской клинической больницы Первого Московского государственного медицинского университета им. И.М. Сеченова (заведующая отделением — к. м. н. Борисова Е.В.) под наблюдением находились 66 детей в возрасте от 4 до 18 лет (средний возраст — 10,2 ± 1,0 года) с генетически подтвержденной ССЛ. Ведущими клиническими проявлениями заболевания являлись лихорадка и абдоминальный болевой синдром. Среди больных было 40 (60,6%) мальчиков и 26 (39,4%) девочек; 39 (59,1%) детей находились в приступном периоде ССЛ, 27 (40,9%) детей — вне приступа.
При оценке степени тяжести ССЛ по критериям Tel HaShomer[7] у 21 ребенка (31,8%) выявлена умеренная степень тяжести, у 41 ребенка (62,1%) — средняя степень, 4 ребенка (6,1%) были с тяжелым течением болезни. Наиболее часто встречались компаунд-гетерозиготные (n = 26; 39,4%), гомозиготные (n = 24; 36,4%) и гетерозиготные мутации (n = 16; 24,2%). Средний возраст манифестации ССЛ составил 2,89 ± 0,59 года, у девочек и мальчиков он различался: 2,56 ± 0,39 и 3,20 ± 0,43 года соответственно.
Для изучения функционального состояния поджелудочной железы всем больным были проведены лабораторные исследования (определение уровней амилазы крови и мочи, панкреатической эластазы 1 кала, оценка результатов копрограммы по Н.Г. Плетневой и М.Ю. Денисову)[8] и УЗИ поджелудочной железы с прандиальной нагрузкой по патенту Г.В. Римарчук, С.И. Поляковой, А.В. Лебедевой [9].
Статистическая обработка данных выполнена с использованием компьютерной программы Microsoft Office Excel «Пакет анализа» (2013) и пакета прикладных программ SPSS 15.0. Критический уровень статистической значимости при проверке нулевой гипотезы считали равным 0,05.
РЕЗУЛЬТАТЫ
У обследованных больных ССЛ со стороны ЖКТ самыми частыми были жалобы на рвоту (n = 22; 33,3%) и разжиженный стул (n = 16; 24,2%). Реже отмечались жалобы на метеоризм (n = 1; 1,5%), изжогу и снижение аппетита (n = 2; 3,0%). У 19,7% больных (n = 13) в анамнезе имелись оперативные вмешательства на брюшной полости.
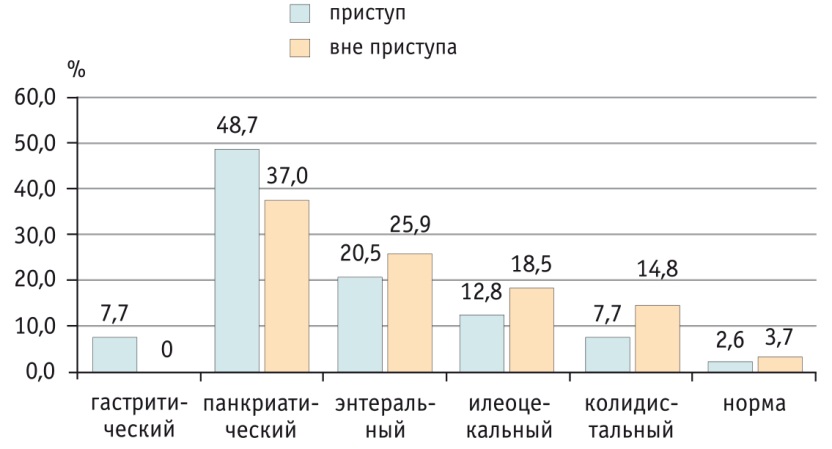
При оценке результатов копрограммы (рис. 1) обнаружена наибольшая частота панкреатического копрологического синдрома (при наличии в кале нейтрального жира, мышечных волокон, потерявших исчерченность, крахмала, перевариваемой клетчатки, йодофильной флоры): 48,7% случаев (19/39) при приступе, 37,0% (10/27) — вне приступа (р = 0,347). Копрограмму без отклонений от нормы имели лишь 2,6% детей (1/39) в приступном периоде и 3,7% (1/27) — вне приступа ССЛ (р = 0,790).
Рис. 1. Частота копрологических синдромов у больных семейной средиземноморской лихорадкой, %
Средние показатели амилазы крови и мочи представлены в таблице 1. Как показано в таблице, уровни амилазы крови вне приступа ССЛ были несколько выше, чем в приступном периоде (p > 0,05), показатели амилазы мочи у детей во время приступа ССЛ и вне его имели практически равные значения.
Таблица 1
Показатели амилазы крови и мочи у больных семейной средиземноморской лихорадкой во время и вне приступов, ед/л
| Показатели | Приступ (n = 39) | Вне приступа (n = 27) | P* |
| Амилаза крови | 64,5 ± 7,3 | 70,0 ± 10,5 | 0,489 |
| Амилаза мочи | 374,4 ± 63,8 | 371,4 ± 83,5 | 1,0 |
* Критерий Манна — Уитни.
Примечание. В таблицах 1–3 данные представлены в форме M ± m, где M — среднее значение, m — ошибка среднего.
В качестве более специфичного показателя функции поджелудочной железы был оценен уровень панкреатической эластазы 1 кала. У детей с ССЛ вне приступа отмечено более низкое содержание эластазы 1 в кале (398,84 ± 109,26 ед/л) по сравнению с детьми во время приступа (451,78 ± 62,64 ед/л, р = 0,345).
Для выявления влияния мутаций гена MEFV анализировались средние показатели амилазы крови и мочи, панкреатической эластазы 1 при гомозиготных, компаунд-гетерозиготных и гетерозиготных мутациях гена MEFV (табл. 2). Наиболее высокий уровень амилазы крови выявлен у детей с гомозиготными мутациями (р > 0,05). Наибольшая концентрация амилазы в моче отмечена в группе детей с компаунд-гетерозиготными мутациями, что также не являлось специфичным (р > 0,05).
Таблица 2
Средние показатели амилазы крови и мочи при различных мутациях гена MEFV, ед/л
| Показатели | ГЗ (n = 24) | КГТЗ (n = 26) | ГТЗ (n = 16) | P* | ||
| ГЗ/КГТЗ | КГТЗ/ГТЗ | ГЗ/ГТЗ | ||||
| Амилаза крови | 71,5 ± 5,5 | 64,5 ± 4,2 | 63,3 ± 6,2 | 0,461 | 0,815 | 0,534 |
| Амилаза мочи | 340,3 ± 34,5 | 420,6 ± 42,3 | 345,3 ± 54,5 | 0,173 | 0,228 | 0,772 |
* Критерий Манна — Уитни.
Примечание. В таблицах 2, 3: ГЗ — гомозиготы; КГТЗ — компаунд-гетерозиготы; ГТЗ — гетерозиготы.
Средний уровень панкреатической эластазы 1 кала в группе гетерозигот оказался ниже, чем у гомозигот и компаунд-гетерозигот (p > 0,05) (табл. 3).
Таблица 3
Уровни панкреатической эластазы 1 в кале при различных мутациях гена MEFV, мкг/г кала
| Показатель | ГЗ (n = 17) | КГТЗ (n = 23) | ГТЗ (n = 10) | ГЗ/КГТЗ | КГТЗ/ГТЗ | ГЗ/ГТЗ |
| Панкреатическая эластаза 1 кала | 437,6 ± 45,7 | 456,8 ± 41,8 | 384,4 ± 64,5 | 0,692 | 0,422 | 0,505 |
При анализе корреляционной взаимосвязи по Спирмену выявлена умеренная обратная связь между уровнями панкреатической эластазы 1 в кале и СОЭ (r = –0,352, p = 0,048).
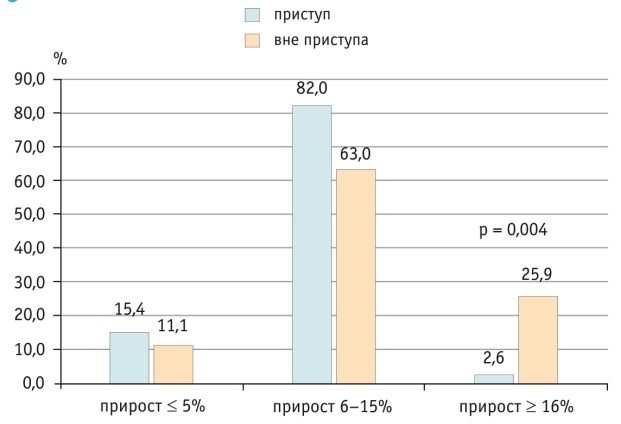
Всем больным было проведено УЗИ поджелудочной железы натощак и через 2 часа после завтрака c измерением ее размеров. Прирост размеров поджелудочной железы у больных ССЛ показан на рисунке 2. Как видно из рисунка, прирост на 16% и более, что являлось нормой, у пациентов вне приступа встречался статистически значимо чаще, чем у детей во время приступа (p = 0,004).
Рис. 2. Результаты ультразвукового исследования поджелудочной железы с прандиальной нагрузкой, %
«Золотым стандартом» лечения больных ССЛ является пожизненная терапия колхицином. В настоящее время активно изучаются возможности применения иммунобиологических препаратов. Немаловажным направлением является купирование абдоминального болевого синдрома. С этой целью 29 детям с ССЛ, сопровождавшейся изменениями в копрограмме, сниженными показателями панкреатической эластазы 1 и недостаточным приростом размеров поджелудочной железы по данным УЗИ, была проведена терапия микросферическим ферментным препаратом (панкреатин) в дозе 1000 ЕД/кг в течение 2 недель (26 детей) или одного месяца (3 ребенка).
Эффективность терапии оценивалась по уменьшению/исчезновению абдоминального болевого синдрома, наличию или отсутствию изменений в копрограмме, размерам поджелудочной железы по результатам контрольного УЗИ. В подгруппе детей с приступом ССЛ (n = 19) после курса заместительной ферментной терапии в 68,4% случаев прошли боли в животе (р < 0,001), у 52,6% пациентов нормализовались показатели копрограммы (р < 0,001), нормализация размеров поджелудочной железы по данным УЗИ произошла лишь в 10,5% случаев (р > 0,05). В подгруппе детей вне приступа ССЛ (n = 10) получены следующие результаты: абдоминальный болевой синдром купировался у 60,0% больных (р < 0,01), показатели копрограммы нормализовались также у 60,0% детей (р < 0,01), нормализации размеров поджелудочной железы по данным УЗИ удалось достичь у 10,0% пациентов (р > 0,05).
ЗАКЛЮЧЕНИЕ
У детей с семейной средиземноморской лихорадкой (ССЛ) часто отмечаются жалобы со стороны желудочно-кишечного тракта (рвота, разжиженный стул). В копрограмме как для приступного, так и для внеприступного периода характерны изменения по типу панкреатического копрологического синдрома. Средние показатели амилазы мочи и крови в различные фазы болезни практически не различаются. С помощью УЗИ с прандиальной нагрузкой выявлены изменения размеров поджелудочной железы во время приступа ССЛ. Для оценки экзокринной функции поджелудочной железы у детей с ССЛ целесообразно использовать копрологическое исследование в сочетании с УЗИ с прандиальной нагрузкой. При длительном течении ССЛ дополнительным показателем может быть панкреатическая эластаза 1 кала, значения которой несколько ниже у детей вне приступа ССЛ и у детей с гетерозиготными мутациями гена MEFV. Уровень СОЭ коррелирует с показателями панкреатической эластазы 1 в кале.
Терапия микросферическими ферментными препаратами в течение не менее чем 3 недель позволяет снизить проявления абдоминального болевого синдрома у больных ССЛ.








