Применение генно-инженерных биологических препаратов (ГИБП) в ревматологии революционным образом изменило результаты лечения пациентов с хроническими артритами, сделав возможным достижение ремиссии и восстановление подвижности суставов у пациентов на стадии болезни, которую расценивали ранее как необратимую. ГИБП селективно угнетают различные медиаторы воспаления, которые участвуют в аутоиммунных механизмах развития ряда системных заболеваний, что делает перспективным их использование при других ревматических болезнях.
Известно, что у детей склеродермия (СкД) является редким заболеванием: по некоторым данным, первичная заболеваемость ювенильной системной склеродермией (ССкД) составляет 0,05 на 100 000 населения, заболеваемость ювенильной ограниченной СкД — 1 случай на 100 000 населения [33, 34]. Ограниченные формы болезни у детей встречаются в 5–7 раз чаще системных [35]. Большинство детских ревматологов в настоящее время лечат ювенильную СкД с помощью иммунодепрессантов — глюкокортикоидов (ГК) и цитостатиков (метотрексата, циклофосфамида, микофенолата мофетила), которые позволяют остановить прогрессирование заболевания, добиться обратного развития фиброзного поражения кожи и подлежащих тканей. Однако существование форм болезни, торпидных к данному лечению, побуждает клиницистов использовать новые группы препаратов, а именно ГИБП.
Цель обзора: установить патогенетическое обоснование применения, оценить эффективность и показания к назначению ГИБП при СкД на основании результатов клинических исследований, представленных в мировой литературе.
Впервые ГИБП при ССкД применил в 2000 г. M. H. Ellman, использовав этанерцепт у больных с диффузной формой ССкД [15]. В 2006 г. в США появилось сообщение A. Adams об успешном применении ритуксимаба в сочетании с циклофосфамидом у 6 пациентов с ювенильной ССкД[3]. В настоящее время в литературе имеются сведения об использовании ГИБП различных классов — ингибиторов ФНО, моноклональных антител к CD20-антигенам В-лимфоцитов, антител к рецепторам ИЛ-2 и ИЛ-6, ингибиторам Т-клеток — более чем у 100 пациентов с различными формами СкД. Проведен ряд экспериментальных работ, результаты которых позволили дать патогенетическое обоснование использованию ГИБП при СкД.
В частности, in vitro показано, что ФНО-α обладает антифиброзным эффектом, дозозависимо угнетая синтез коллагена I и II типов, фибронектина фибробластами кожи. В исследованиях in vitro культуры фибробластов человека ФНО-α вызывал синтез матриксных металлопротеиназ (ММП), уменьшал продукцию их тканевого ингибитора. ФНО-α также стимулирует синтез коллагена фибробластами кожи и синовиальной оболочки, усиливает синтез ММП-2 легочными фибробластами. Индукция ММП под воздействием ФНО-α отмечена в кардиомиоцитах, кардиомиофибробластах, что подтверждает его участие в ремоделировании сердечной мышцы [25]. ФНО-α подавляет продукцию ФНО-β — главного медиатора фиброза при СкД [31, 32]. Таким образом, установлено, что ФНО-α выполняет антифиброзную функцию — либо путем угнетения синтеза коллагена фибробластами, либо разрушая его отложения. В то же время существуют работы, напротив, свидетельствующие о профиброзном действии ФНО-α. В исследовании in vitro показано, что ФНО-α вызывает образование легочных фибробластов с профиброзным фенотипом у мышей, усиливая тем самым синтез коллагена [30]. Разнонаправленные влияния ФНО-α на процесс фиброзообразования объясняют тем, что его про- или антифиброзный эффект реализуется в зависимости от степени активности воспаления [11, 17]. Поэтому предлагается использовать ингибиторы ФНО-α (иФНО-α) у больных с ранней, активной фазой воспаления.
У пациентов с ССкД отмечено повышение уровня ФНО-α сыворотки крови как при диффузной, так и при лимитированной форме болезни, выявлена положительная корреляция уровня ФНО-α и тяжести поражения легких [16].
Рандомизированные исследования по применению иФНО-α при ССкД отсутствуют. В нерандомизированном исследовании этанерцепт применяли у 18 больных ССкД с поражением суставов — улучшение достигнуто у 15 [20]. S. Bosello и соавт. лечили иФНО-α четверых больных ССкД с поражением легких и эрозивным артритом[7]. Через 6 месяцев терапии отмечены значительное уменьшение плотности кожи, заживление дигитальных язв и увеличение объема движений в суставах у всех больных. Сведений о функции легких на фоне терапии в статье нет.
В другом исследовании инфликсимаб в дозе 5 мг/кг использовали у 16 пациентов с диффузной ССкД и прогрессирующим поражением кожи [10]. Положительной динамики кожного процесса не отмечено. Выявлены нежелательные реакции в виде почечного криза и синдрома Рейно с дигитальной ишемией и язвами. У 5 пациентов появились антитела к инфликсимабу, что требует одновременного назначения метотрексата. В литературе есть указания на развитие быстропрогрессирующего легочного фиброза и смерти больных, получавших иФНО-α[4]. Наряду с этим существуют описания улучшения легочного процесса по функциональным показателям и данным КТ у больных с легочным фиброзом на фоне лечения иФНО-α[5].
Таким образом, имеющиеся результаты клинического использования иФНО-α противоречивы. Экспертным советом EUSTAR (The Eular Scleroderma Trials and Research) [12] не рекомендовано рутинное использование иФНО-α при СкД, поскольку не существует доказательств положительного влияния их препаратов на фиброзный процесс.
В настоящее время широко изучается роль В-лимфоцитов в патогенезе СкД. В биоптатах кожи больных СкД были обнаружены В-клетки, тогда как в коже здоровых людей они отсутствовали. В-клеточная инфильтрация выявлена при интерстициальном поражении легких [19]. У пациентов с СкД отмечено повышение числа В-клеток сыворотки крови. В-лимфоциты синтезируют аутоантитела к топоизомеразе, эндотелиальным клеткам, фибробластам, которые участвуют в патогенезе болезни. Существуют экспериментальные и клинические данные об участии В-лимфоцитов в повреждении кожи и легких, что обосновывает использование группы моноклональных химерных антител к CD20 в лечении СкД[8].
Было предпринято рандомизированное контролируемое исследование по оценке эффективности ритуксимаба в лечении ССкД с интерстициальным поражением легких [28]. Все пациенты имели диффузный вариант поражения кожи, были позитивны по антителам Scl-70, получали базисную терапию в предшествующие лечению 12 месяцев. Препарат применяли в дозе 375 мг/м2 еженедельно в течение 4 недель, затем повторяли курс через 24 недели. Восемь пациентов получали ритуксимаб, 6 — плацебо. В группе ритуксимаба у всех больных отмечено улучшение функции легких, тогда как у 5 из 6 пациентов, получавших плацебо, функция легких ухудшилась. Приведенное исследование продемонстрировало эффективность ритуксимаба при интерстициальном поражении легких. Аналогичные результаты были получены еще в трех неконтролируемых исследованиях с участием 32 пациентов с диффузным поражением кожи без тяжелых висцеритов. В двух исследованиях отмечено улучшение кожного процесса[6, 28], еще в одном изменений не выявлено [18]. В литературе нами найдено описание двух отдельных случаев улучшения функции легких после применения ритуксимаба [14, 21]. Интересно, что у больных, получавших препарат, отмечены снижение уровня ИЛ-6 сыворотки крови, уменьшение индекса активности кожного процесса и числа В-лимфоцитов, миофибробластов, гиалинизированного коллагена в биоптатах кожи[9, 28]. Подчеркивается также необходимость изучения роли дополнительной иммуносупрессии при лечении ритуксимабом.
В 2014 г. отечественные ревматологи опубликовали результаты применения данного препарата у 40 взрослых больных ССкД, у которых ведущим показанием к назначению ритуксимаба явилось торпидное к терапии интерстициальное поражение легких[2]. У 40% больных отмечен хороший эффект терапии в виде стойкого улучшения показателей легочной функции. Авторы исследования считают целесообразным назначение ритуксимаба не только при неэффективности стандартной терапии, но и в дебюте заболевания при высокой активности ССкД.
Заслуживает внимания опыт отечественных детских ревматологов Е. И. Алексеевой и соавт., которые использовали ритуксимаб у девочки с высокоактивной ССкД, рефрактерной к терапии ГК и цитостатиками[1]. Через 4 недели лечения авторы отметили уменьшение плотности и площади очагов СкД, к 24 неделям нормализовались иммунологические показатели активности болезни, была достигнута ремиссия заболевания.
ИЛ-6 — многофункциональный цитокин, который участвует в патогенезе ряда хронических заболеваний, вызывает острую фазу воспаления и оказывает профиброзное действие, стимулируя продукцию коллагенов и глюкозамингликанов. Многими исследованиями подтверждено участие ИЛ-6 в патогенезе СкД, его уровень повышен в плазме больных ССкД, при этом абсолютные значения ИЛ-6 выше при диффузной форме по сравнению с лимитированной формой и при поражении легких [24]. Иммуногистохимические исследования биоптатов кожи больных СкД показали, что экспрессия ИЛ-6 в фибробластах и эндотелиальных клетках у них выше, чем у здоровых людей [17]. Концентрация ИЛ-6 в плазме коррелирует со степенью плотности кожи. Работы in vitro показали, что блокада ИЛ-6 антителами вызывает значительное снижение продукции проколлагена 1-го типа культурой индуцированных склеродермических фибробластов [22].
Клинический опыт применения тоцилизумаба при СкД в настоящее время невелик. Большой интерес представляет исследование Y. Shima, в котором данный препарат впервые применяли в терапии СкД [27]. Было проведено гистологическое исследование биоптатов кожи у двух взрослых пациентов с ССкД до и после использования препарата. У одного пациента помимо поражения кожи имелся интерстициальный фиброз легких, у другого — склеродермический почечный криз. В результате лечения отмечено улучшение функции почек у пациента с почечным кризом и не выявлено положительной динамики со стороны легочного процесса у больного с фиброзом. При этом у обоих пациентов значительно уменьшилась плотность кожи, увеличилась апертура рта, улучшилась подвижность суставов. В биоптатах кожи отмечены истончение коллагеновых волокон дермы, уменьшение числа миофибробластов, увеличение количества которых коррелирует с повышением плотности кожи. Таким образом, несмотря на отсутствие отчетливого влияния на висцериты при ССкД, получены морфологические подтверждения уменьшения плотности кожи под влиянием тоцилизумаба, не отмечено нежелательных лекарственных реакций.
В другом исследовании с участием 27 больных ССкД с рефрактерными суставным и миопатическим синдромами использовали тоцилизумаб у 15 и абатацепт у 12 пациентов [14]. После 5 месяцев лечения тоцилизумабом отмечено ослабление суставного синдрома у 10 из 15 больных; у 2 пациентов лечение было прекращено ввиду неэффективности. В группе абатацепта через 11 месяцев терапии у 6 больных лечение суставного синдрома признано эффективным. Клинические наблюдения свидетельствуют о способности тоцилизумаба уменьшать проявления кожного и суставного синдромов при ССкД [26].
Анализ имеющихся экспериментальных данных свидетельствует о значительной роли В-клеток и различных цитокинов в патогенезе СкД, что делает патогенетически обоснованным применение ГИБП в лечении этого заболевания. В настоящее время, по данным литературы, в мире имеется 23 клинических исследования по применению ГИБП при СкД [22]; в некоторых работах установлено их положительное влияние на кожный, суставной и легочный процессы. Позитивный опыт лечения ГИБП обнадеживает. В мире ведутся многочисленные клинические исследования, задачей которых является определить место ГИБП в лечении СкД.
Представляем собственный опыт применения ГИБП у ребенка с ювенильной СкД.
Больная З. К. поступила в Университетскую детскую клиническую больницу Первого Московского государственного медицинского университета им. И. М. Сеченова (далее — УДКБ Первого МГМУ им. И. М. Сеченова) в феврале 2012 г. с очагами синюшного цвета на лице, участком выпадения волос на голове, уменьшением правой половины носа, приступами судорог с потерей сознания.
Анамнез жизни. Девочка рождена от молодых здоровых родителей, беременность вторая. Роды самопроизвольные, в срок; вес — 3490 г, рост — 52 см. Раннее развитие по возрасту. Привита по возрасту, без реакций до настоящего заболевания.
Анамнез заболевания (рис. 1). Ребенок заболел в июне 2011 г. в возрасте 2 лет 10 месяцев, когда впервые появились слабость в левой руке, слюнотечение, неоднократная рвота. Второй приступ развился через месяц, сопровождался судорогами конечностей, кратковременной потерей сознания. При МРТ головного мозга в перивентрикулярном белом веществе в области переднего рога, задних отделов тела и заднего рога правого бокового желудочка визуализированы зоны измененного магнитно-резонансного сигнала, гиперинтенсивные в Т2 и FLAIR (Fluid-Attenuated Inversion Recovery, инверсия-восстановление с подавлением сигнала от воды) и изо-, гипоинтенсивные — в Т1.
Рис. 1. График анамнеза заболевания пациентки З. К. 5 лет. Диагноз: системная склеродермия
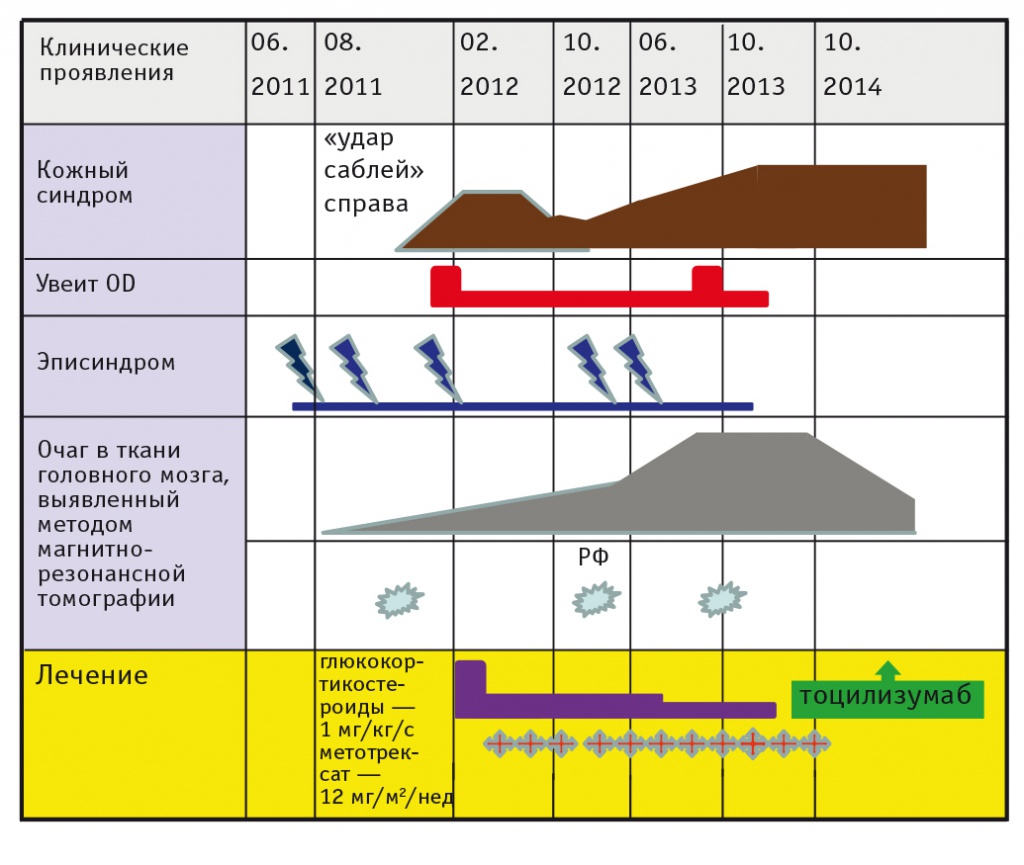
Состояние расценено как криптогенная фокальная эпилепсия, девочке назначен карбамазепин в дозе 16 мг/кг/сут, после приема которого приступы эпилепсии прекратились. Спустя 2 месяца отмечено появление очага на коже в виде синевы, затем уплотнения светло-коричневого цвета на лбу. Изменения на коже трактовались врачами как сосудистый компонент эпилепсии. В январе 2012 г. впервые обратили внимание на асимметрию лица, уменьшение правой половины лба, носа, уплотнение, блеск кожи в этом месте, а также участок алопеции в лобно-теменной области справа. Дерматолог заподозрил очаговую СкД. Изменения на коже постепенно увеличивались, одновременно разрастался участок алопеции на голове. В феврале 2012 г. возобновились приступы судорог с потерей сознания. Девочка была госпитализирована в неврологическое отделение, где при МРТ головного мозга был обнаружен очаг в белом веществе прежней локализации и размеров, при электроэнцефалографии (ЭЭГ) выявлена эпилептиформная активность. Тогда же диагностирован иридоциклит правого глаза.
Ребенок впервые госпитализирован в УДКБ Первого МГМУ им. И. М. Сеченова в феврале 2012 г. При поступлении состояние девочки расценено как среднетяжелое из-за приступов судорог, возникавших 2–3 раза в месяц.
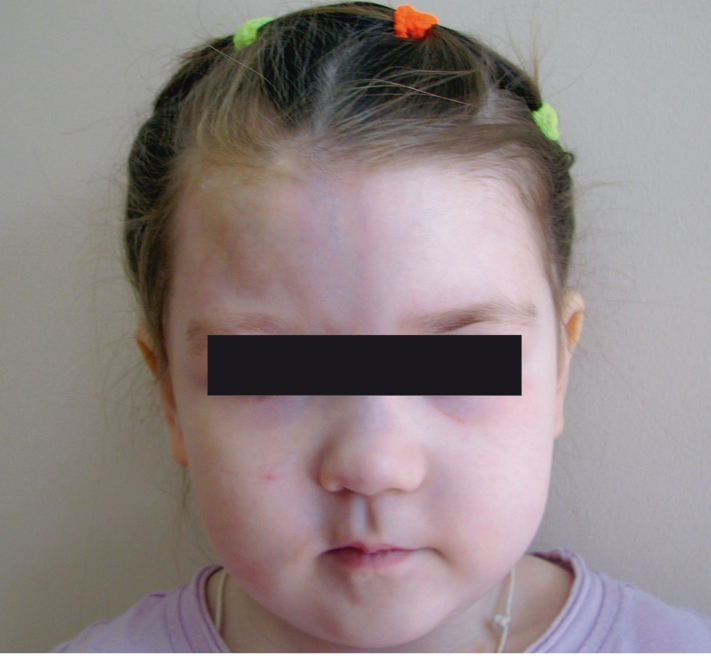
Вес ребенка при поступлении — 23 кг, длина тела — 103 см. В статусе — асимметрия лица: уменьшение половины лба, скуловой области, крыла носа, западение верхней губы справа. Отмечено незначительное западение внутреннего края глазной щели. В лобно-теменной области обнаружен линейный участок алопеции размером 8 × 3 см, сиреневой окраски с уплотнением и блеском; отмечены выпадение волос правой брови, интенсивное сине-фиолетовое окрашивание по спинке и правому крылу носа, блеск, истончение кожи (рис. 2).
Рис. 2. Внешний вид больной через 8 месяцев от начала болезни. Линейный очаг склеродермии в стадии эритемы и отека на лбу и спинке носа справа от срединной линии; участок атрофии на верхней губе справа. Фото авторов
При физикальном обследовании патологии со стороны внутренних органов не выявлено.
По лабораторно-инструментальным данным в общем анализе крови и мочи и биохимическом анализе крови патологии не обнаружено. Выявлены ревматоидный фактор — 48 МЕ/мл, повышение IgG до 1600 мг/дл; комплемент, антитела к кардиолипинам в норме; СРБ, антинуклеарный фактор, антитела к ДНК, антитела СКЛ-70, антицентромерные антитела не обнаружены. Эзофагогастродуоденоскопия выявила терминальный эзофагит, распространенный гастрит, обострение, гипотонию пищевода. При рентгенографии легких патологии не обнаружено. При УЗИ внутренних органов выявлены лабильный перегиб в средней трети желчного пузыря, незначительное увеличение размеров поджелудочной железы, эктопическая хорда в полости ЛЖ.
По заключению офтальмолога, у пациентки иридоциклит правого глаза, подострое течение, неполная ремиссия. Консультирована фтизиатром — противопоказаний к терапии цитостатиками нет.
Диагноз. ССкД с поражением кожи, подкожной клетчатки, костей лица и головы по типу «удар саблей» справа в стадии индурации и фиброза; поражение головного мозга (очаговые изменения в лобной и затылочной областях справа, вторичная эпилепсия с генерализованными приступами); иридоциклит справа; поражение ЖКТ (гипотония пищевода), подострое течение, активность 2-й степени. Невротические реакции. Дискинезия желчевыводящих путей.
Девочке была назначена терапия преднизолоном, в дозе 1 мг/кг/сут (25 мг/сут), который она получала в максимальной дозе в течение 10 недель, и метотрексатом — 10 мг/м2 (7,5 мг) в неделю. Пациентка продолжала получать противосудорожную терапию карбамазепином в дозе 300 мг/сут, фолиевую кислоту, препараты калия, кальция, антациды, местно нестероидные капли для глаз.
На фоне терапии отмечены уменьшение местной активности в очагах СкД, прекращение их роста, отсутствие приступов эпилепсии.
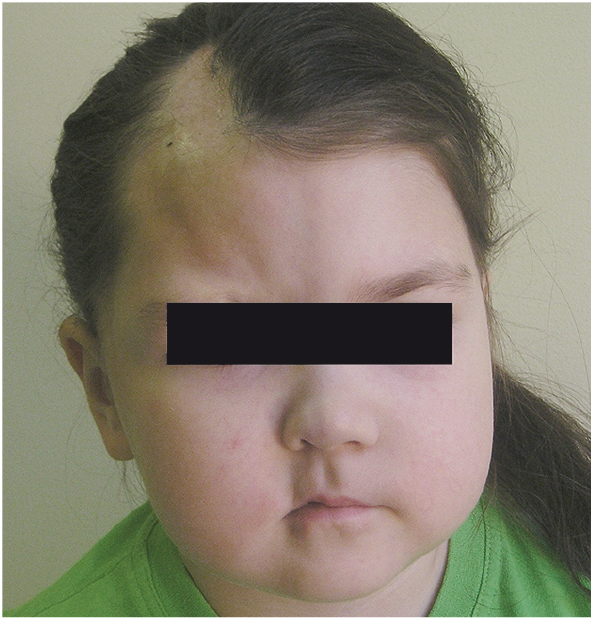
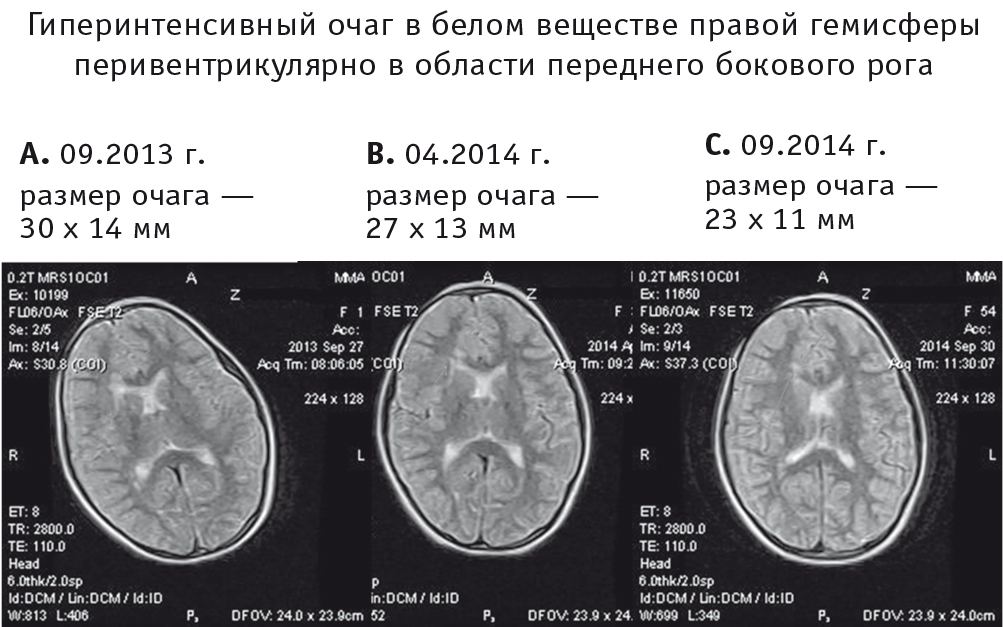
С апреля 2013 г. доза метотрексата была повышена до 12 мг/м2/нед (из расчета 10 мг/нед). В период с апреля по декабрь 2012 г. состояние девочки оставалось стабильным — кожный синдром не прогрессировал, эпилептических припадков не отмечалось, иридоциклит был вне обострения. Доза преднизолона постепенно была снижена до 5 мг/сут, метотрексат девочка получала в дозе 10 мг/нед с редкими перерывами из-за ОРВИ. Обострение заболевания отмечено с марта 2013 г., когда у пациентки вновь ежемесячно стали возникать эпилептические припадки. Проведено усиление противосудорожной терапии, карбамазепин заменен на вальпроевую кислоту и топирамат. Через 3 месяца у ребенка отмечены усиление индурации в очаге СкД в лобно-теменной области справа, нарастание атрофии правой половины лица (рис. 3). Спустя месяц развился рецидив иридоциклита справа, в связи с чем было начато местное лечение кортикостероидами. Еще через 2 месяца при МРТ головного мозга зафиксирован рост очага размером 30 × 14 мм в белом веществе в области переднего рога правого бокового желудочка. При лабораторном обследовании отмечено повышение уровня IgG и ревматоидного фактора. При инструментальном обследовании внутренних органов, сердца, легких, почек специфического для СкД поражения не выявлено.
Рис. 3. Внешний вид больной через 15 месяцев от начала болезни. Линейный очаг склеродермии в лобно-теменной области справа в стадии индурации и поверхностного фиброза, гиперпигментация, блеск кожи, выпадение волос, атрофия лица справа. Фото авторов
Учитывая отрицательную динамику заболевания, проявлявшуюся в виде прогрессирования кожного синдрома, гемиатрофии лица, рецидива иридоциклита, роста патологического очага в ткани головного мозга, несмотря на проводившуюся терапию, консилиумом врачей было решено начать применение тоцилизумаба в дозе 10 мг/кг в сочетании с метотрексатом (12 мг/м2/нед) и преднизолоном (5 мг/сут). Спустя трое суток отмечено уменьшение синей окраски кожи в очагах на лбу и носу, еще через двое суток кожа на голове в участке алопеции стала насыщенного розового цвета, что расценено нами как усиление кровотока в очаге СкД. Лечение тоцилизумабом продолжали в прежних дозах в течение последующих 14 месяцев. Преднизолон отменен полностью через 3 месяца от начала терапии тоцилизумабом, метотрексат — через 4 месяца в связи с плохой переносимостью препарата. Таким образом, на протяжении последующих 10 месяцев ребенок получал монотерапию тоцилизумабом.
Препарат вводили 1 раз в 4 недели в дозе 10 мг/кг в/в капельно в условиях стационара. Дважды с трехмесячным интервалом были пропуски инфузии в связи с респираторной инфекцией у ребенка; всего за 14 месяцев лечения тоцилизумаб вводили 12 раз. Девочка получала противосудорожную терапию двумя препаратами, местно на очаги применяли мази с регенерирующим эффектом. Ежемесячно проводили лабораторное обследование пациентки. После трех введений тоцилизумаба исчез ревматоидный фактор, отмечена положительная динамика по данным ЭЭГ. Весь период наблюдения у ребенка не было приступов судорог, обострений увеита, нежелательных лекарственных реакций. В апреле 2014 г. после 5 введений препарата при МРТ головного мозга отмечено небольшое уменьшение размера гиперинтенсивного очага, по сравнению с результатами исследования, проведенного в сентябре 2013 г. (до 27 × 13 мм).
После 12 инфузий тоцилизумаба (14 месяцев лечения) девочке выполнены полные клинико-инструментальное и лабораторное обследования с целью оценки результатов терапии и определения дальнейшей лечебной тактики.
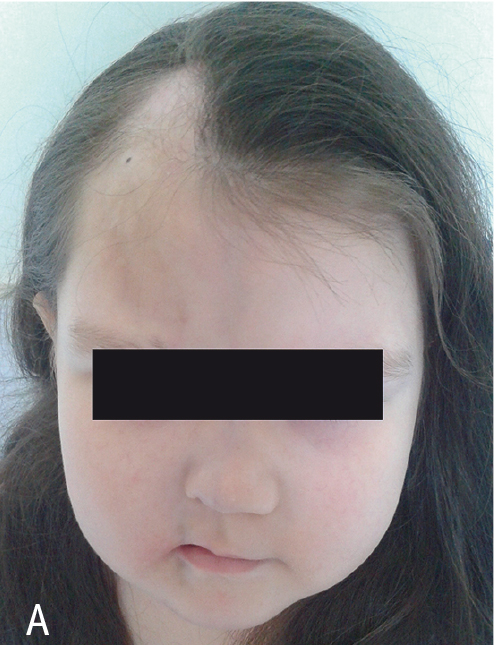
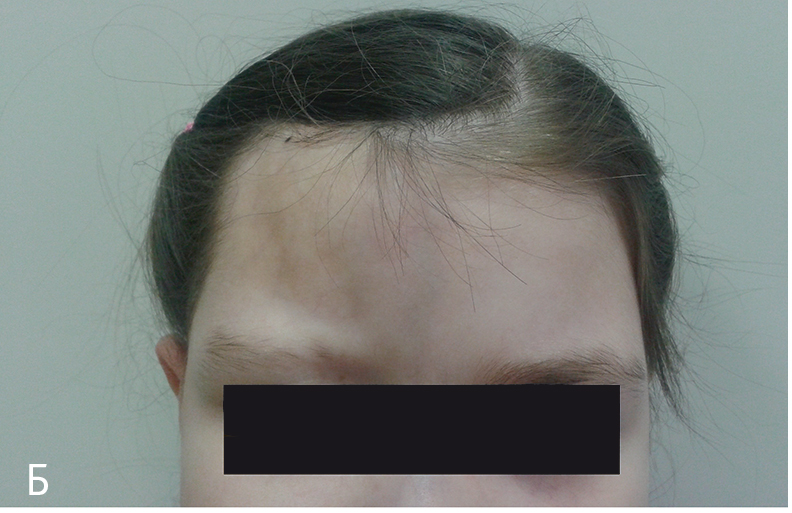
В статусе. Девочке 5 лет, вес — 32 кг, рост — 116 см. Состояние удовлетворительное, отмечали проявления медикаментозного синдрома Иценко — Кушинга. На коже лобно-теменной области справа был линейный участок алопеции с небольшим ростом волос в центре и по периферии очага, кожа очага местами имела поверхностный блеск, но собиралась в складку, участков уплотнения не было. Правая лобная область была несколько меньше левой по объему, отмечены гиперпигментация кожи с ее усилением к срединной линии, хорошая эластичность, индурации; фиброз не обнаружен. Имелись небольшое западение надбровной дуги справа, очаговое выпадение волос правой брови, уменьшение объема правой половины носа и мягких тканей в средней части носогубного треугольника и нижней губы справа, там же — вертикальный участок гиперпигментации кожи (рис. 4). Мимика сохранена, открывание рта — полное, асимметрии зубочелюстного аппарата и языка не было. Кожа и подлежащие ткани других участков тела не изменены. Лимфатический, опорно-двигательный аппараты в пределах возрастной нормы. Физикально со стороны внутренних органов патологии не выявлено.
Рис. 4. А — внешний вид больной через 14 месяцев терапии тоцилизумабом; Б — очаг склеродермии в виде поверхностной атрофии, появление роста волос, атрофия лица справа. Фото авторов
При обследовании в общем и биохимическом анализах крови, общем анализе мочи патологических отклонений обнаружено не было. Иммунологической активности болезни не выявлено. При инструментальном обследовании внутренних органов отмечали прежние малые аномалии развития сердца, желчного пузыря. Эзофагогастродуодено-скопию не проводили в связи с отсутствием жалоб и риском провокации эпилептического припадка. При ЭЭГ типичной эпилептиформной активности не зарегистрировано. При МРТ головного мозга от 30.09.2014 на аксиллярной томограмме в Т2-взвешенной последовательности отмечали положительную динамику в виде уменьшения размера гиперинтенсивного очага в периваскулярном отделе белого вещества правой лобной области до 23 × 11 мм. Контуры очага приобрели большую четкость, отмечена его однородная структура, масс-эффект не выражен. По заключению окулиста (29.09.2014) установлен подострый иридоциклит правого глаза, ремиссия.
Эффект лечения тоцилизумабом в приведенном наблюдении мы расцениваем как хороший, поскольку удалось прекратить распространение очага с захватом новых участков кожи и развитием атрофии подлежащих тканей и костей, зубочелюстного аппарата; рецидивов увеита, эпилептических припадков не было, отмечена положительная динамика по данным ЭЭГ.
Особого внимания заслуживает уменьшение размеров очага в ткани головного мозга на фоне терапии тоцилизумабом, документированное МРТ (рис. 5).
Рис. 5. Магнитно-резонансная томограмма головного мозга. Динамика уменьшения очага в белом веществе правой гемисферы в области переднего рога. Фото авторов
ОБСУЖДЕНИЕ
Линейная СкД по типу «удар саблей» часто протекает с поражением нервной системы, глаз (увеит).
По данным международного многоцентрового исследования, из 750 детей с СкД поражение ЦНС выявлено у 4,4%, поражение глаз — у 3,2% пациентов; при этом в группе линейной СкД по типу «удар саблей» поражения ЦНС и глаз выявлены у 18 и 14,2% детей соответственно [35]. Среди поражений ЦНС и глаз эписиндром и передний увеит занимают второе место после головных болей и фиброзных изменений век. Патогенез поражения головного мозга при СкД складывается из воспалительных изменений в стенке сосудов головного мозга и нейроглии. В немногочисленных работах по изучению биоптатов головного мозга указывают на присутствие периваскулярной лимфоцитарной инфильтрации с признаками васкулита, глиоза, склероза лептоменингеальных структур, формирования кальцинатов в паренхиме и сосудах мозга [29]. Описаны случаи одновременного развития у пациента одностороннего поражения глаз и очага в ткани головного мозга; согласно одной из гипотез, это может быть обусловлено тем, что у тканей лица и подлежащей паренхимы головного мозга имеется единый клеточный предшественник, раннее повреждение которого с одной стороны ростральной нервной трубки может вызвать впоследствии его одностороннее поражение [13]. Неврологические проявления СкД чаще развиваются после появления характерных изменений на коже. В работе F. Zulian представлено развитие эпилепсии у мальчика за 3 месяца до появления изменений на коже по типу «удар саблей» [23]. При МРТ головного мозга у пациента были выявлены участки гиперинтенсивного сигнала субкортикально в левой фронтальной доле во FLAIR- и Т2-взвешенном режимах. Лечение преднизолоном в дозе 1 мг/кг/сут в течение трех месяцев и метотрексатом в дозе 15 мг/м2/нед в течение 12 месяцев привело к ослаблению кожного синдрома, прекращению эпилептических припадков. При МРТ головного мозга отмечены уменьшение размеров очагов и образование в них кальцинатов. Автор рассматривает поражение кожи, головного мозга и эписиндром как проявления СкД, что подтверждается обратным развитием симптомов болезни на фоне иммунодепрессивной терапии.
В нашем наблюдении эписиндром и очаг в ткани головного мозга также развились до появления изменений на коже. Высокая степень активности СкД у нашей пациентки сопровождалась персистирующей иммунологической активностью, развитием увеита, отсутствием эффекта от базисной терапии. Применение тоцилизумаба позволило остановить прогрессирование болезни. Отмечены уменьшение размеров очага в головном мозге, прекращение судорожных приступов. По-видимому, в нашем наблюдении очаг в ткани головного мозга носил преимущественно воспалительный, а не фиброзный характер, что позволило уменьшить его размеры, воздействуя на активность иммунного воспаления. В доступной литературе нам не встретилось аналогичных наблюдений.
ЗАКЛЮЧЕНИЕ
Генно-инженерные биологические препараты (ГИБП) в последние 10 лет применяют при склеродермии (СкД) в случае торпидности к традиционной терапии, эти препараты оказывают положительное влияние на течение кожного, суставного и легочного поражений.
В нашем наблюдении лечение тоцилизумабом у ребенка с СкД по типу «удар саблей», увеитом и вторичным эписиндромом было начато поздно — спустя 2 года от начала болезни и через 6 месяцев от ее рецидива. По-видимому, при прогностически неблагоприятных вариантах СкД следует раньше использовать ГИБП. Такого мнения придерживаются Л. П. Ананьева и соавт.[2].
Детальная оценка эффективности терапии ювенильной СкД иммунодепрессантами позволит выявить маркеры торпидности к лечению и определить показания к назначению ГИБП по мере накопления опыта их использования при СкД.








