Несмотря на очевидную роль Th2-опосредованного воспаления в патогенезе бронхиальной астмы (БА), оно не может в полной мере объяснить ни возникновение заболевания, ни повышенную восприимчивость дыхательных путей больных к широкому кругу различных факторов внешней среды. Более того, известно, что применение мощных противовоспалительных средств (глюкокортикостероидов) позволяет контролировать симптомы БА, однако, по-видимому, не влияет на естественный ход заболевания [1–3]. В настоящее время предполагают, что большое значение в патогенезе БА имеют респираторный эпителий и нарушение эпителиального барьера [4, 5].
Одной из важнейших функций респираторного эпителия является мукоцилиарный клиренс, обеспечивающий неспецифическую защиту респираторного тракта. Уникальное свойство эпителия заключается в способности создавать непроницаемый барьер за счет формирования плотных межклеточных контактов. Последние сгруппированы в виде апикальных соединительных комплексов, которые состоят из взаимодействующих между собой белков (ZO-1–3, окклюдин, клаудин-1–5, β-катенины, Е-кадгерин и др.)[6].
Респираторный эпителий активно участвует в иммунных реакциях за счет цитокиновых взаимодействий с дендритными (антигенпрезентирующими) клетками, макрофагами, эозинофилами, нейтрофилами и Т-лимфоцитами [7–9]. Стойкое нарушение структуры и функции респираторного эпителия может привести к увеличению восприимчивости к респираторным инфекциям, выраженному и продолжительному иммунному ответу, формированию хронического воспаления [10].
Барьерная функция эпителия у больных БА нарушена за счет врожденного дефекта формирования плотных межклеточных контактов [11–13]. Нарушение формирования плотных соединений отмечено при культивировании биоптатов бронхиального эпителия, что указывает на врожденный характер таких дефектов [6, 12]. Имеются также данные о врожденных отличиях бронхиального эпителия больных БА от эпителия здоровых лиц по цитокератиновому профилю, у них наблюдаются усиленное высвобождение противовоспалительных медиаторов и сниженный синтез TGF-β1 [14]. Нарушение целостности эпителиального барьера и повышение его проницаемости играют важную роль в развитии сенсибилизации к аллергенам, так как способствуют более легкому контакту аллергенов с подэпителиальными антигенпрезентирующими клетками [15].
У больных БА отмечены следующие морфологические особенности респираторного эпителия: слущивание эпителиальных клеток; потеря клетками ресничек; гиперсекреция слизи; гипертрофия слизистой оболочки; гиперплазия клеток эпителия (при большой длительности заболевания нарастают явления атрофии и субатрофии); изменение формы эпителиальных клеток; исчезновение реснитчатой каймы; увеличение числа бокаловидных клеток [7, 16–18]. Морфологические изменения эпителия у больных БА выявляются и в слизистой носа, даже при отсутствии клинических признаков аллергического ринита (АР)[19].
При АР также наблюдаются изменения эпителия: метаплазия бокаловидных клеток; слущивание эпителия; снижение числа клеток с подвижными ресничками; потеря ресничек эпителиальными клетками; инфильтрация слизистой оболочки клетками воспаления; утолщение базальной мембраны [20].
Для эпителия больных БА характерно нарушение процессов репарации. Отмечается ускоренная, но некоординированная пролиферация клеток эпителия, что не позволяет восстановить нарушенный эпителиальный барьер [21, 22].
Верхние и нижние дыхательные пути представляют собой единое целое, имеют схожие строение и функции, а также механизмы развития патологических состояний [23]. БА и АР часто сочетаются [24]. До 40% лиц с АР больны БА, и до 85% больных БА страдают АР [25].
Поверхность респираторного тракта выстлана мерцательным (цилиарным) эпителием, состоящим преимущественно из реснитчатых, бокаловидных и базальных клеток. Реснитчатые клетки имеют на апикальной поверхности около 250 ресничек, которые продвигают слизь и осуществляют мукоцилиарный клиренс. Бокаловидные клетки секретируют слизь, базальные клетки являются недифференцированными. В норме соотношение бокаловидных и реснитчатых клеток в бронхиальном эпителии составляет 1 : 5. При хронических заболеваниях дыхательных путей это соотношение нарушается и преобладают бокаловидные клетки.
Реснички движутся координированно благодаря гидродинамическим взаимодействиям [26]. Движение ресничек на соседних участках слизистой оболочки несколько сдвинуто по фазе, что формирует метахронные волны [27]. Так как движению ресничек свойственен автоматизм, оно в течение некоторого времени продолжается и в биоптатах эпителия [28]. Регуляция частоты биения ресничек (ЧБР) зависит от количества АТФ, высвобождаемой клетками респираторного эпителия, и опосредуется через кальциевые каналы [29].
Мукоцилиарная недостаточность у больных БА формируется на ранних стадиях заболевания [30]. По данным динамической пульмоносцинтиграфии и исследования двигательной активности ресничек эпителия, у большинства взрослых больных БА имеются существенные нарушения мукоцилиарного клиренса, выраженность которых коррелирует со степенью тяжести заболевания [18, 30]. У 20% больных БА не удается выявить клетки с подвижными ресничками в биоптатах бронхиального эпителия [17, 30]. Мукоцилиарная недостаточность более выражена в стадии обострения БА и сохраняется, хотя и в меньшей степени, в состоянии ремиссии, что указывает на персистирование воспаления в дыхательных путях [31].
Угнетение двигательной активности ресничек эпителия при БА может быть связано с влиянием гистамина. М.Т. Луценко показал, что у больных БА на апикальном полюсе клеток мерцательного эпителия происходит накопление гистамина, которое приводит сначала к угнетению двигательной активности ресничек эпителия, а затем к повреждению клеточных мембран и потере клетками ресничек [32].
Важную роль в патогенезе БА играют интерлейкины — ИЛ-4 и ИЛ-13. Продемонстрировано, что хроническая стимуляция ИЛ-13 приводит к потере реснитчатых клеток, может блокировать дифференцировку базальных клеток в реснитчатые клетки и угнетать мукоцилиарный клиренс [33, 34]. Показано также угнетающее действие ИЛ-4 и ИЛ-13 на ЧБР эпителия [35].
Следует отметить, что в большинстве случаев мукоцилиарная система при БА изучалась у взрослых пациентов. Исследований цилиарного эпителия у детей с БА крайне мало, что определило актуальность нашей работы.
Цель исследования:
изучить особенности функционального состояния цилиарного эпителия у детей с бронхиальной астмой и аллергическим ринитом.
МАТЕРИАЛЫ И МЕТОДЫ
Открытое проспективное нерандомизированное сравнительное клиническое исследование проведено в период 2015–2017 гг. на базе Университетской детской клинической больницы и кафедры детских болезней лечебного факультета Первого Московского государственного медицинского университета им. И.М. Сеченова Минздрава России (заведующая кафедрой — д. м. н., профессор Н.А. Геппе).
Обследован 131 ребенок в возрасте 4–17 лет: 75 детей с БА в сочетании с АР, 20 детей с БА без сопутствующего АР, 19 детей с АР без сопутствующей патологии нижних дыхательных путей (основные группы), а также 17 детей без патологии дыхательной системы и лор-органов (контрольная группа) (табл. 1).
Таблица 1
Характеристика обследованных групп (n = 131)
| Параметры | БА + АР | БА | АР | Контроль |
| Количество детей | 75 | 20 | 19 | 17 |
| Возраст, лет, Me [Q1–Q3] | 11,0 [9,0–15,0] | 12,5 [7,3–15,8] | 10,0 [7,0–13,0] | 12,0 [10,0–13,0] |
|
Распределение по полу, n (%): • мальчики • девочки |
57 (76,0) 18 (24,0) |
14 (70,0) 6 (30,0) |
12 (63,2) 7 (36,8) |
11 (64,7) 6 (35,3) |
Примечание. В таблицах 1, 2: АР — аллергический ринит; БА — бронхиальная астма.
Критериями включения в основные группы являлись возраст пациентов от 4 до 17 лет и установленный диагноз БА и/или АР; критериями исключения были ОРВИ, перенесенная в предшествующие 4 недели, и оперативное лечение лор-органов, выполненное в 4-месячный период до исследования. В основные группы входили пациенты как в стадии обострения, так и в стадии ремиссии заболеваний. При отборе детей в группу контроля учитывались отсутствие острых и хронических заболеваний лор-органов и респираторного тракта, аллергических реакций и нормальные показатели ФВД.
БА диагностировали на основании жалоб, клинической картины, данных лабораторно-инструментального обследования. Тяжесть течения БА определяли в соответствии с рекомендациями Национальной программы «Бронхиальная астма у детей. Стратегия лечения и профилактика» и Глобальной инициативы по астме (англ. Global Initiative for Asthma) [36, 37]. Диагноз АР устанавливали на основании жалоб, клинической картины, данных риноскопии, лабораторного обследования.
Протокол исследования одобрен межвузовским комитетом по этике. Все пациенты или их законные представители подписывали форму информированного согласия на участие в исследовании.
Соскобы назального эпителия выполнялись оториноларингологом без применения анестезии с помощью стерильной пластиковой кюретки ASI Rhino-Pro (Arlington Scientific Inc., США). Эпителий получали с нижней носовой раковины, а при наличии анатомического доступа — также со средней носовой раковины. Полученные образцы эпителия незамедлительно помещали в пробирку с 0,9%‑ным раствором натрия хлорида. Исследование нативного неокрашенного эпителия проводили в течение первых 15–30 минут после забора материала при комнатной температуре (22–24 °C).
Двигательную активность цилиарного эпителия регистрировали методом цифровой высокоскоростной видеомикроскопии с помощью видеокомплекса, состоявшего из светового микроскопа «Биомед 6» (Биомед-сервис, РФ), цифровой высокоскоростной видеокамеры BMR-0440HC-UF (ЕС-Экспертс, РФ), компьютера с программным обеспечением MMC MultiMeter (MMCSoft, РФ). Микроскопию проводили при 400- и 1000-кратном увеличении (с масляной иммерсией). Оценивали относительное количество клеток с подвижными ресничками в пласте эпителия, синхронность биения ресничек, подсчитывали ЧБР.
ЧБР определяли при скорости съемки 50 кадров в секунду по формуле [38]:
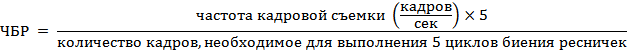
Подсчет ЧБР осуществляли не менее чем у 2–3 клеток в каждом из 10–15 полей зрения, выбирая клетки с максимально активными ресничками. Таким образом, для каждого пациента выполняли 20–45 измерений ЧБР.
Сахариновый тест проводили по общепринятой методике.
Статистическая обработка полученных результатов выполнена с помощью программы BioStat Pro 6.2.0.0 (AnalystSoft Inc., США). Непараметрические данные представляли в виде медианы (Me) и интерквартильного размаха [Q1–Q3]. Для сравнения двух групп использовали U-критерий Манна — Уитни, сравнение большего числа групп проводили с помощью теста Краскела — Уоллиса и критерия Данна. Для анализа качественных признаков применяли критерий хи-квадрат (χ2) Пирсона. Статистическую значимость результатов устанавливали при значениях р < 0,05.
РЕЗУЛЬТАТЫ
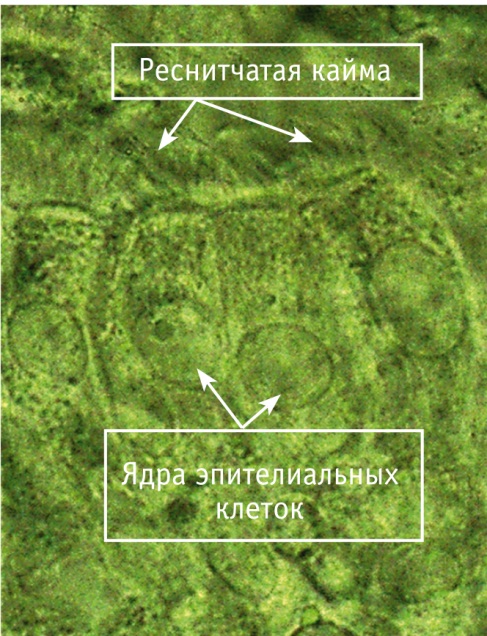
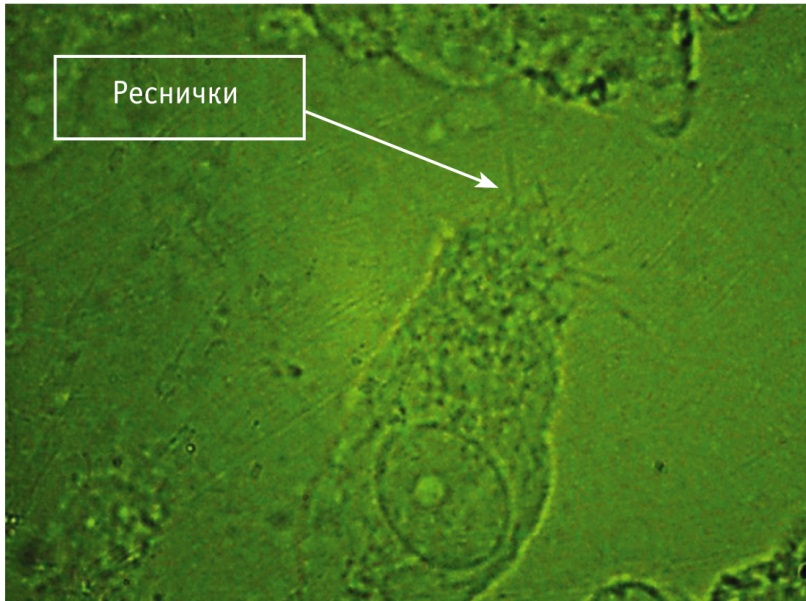
Длительность БА у обследованных детей составила 4,0 [1,0–9,0] года, длительность АР — 4,0 [1,0–8,8] года. Применение высокоскоростной цифровой видеомикроскопии позволило непосредственно визуализировать полученные образцы цилиарного эпителия и оценить функциональное состояние ресничек. При проведении световой микроскопии можно отчетливо различить клетки цилиарного эпителия, их реснички (рис. 1).
Рис. 1. Цилиарный эпителий. Световая микроскопия, ув. × 1000. Фото авторов
У детей с БА и c БА в сочетании с АР часто отмечались поля зрения без подвижных ресничек или сниженное количество клеток с подвижными ресничками. Нередко в препарате удавалось обнаружить лишь от 1 до 3 клеток с подвижными ресничками.
Наблюдалось большое количество слущенных клеток (рис. 2). Реснички на слущенных клетках часто располагались хаотично (рис. 3), были более редкими и поврежденными, чем в норме (рис. 4).
Рис. 2. Слущенные клетки эпителия с неподвижными ресничками. Световая микроскопия, ув. × 400. Фото авторов
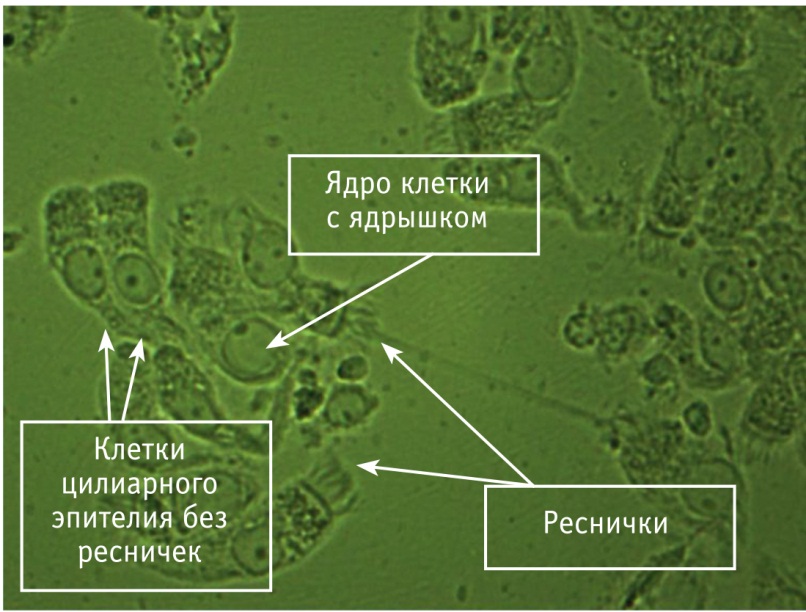
Рис. 3. Клетка цилиарного эпителия с хаотично расположенными ресничками. Световая микроскопия, ув. × 1000. Фото авторов
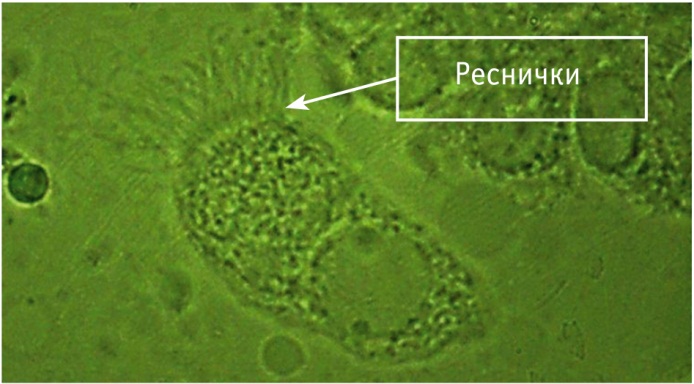
Рис. 4. Клетка цилиарного эпителия с поврежденными и поредевшими ресничками. Световая микроскопия, ув. × 1000. Фото авторов
У детей с БА и с БА в сочетании с АР характер движения ресничек часто был нарушен: отмечалось пульсирующее, спастическое или хаотичное движение. В группах БА и БА + АР в соскобах было снижено относительное количество клеток с подвижными ресничками, а также реже, чем в контрольной группе, отмечалось синхронное движение ресничек (в обоих случаях отличия статистически значимы: p < 0,01). У детей с АР без патологии нижних дыхательных путей количество клеток с подвижными ресничками в образцах эпителия было сопоставимо с контрольным показателем, а синхронное движение ресничек хоть и отмечалось несколько реже, но различия с контролем не имели статистической значимости. ЧБР и время сахаринового теста в основных группах и группе контроля были сходными (табл. 2).
Таблица 2
Показатели функционального состояния цилиарного эпителия
| Показатели |
БА+АР (n = 75) |
БА (n = 20) |
АР (n = 19) |
Контроль (n = 17) |
|
|
Средняя носовая раковина |
частота биения ресничек, Гц, Me [Q1–Q3] |
4,88 [4,15–6,10] |
4,77 [4,19–5,15] |
4,80 [3,93–5,69] |
5,70 [4,60–6,86] |
| процент клеток с подвижными ресничками в пласте эпителия, Me [Q1–Q3] |
20,0 [9,0–40,0]* |
20,0 [10,0–20,0]* |
60,0 [40,0–70,0] |
60,0 50,0–70,0] |
|
|
количество пациентов, у которых выявлено синхронное движение ресничек, n (%) |
7/64 (10,9)* |
2/19 (10,5)* |
6/8 (75,0) |
15/16 (93,8) |
|
|
Нижняя носовая раковина |
частота биения ресничек, Гц, Me [Q1–Q3] |
4,72 [4,12–5,76] |
5,11 [3,92–5,89] |
4,71 [3,645,55] |
5,50 [4,77–6,50] |
| процент клеток с подвижными ресничками в пласте эпителия, Me [Q1–Q3] |
10,0 [5,0–20,0]* |
13,0 [5 ,0–19,0]* |
20,0 [6,5–30,0] |
30,0 [30,0–40,0] |
|
| количество пациентов, у которых выявлено синхронное движение ресничек, n (%) | 8/72 (11,1)* | 2/17 (11,8)* | 8/14 (57,1) | 15/16 (93,8) | |
| Сахариновый тест, мин., Me [Q1–Q3] |
9,0 [6,1–14,0] |
9,0 [6,0–13,0] |
12,1 [7,9–17,6] |
7,0 [5,3–10,1] |
|
Примечание. Знаком (*) отмечены статистически значимые различия с контрольной группой: p < 0,01.
Как было описано нами ранее [39], по исследуемым показателям функционального статуса эпителия не выявлено статистически значимых различий между группами БА тяжелого, среднетяжелого и легкого течения, а также между группами БА и БА + АР.
В ходе динамического наблюдения с целью уточнения функционального состояния цилиарного эпителия при обострении и ремиссии БА и АР были выделены четыре группы пациентов: с БА в стадии обострения и сопутствующим АР в стадии обострения (БАо + АРо, n = 28); с БА в стадии ремиссии и сопутствующим АР в стадии ремиссии (БАр + АРр, n = 36); с БА в стадии обострения и сопутствующим АР в стадии ремиссии (БАо + АРр, n = 39); с БА в стадии ремиссии и сопутствующим АР в стадии обострения (БАр + АРо, n = 14).
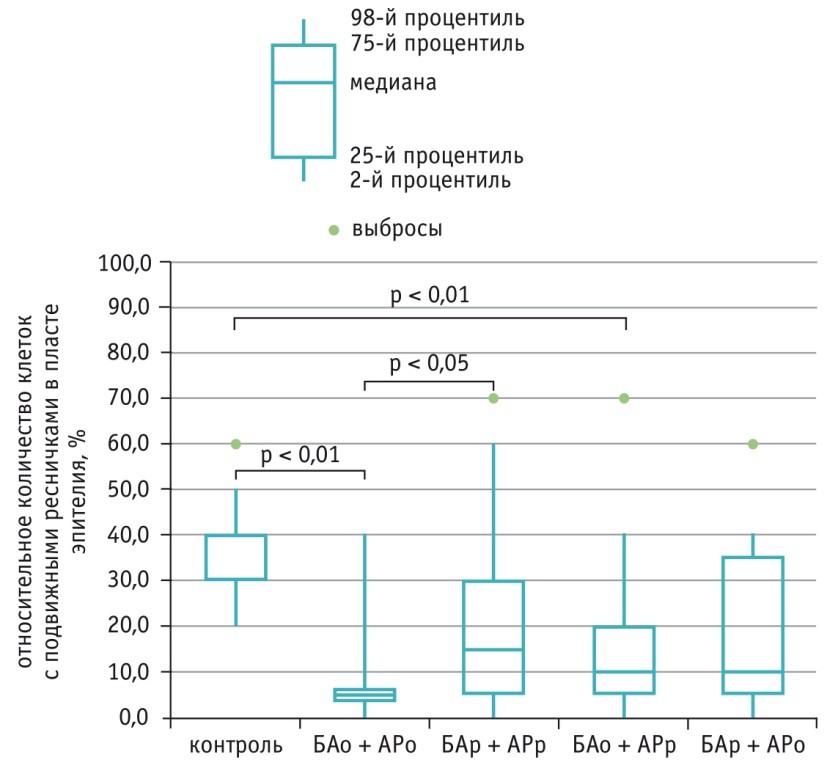
Относительное количество клеток с подвижными ресничками в пласте эпителия в соскобах с нижней носовой раковины в группах БАо + АРо и БАо + АРр было статистически значимо (р < 0,01) ниже, чем в контрольной группе (5,0 [4,0–6,0]%, 10,0 [5,0–20,0]% и 30,0 [30,0–40,0]% соответственно). В группах, где БА была в стадии ремиссии, независимо от обострения или ремиссии сопутствующего АР также отмечалось снижение показателя, однако статистической значимости различий достигнуто не было (рис. 5).
Рис. 5. Относительное количество клеток с подвижными ресничками в пласте эпителия в соскобах с нижней носовой раковины, %.
Примечание. АР — аллергический ринит; БА — бронхиальная астма; о — обострение, р — ремиссия
Аналогичные результаты были получены для образцов эпителия со средней носовой раковины: для групп БАо + АРо, БАо + АРр и контрольной группы — 20,0 [6,0–35,0]%, 20,0 [8,0–50,0]% и 60,0 [50,0–70,0]% соответственно (в обоих случаях при сравнении с контролем р < 0,01); у пациентов с ремиссией БА статистически значимые отклонения отсутствовали (p > 0,05).
У детей с одновременным обострением БА и АР отмечалось также снижение ЧБР в соскобах с нижней носовой раковины по сравнению с показателем в контрольной группе (4,2 [3,7–4,6] Гц и 5,5 [4,8–6,5] Гц соответственно; р < 0,01).
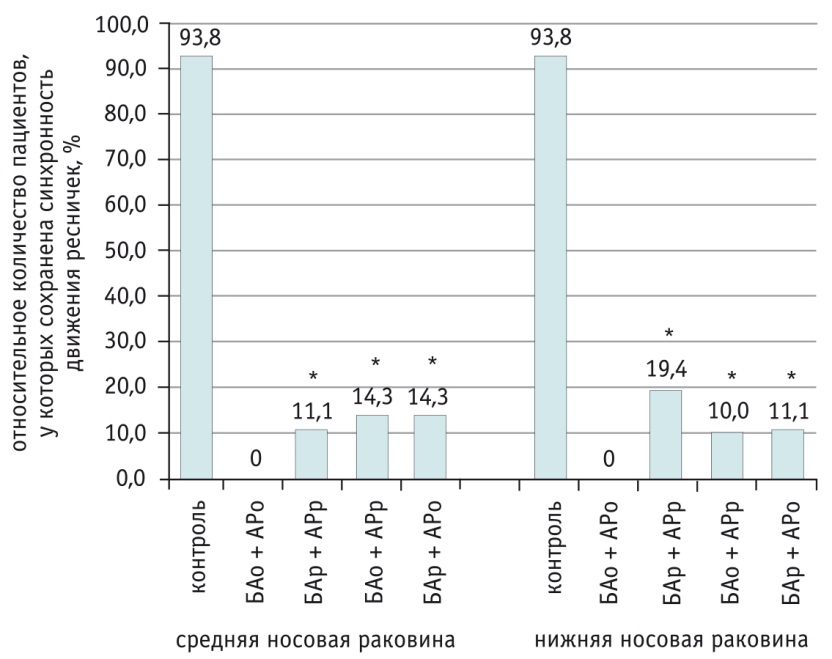
Показатели синхронности движения ресничек в зависимости от обострения или ремиссии БА и АР приведены на рисунке 6.
Рис. 6. Относительное количество пациентов с синхронным движением ресничек в пласте эпителия, %.
Примечания.
1. АР — аллергический ринит; БА — бронхиальная астма; о — обострение, р — ремиссия.
2. Знаком (*) отмечены статистически значимые различия с контрольной группой: p < 0,01.
Оценена динамика функционального состояния эпителия у 19 детей, у которых при первом обследовании БА была в стадии обострения, а при повторном обследовании через 6 недель — в стадии ремиссии. При обострении БА в соскобах с нижней носовой раковины отмечалось статистически значимое снижение ЧБР по сравнению с контрольной группой (3,6 [3,4–4,4] Гц и 5,5 [4,8–6,5] Гц соответственно; р < 0,01). При повторном обследовании через 6 недель показатель возвращался к норме (5,2 [4,3–6,5] Гц).
Относительное количество клеток с подвижными ресничками в пласте эпителия в соскобах с нижней носовой раковины при обострении БА было статистически значимо ниже, чем в контрольной группе (5,0 [0,8–13,8]% и 30,0 [30,0–40,0]% соответственно; р < 0,01). При повторном обследовании через 6 недель показатель увеличился до 15,0 [7,5–25,0]%, но по-прежнему существенно отставал от контрольного (р < 0,01). При обострении БА детей с синхронным движением ресничек в образцах эпителия не было, в ремиссии заболевания синхронное движение наблюдалось в 26,3% случаев, однако данный показатель оставался статистически значимо ниже, чем в группе контроля (93,8%; р < 0,05).
Среди детей с АР без патологии нижних дыхательных путей также были выделены две группы: 12 детей с АР в стадии обострения и 7 детей с АР в стадии ремиссии. В этих группах ЧБР и относительное количество клеток с подвижными ресничками в пласте эпителия не имели статистически значимых отличий от соответствующих контрольных показателей. При обострении АР синхронное движение ресничек отмечалось реже, чем в контрольной группе: в соскобах с нижней носовой раковины различия были статистически значимы (44,4% и 93,8% детей соответственно; р < 0,05); в соскобах со средней носовой раковины они не достигли статистической значимости (50,0% и 93,8% детей соответственно; р = 0,056). В стадии ремиссии АР у подавляющего большинства (более чем у 80%) детей отмечалось синхронное движение ресничек в пласте эпителия.
ОБСУЖДЕНИЕ
Выбор слизистой оболочки носа в качестве источника цилиарного эпителия позволил избежать инвазивных и сложных методов забора бронхиального эпителия с проведением бронхоскопии. В литературе имеются данные о корреляции функционального состояния цилиарного эпителия верхних и нижних дыхательных путей, что позволяет использовать назальный эпителий для косвенной оценки функционального состояния цилиарного эпителия всего респираторного тракта [40, 41].
У детей с БА, в отличие от детей с АР без сопутствующей патологии нижних дыхательных путей, выявлены выраженные отклонения функционального состояния назального цилиарного эпителия. Наличие или отсутствие сопутствующего АР не оказывало существенного влияния на функциональные показатели эпителия у детей с БА. Снижение относительного количества клеток с подвижными ресничками в пласте эпителия у больных БА может быть связано как с нарушением подвижности ресничек, так и со слущиванием ресничек с поверхности эпителия.
У детей с БА синхронное движение ресничек отмечалось намного реже, чем в контрольной группе (менее чем в 12% случаев). У детей с АР существенное снижение показателя происходило лишь при обострении заболевания. Несинхронность биения ресничек наблюдалась как на соседних клетках, так и на одной клетке — вплоть до хаотичного движения.
У пациентов с БА изменения назального эпителия отмечены даже при отсутствии симптомов и клинических признаков АР. Полученные данные могут говорить о том, что, возможно, у больных БА имеются определенные особенности строения и функционирования цилиарного эпителия, предрасполагающие к развитию астмы. Такое предположение косвенно подтверждается тем фактом, что не у всех пациентов с АР развивается БА.
Неизвестно, насколько корректно было бы экстраполировать выявленные нарушения со стороны назального эпителия на бронхиальный эпителий, однако, учитывая концепцию единых дыхательных путей, а также данные, полученные при исследовании бронхиального эпителия у взрослых больных БА [17, 18], не исключено, что подобные изменения присутствуют и в бронхиальном эпителии.
По данным исследования, при обострении БА показатели функционального состояния цилиарного эпителия ухудшаются. Наиболее низкие показатели отмечены при одновременном обострении БА и АР. В то же время обострение АР при сохранении ремиссии БА не приводило к существенному снижению функциональных показателей цилиарного эпителия слизистой оболочки носа.
При наступлении клинической ремиссии БА функциональное состояние эпителия остается на сниженном уровне в течение длительного времени. Полного восстановления всех параметров функциональной активности эпителия в течение 6 недель после обострения не происходит, что отражает персистирование воспаления и свидетельствует о необходимости продолжения базисной терапии.
ЗАКЛЮЧЕНИЕ
До настоящего времени остается открытым вопрос о том, что первично: врожденные особенности эпителия дыхательных путей у больных бронхиальной астмой способствуют нарушению структуры и функции эпителия и, как результат, развитию воспаления или эти нарушения являются следствием хронического воспаления. Концепция центральной роли респираторного эпителия в патогенезе бронхиальной астмы открывает новые перспективы в разработке подходов к профилактике и лечению этого заболевания, направленные на повышение резистентности эпителия к факторам внешней среды, а не только на подавление воспаления и устранение спазма гладких мышц.








