Микрофлора человека представляет собой совокупность множества микробиоценозов и включает в себя десятки и сотни разнообразных видов микроорганизмов, которые по своему количеству почти на порядок превышают число клеток всех органов и тканей человеческого организма [1, 2, 3, 6]. Общий геном бактерий ЖКТ в 50-100 раз больше генома человека [2, 5]. Показано, что пристеночная и просветная микрофлора кишечника включает в себя 395 филогенетически обособленных групп микроорганизмов [4]. Микробиом полости рта человека содержит 619 таксонов в 13 филотипах [4]. Выявляются существенные различия детских и взрослых типов микрофлоры.
Недостаток или избыток самих микроорганизмов и/или их метаболитов служит сигналом для активации адаптивных механизмов в той или иной экосистеме. Механизмы поддержания микрофлоры человека до конца не изучены; очевидно, именно этим обусловлен постоянный интерес к проблеме микробиоценоза. Микроэкология пищеварительного тракта в данном плане представляет особый интерес: понимание структурно-функционального значения изменений микрофлоры кишечника позволит подойти к терапии основных заболеваний и к коррекции микробиоценоза с патогенетических позиций.
В настоящее время внимание педиатров привлекает появившийся на отечественном рынке мультиштаммовый пробиотик Бак-Сет форте (Probiotics International Ltd, Великобритания). Он содержит 14 штаммов пробиотических бактерий в капсулированной форме. Известно, что биотрансформация лактозы осуществляется с участием индигенной микрофлоры ЖКТ. Наиболее высокая активность бета-галактозидазы выявлена у молочнокислых бактерий штамма Lactobacillus acidophilus LA-1. Бак-Сет форте, кроме L. casei PXN 37, L. rhamnosus и Streptococcus thermophilus PXN 66, содержит L. acidophilus PXN 35, что делает его применение у детей патогенетически обоснованным.
Не меньшее значение при выборе пробиотика имеет физиологичность его штаммового состава (табл. 1). Бак-Сет форте содержит виды бифидобактерий, которые могут применяться у детей с первых месяцев жизни (Bifidobacterium breve PXN 25, B. infantis PXN 27, B. longum PXN 30).
Таблица 1
Состав бифидобактерий микробиоценоза желудочно-кишечного тракта в зависимости от возраста
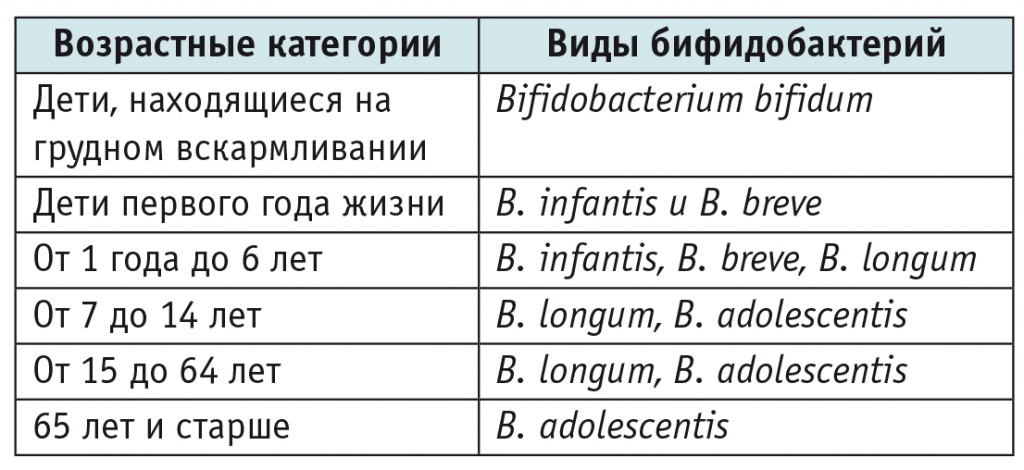
На кафедре педиатрии с инфекционными болезнями у детей факультета дополнительного профессионального образования Российского национального исследовательского медицинского университета им. Н. И. Пирогова проведено рандомизированное наблюдательное плацебо-контролируемое клиническое исследование по изучению эффективности Бак-Сет форте.
Цель исследования: оценить влияние пробиотика Бак-Сет форте на состояние кишечной микробиоты и клиническую картину у детей с диареями, запорами и атопическим дерматитом (АтД).
МАТЕРИАЛЫ И МЕТОДЫ
В исследование входили 120 пациентов в возрасте от 4 до 12 лет, которые методом случайной выборки были разделены на пять групп:
1) основная группа 1 (n = 30): дети с диареей на фоне приема антибиотиков, ротавирусной инфекции, с синдромом мальабсорбции;
2) основная группа 2 (n = 30): дети с расстройством стула (запор) на фоне смены рациона питания (в связи с путешествием, началом посещения детского организованного коллектива);
3) основная группа 3 (n = 30): дети с АтД легкой и средней степеней тяжести;
4) группа контроля 1 (n = 15): дети с функциональными кишечными нарушениями (диарея, запор, неустойчивый стул) после острых кишечных инфекций, пищевых отравлений, курса антибиотикотерапии, смены привычного рациона питания;
5) группа контроля 2 (n = 15): дети с АтД легкой и средней степеней тяжести.
Участники трех основных групп помимо базисной терапии получали пробиотик Бак-Сет форте по 1 капсуле 1 раз в день перед завтраком в течение 2 недель (14 дней). Пациентам двух контрольных групп в дополнение к базисной терапии назначали плацебо по схеме, аналогичной схеме применения Бак-Сет форте.
До начала приема пробиотика или плацебо проводились общеклиническое исследование, УЗИ органов пищеварительного тракта, копрологическое исследование, анализ кала на дисбактериоз. По окончании применения указанных средств все исследования выполнялись повторно.
Статистическая обработка и анализ результатов исследования проводились с использованием программы Microsoft Excel 2007, AtteStat, Statistica 10.0. Различия полученных данных считали статистически значимыми при р ≤ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Распределение детей по полу и возрасту представлено в таблице 2.
Таблица 2
Распределение наблюдаемых детей по полу и возрасту
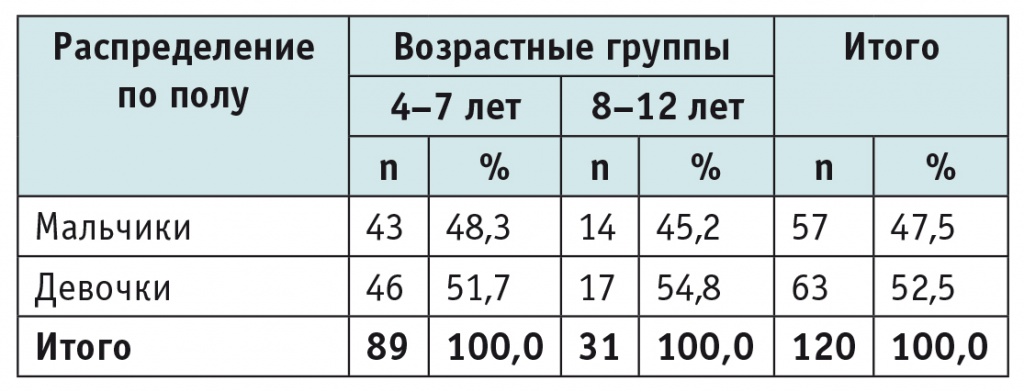
Среди детей первой группы (с диареей) мальчики практически двукратно преобладали над девочками. Диарея встречалась статистически значимо чаще у детей до 7 лет, чем у пациентов среднего школьного возраста и подростков (p ˂ 0,05).
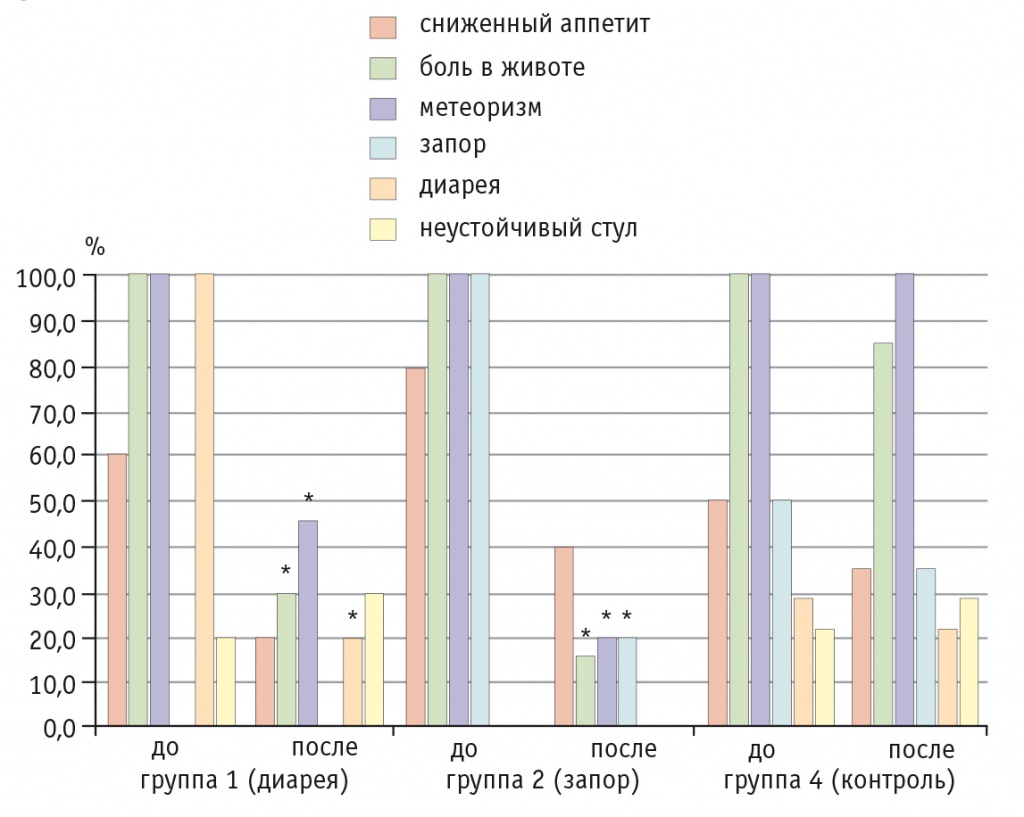
Анализ клинической картины в основных группах 1 (диарея) и 2 (запор) показал снижение частоты практически всех клинических симптомов в ходе лечения (рис. 1).
Рис. 1. Динамика абдоминальных симптомов у детей с диареей и запором на фоне приема Бак-Сет форте и в контрольной группе, %.
* P ≤ 0,05
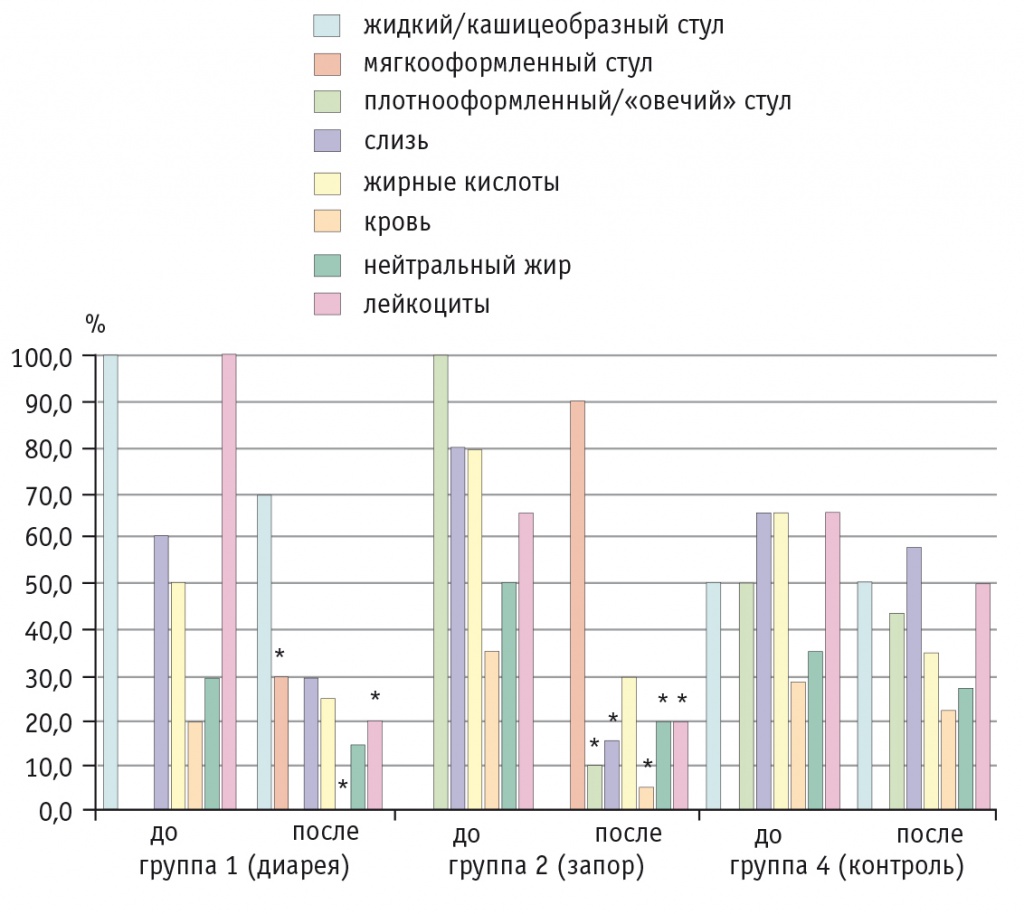
Положительная динамика абдоминального синдрома подтверждалась данными копрологического исследования (рис. 2).
Рис. 2. Динамика результатов копрологического исследования у детей с диареей и запором на фоне приема Бак-Сет форте и в контрольной группе, %.
* P ≤ 0,05
В целом в первой группе обращало на себя внимание постепенное исчезновение диареи у большинства больных. Диарея прекращалась в среднем к 3-5-му дню при ротавирусной инфекции и на 1-2-е сутки у детей с хронической диареей, обусловленной непереносимостью пищевых веществ (целиакоподобный синдром, непереносимость белка коровьего молока, хронические воспалительные заболевания кишечника), — иными словами, с заболеваниями с аллергическим и иммунозависимым патогенезом. Полученные данные коррелировали с частотой и длительностью исчезновения атопических реакций, что позволяет предполагать противовоспалительный и иммуномодулирующий эффекты Бак-Сет форте. Эти результаты требуют подтверждения на большей выборке.
Во второй группе клинические изменения имели ту же направленность, однако в количественном отношении динамика была более значимой. Запор нивелировался у большинства детей, при этом нормализация стула у них происходила уже после первого приема Бак-Сет форте.
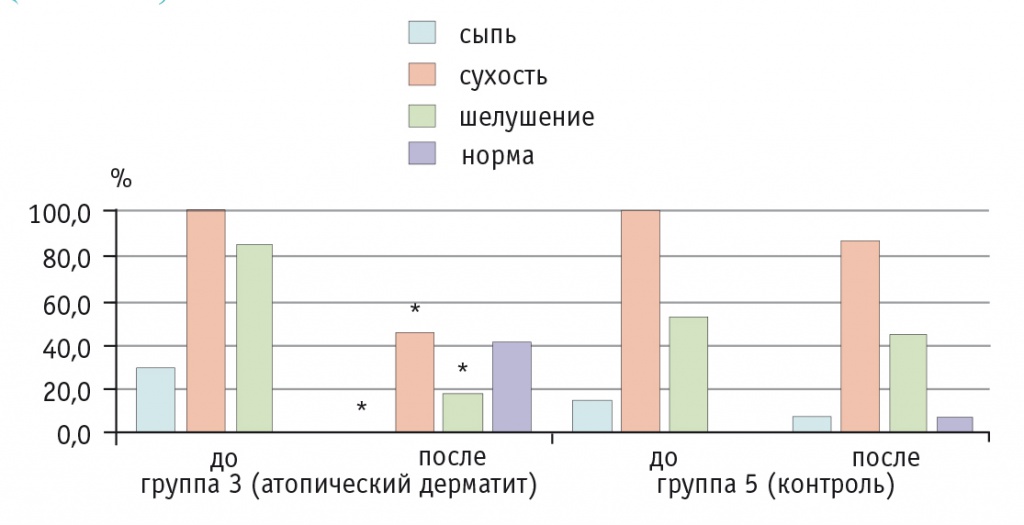
У пациентов третьей группы (с АтД) отмечалась значительная положительная динамика: более чем у половины детей на протяжении 2-3 дней исчезали раздражительность, повышенная возбудимость, боли в животе, нормализовался стул (рис. 3), одновременно с этим пациентов переставали беспокоить сыпь, шелушение и сухость кожи (рис. 4).
Рис. 3. Динамика абдоминальных симптомов у детей с атопическим дерматитом на фоне приема Бак-Сет форте и в контрольной группе, %.
* P ≤ 0,05
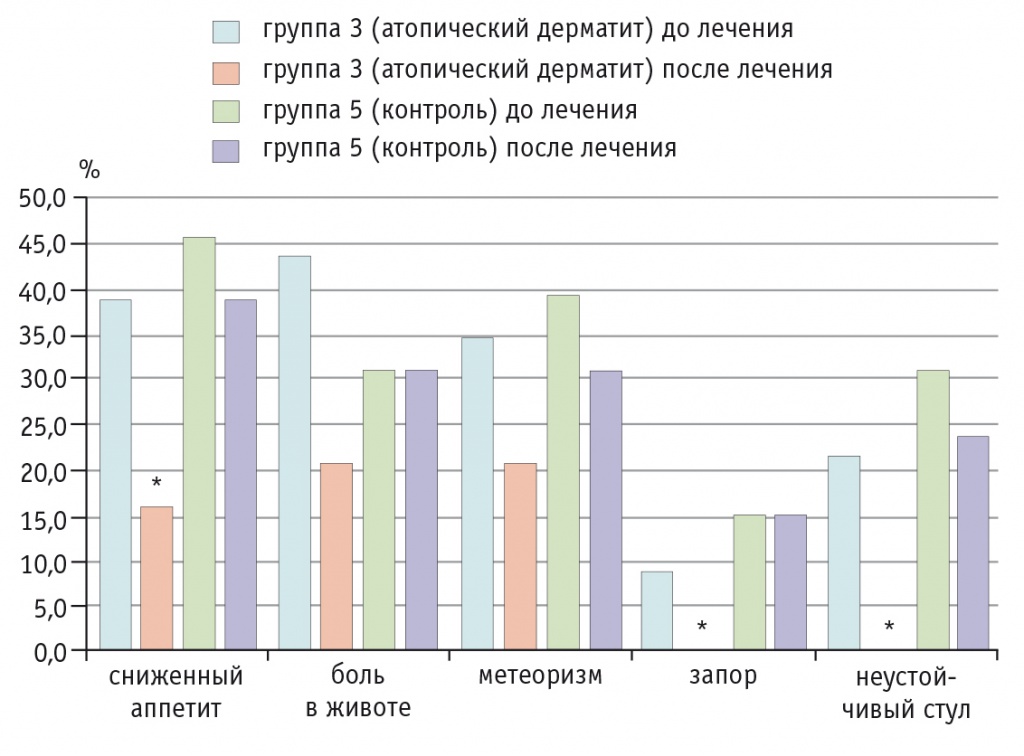
Рис. 4. Динамика кожных проявлений у детей с атопическим дерматитом на фоне приема Бак-Сет форте и в контрольной группе, %.
* P ≤ 0,05
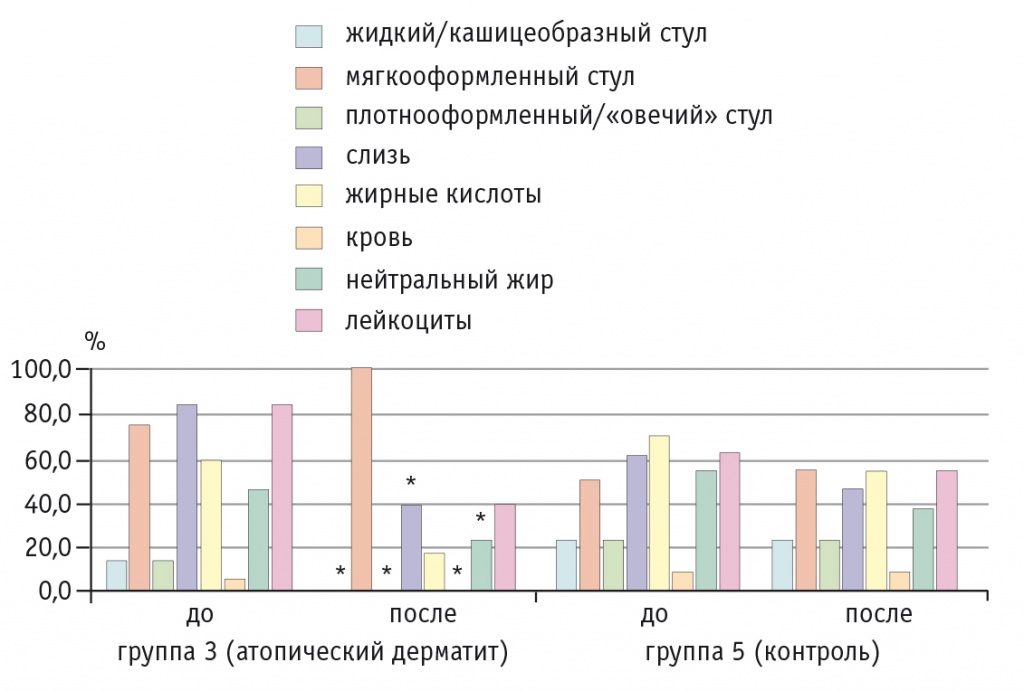
В копрограммах у детей с АтД основной группы отмечалось уменьшение количества лейкоцитов, слизи примерно в 5 раз, нейтрального жира — в 10 раз, жирных кислот и внутриклеточного крахмала — в 1,5 раза, что свидетельствовало о нормализации процессов пищеварения и нивелировании аллергического и воспалительного процессов в стенке кишечника. У каждого второго ребенка происходила нормализация содержания жирных кислот и процессов пищеварения. В контрольной группе также уменьшалось количество лейкоцитов, слизи и нейтрального жира, но эти изменения не достигли статистической значимости (рис. 5).
Рис. 5. Динамика основных показателей копрограммы у детей с атопическим дерматитом на фоне приема Бак-Сет форте и в группе контроля, %.
* P ≤ 0,05
При изучении количественных показателей микрофлоры кишечника положительная динамика хотя и определялась, однако не была статистически значимой. Наиболее значительными были изменения со стороны клебсиелл и кишечной палочки, количество которых возвращалось к норме после окончания приема Бак-Сет форте. Количественные показатели в отношении как индигенной, так и условно-патогенной микрофлоры кишечника восстанавливались у 80% детей. Те же закономерности отмечались и при микроскопическом исследовании кала.
При анализе результатов исследования у детей на фоне приема плацебо не было выявлено статистически значимых различий с исходными данными ни по одному показателю.
ЗАКЛЮЧЕНИЕ
Опыт клинического применения Бак-Сет форте у детей старше 4 лет подтвердил, что этот мультипробиотик высокоэффективен в коррекции нарушений стула при хронической диарее и запорах, подавлении атопических и воспалительных реакций при пищевой аллергии.
На фоне применения Бак-Сет форте отмечалось постепенное купирование диареи: в среднем на 3-5-е сутки при ротавирусной инфекции и в 1-2-е сутки у детей с хронической диареей, обусловленной пищевой непереносимостью. Полученные данные коррелировали с частотой и длительностью исчезновения атопических реакций.
При запорах клинический эффект проявлялся уже в первые сутки применения Бак-Сет форте. При пищевой непереносимости и атопическом дерматите нормализация стула положительно коррелировала с динамикой кожных проявлений.
Полученные результаты открывают широкие возможности для использования Бак-Сет форте — единственного мультипробиотика, содержащего 14 штаммов бактерий, — в широкой педиатрической практике.








