ВВЕДЕНИЕ
Пневмококовая инфекция — одна из самых частых бактериальных инфекций во всем мире. От заболеваний, вызванных пневмококком, умирает около 1,5 млн человек в мире за год, из которых половина — это дети первых 5 лет жизни[1].
Возбудитель Streptococcus pneumoniae — грамположительный, инкапсулированный анаэроб, главный фактор вирулентности которого — полисахаридная капсула, на основе ее вариаций в настоящее время идентифицированы более 100 серотипов пневмококков. Капсула позволяет возбудителю уклоняться от иммунного ответа хозяина и снижает эффективность антибактериальной терапии. Серотипы отличаются географическим распространением, локализацией инфекционного процесса, циркуляцией среди взрослого или детского населения, инвазивным потенциалом, риском летальных исходов и т. п.
Как правило, инфекционный процесс вызывают около 20 из известных серотипов. Определены серотипы, которые, например, чаще встречаются у детей при колонизации носоглотки или чаще вызывают средний отит, пневмонию, менингит[2, 3].
Говоря о таких инвазивных формах пневмококковой инфекции, как пневмония, бактериемия, менингит, эндокардит, перитонит, стоит вспомнить о доказанной кардиотоксичности этого возбудителя. Многие исследования рассматривают пневмококковую инфекцию как фактор риска сердечно-сосудистых осложнений, в том числе сердечной недостаточности и сердечной аритмии. Показана более высокая смертность кардиологических больных с пневмококковой пневмонией. Пневмококки могут проникать в сердце и образовывать микропоражения, тем самым нарушая проведение электрических импульсов и сократительную функцию кардиомиоцитов. Пневмококк закрепляется в миокарде, не вызывая иммунного ответа, размножаясь во внутиклеточных везикулах и образуя биопленки[4].
Пневмококковый токсин повышает жесткость артериальной стенки, увеличивая значения пульсового и центрального артериального давления, что, в свою очередь, меняет уровень общего сосудистого сопротивления, усиливает потребность миокарда в кислороде. Развивающаяся гипоксемия повышает общее легочное сосудистое сопротивление и приводит к росту преднагрузки на миокард, а это способствует снижению сократительной способности правых отделов сердца. Тахикардия, развивающаяся на фоне пневмонии, сокращает продолжительность диастолы, что увеличивает риски фибрилляционной активности скомпрометированного миокарда.
В одном из исследований, посвященном взрослым пациентам с сердечно-сосудистой патологией, в рамках стационарного лечения показано, что сочетание хронической сердечной недостаточности (ХСН) и пневмонии повышало риск летального исхода почти в 5 раз[5].
Даже при своевременной диагностике пневмококковой инфекции и назначенной антибактериальной терапии осложнения со стороны сердечно-сосудистой системы могут возникать, например, в результате использования самих лекарств. Так, некоторые β-лактамные антибиотики могут осложнить течение ХСН из-за увеличения уровня натрия плазмы, макролиды способны вызвать сердечные аритмии, удлиняя интервал QT.
Проблема реализации профилактических мероприятий против пневмококковой инфекции среди пациентов с хроническими заболеваниями обсуждается разными специалистами в течение длительного времени. Для взрослых пациентов в клинические рекомендации по сердечной недостаточности уже включены пункты по обязательной иммунопрофилактике пневмококковой инфекции[6].
В ФГАУ «НМИЦ здоровья детей» Минздрава России вопросы вакцинопрофилактики детей из групп риска всегда занимали важное место в научно-исследовательской сфере.
Особенности специфической иммунопрофилактики пневмококковой инфекции изучены на примере нефротического синдрома у детей, системного ювенильного идиопатического артрита. Такие дети относятся к группе риска тяжелого течения вакциноуправляемой инфекции, вызываемой S. pneumoniae, т. к. находятся в группе с низким охватом вакцинацией и при этом чаще контактируют с внутрибольничной флорой из-за регулярных госпитализаций.
Проведенные исследования показали, что иммунизация пневмококковой конъюгированной вакциной (ПКВ) высокоэффективна и безопасна у иммунокомпрометированных пациентов с поражением суставов, их результаты позволяют преодолеть необоснованную предубежденность детских ревматологов против вакцинации детей с ювенильным ревматоидным артритом[7, 8].
Аналогичная ситуация сложилась и для детей с заболеваниями сердечно-сосудистой системы с ХСН. Таких пациентов, безусловно, тоже нужно отнести к группе риска тяжелого течения пневмококковой инфекции, у врачей отсутствует исчерпывающая информация о безопасности, эффективности и противопоказаниях к вакцинации детей с сердечной недостаточностью[9].
В отечественной и зарубежной литературе работы, посвященные эффективности и безопасности вакцинацинации против пневмококковой инфекции детей с сердечно-сосудистыми заболеваниями и врожденными пороками сердца (ВПС), немногочисленны. В последнее время тема вакцинации данной категории больных становится все более актуальной.
Так, исследование охвата вакцинацией детей с ВПС в Нижегородской области выявило существенно более поздний старт вакцинации у оперированных детей на примере иммунизации против пневмококковой инфекции — защищенными оказались только 11,8%, вакцинация у них была отложена на 3 года и более[10].
Изучение иммунизации ПКВ недоношенных детей и детей с ВПС в Иркутске показало высокую эффективность вакцинопрофилактики пневмококковой инфекции в этой группе пациентов. В течение 1,5 года у привитых детей не зарегистрировано ни одного случая пневмонии, менингита, острого среднего отита, бронхообструктивного синдрома. Возникавшие острые респираторные инфекции не требовали назначения антибактериальной терапии, в том числе и у детей, ранее получавших антибиотики более 8 раз в течение года[11].
Еще одно исследование когорты детей до 5 лет с ВПС с различными схемами вакцинации подтвердило эффективность как минимум двух доз ПКВ для снижения риска развития пневмонии — 26 случаев пневмонии в группе 196 вакцинированных детей против 51 случая пневмонии в группе 152 невакцинированных. Различий между пациентами, получившими две, три или четыре дозы, не было[12].
Для определения результативности иммунизации важен не только анализ охвата вакцинацией, но и показатели клинической и иммунологической эффективности вакцины. Для оценки иммунного ответа на вакцину проводится сравнение титров специфических антител в сыворотке крови пациентов непосредственно перед вакцинацией и в разные сроки после нее, а также сравнение этих результатов с уровнями антител у непривитых лиц[13].
Согласно рекомендациям Всемирной организации здравоохранения, для ПКВ определена эквивалентность иммунного ответа по концентрации специфических антител иммуноглобулина G (IgG) ≥ 0,35 мкг/мл. Однако данные об иммунологической эффективности (защитном титре антител) ПКВ у детей с заболеваниями сердечно-сосудистой системы с сердечной недостаточностью отсутствуют или противоречивы.
Тринадцативалентная полисахаридная ПКВ (ПКВ13) включает до 90% серотипов, являющихся причиной инвазивных пневмококковых инфекций, в т. ч. устойчивых к лечению антибиотиками, демонстрирует эффективность в отношении назофарингеального носительства как серотипов, входящих в состав вакцины, так и некоторых других.
Дети с заболеваниями сердечно-сосудистой системы, сопровождающимися ХСН, по жизненным показаниям должны быть вакцинированы против вакциноуправляемых пневмотропных инфекций, в частности против пневмококка.
Согласно инструкции к ПКВ13, противопоказаниями являются:
-
повышенная чувствительность при предшествующем введении препарата (в т. ч. анафилактический шок, тяжелые генерализованные аллергические реакции);
-
повышенная чувствительность к компонентам препарата;
-
острые инфекционные или обострения хронических заболеваний.
Вакцинацию проводят после выздоровления и на фоне стабильного состояния по основному заболеванию.
В литературе имеются данные только по тактике вакцинации взрослых пациентов с болезнями сердечно-сосудистой системы. Таким больным рекомендуется проведение вакцинации в следующих случаях:
-
в период ремиссии на фоне подобранной терапии;
-
в случае прогрессирования заболевания вакцинацию ПКВ проводят через 2–4 недели после купирования обострения при достижении стабильных показателей гемодинамики;
-
после осложненного инфаркта миокарда медицинский отвод от вакцинации на 28 дней;
-
у пациентов с ХСН через 7 дней от момента окончания титрации диуретиков при стабильной массе тела;
-
при дилатационной кардиомиопатии контроль гемодинамики 4 недели и вакцинация при стабильном состоянии[14].
Похожие рекомендации можно найти и для детей с ВПС и аритмиями — их прививают по достижении минимума гемодинамических нарушений, в том числе на фоне комбинированной медикаментозной терапии, в случае приобретенной кардиомиопатии — в период ремиссии. Специальных противопоказании для этих пациентов не существует, напротив, существенные гемодинамические заболевания сердца и сосудов являются показаниями для вакцинации[15].
В Российской Федерации вакцинация против пневмококковой инфекции была включена в национальный календарь профилактических прививок в марте 2014 г. для всех детей начиная с возраста 2 месяца, с введением второй дозы вакцины в 4,5 месяца и ревакцинацией на втором году жизни — в 15 месяцев. При нарушении графика вакцинации детям с 7 до 12 месяцев вводятся 2 дозы с интервалом 4 недели и ревакцинацией на втором году жизни, детям 12–23 месяцев вводятся 2 дозы с интервалом 8 недель, детям 2 лет и старше — 1 доза однократно. Прерванный курс прививок не требует повторения предыдущих доз.
Однако, как демонстрируют результаты ранее приведенных исследований, несмотря на все предпосылки для как можно более широкого охвата профилактическими прививками детей с заболеваниями сердечно-сосудистой системы, эта группа по-прежнему остается самой уязвимой в отношении одной из вакциноуправляемых инфекций, вызываемой S. pneumoniae.
Цель исследования: определить охват, эффективность и переносимость вакцинации против пневмококковой инфекции у детей с сердечно-сосудистыми заболеваниями, сопровождающимися ХСН.
МАТЕРИАЛЫ И МЕТОДЫ
В 2020–2022 гг. на базе отделения кардиологии ФГАУ «НМИЦ здоровья детей» Минздрава России исследованы эффективность и безопасность вакцинации у 250 пациентов с заболеваниями сердечно-сосудистой системы, сопровождающимися ХСН.
Ввиду высокой частоты бактерионосительства среди детей до 5 лет в исследуемую группу вошли дети от 2 месяцев до 5 лет[16, 17].
По нозологиям они распределились следующим образом:
-
дети с ХСН на фоне кардиомиопатии (дилатационной, гипертрофической, неклассифицируемой, неуточненной) — 199 (80%);
-
дети с ХСН на фоне ВПС — 51 (20%).
В рамках профильного лабораторно-инструментального обследования у всех детей оценивали уровни специфических иммуноглобулинов (Ig) к наиболее значимым серотипам пневмококка (1-5, 6B, 7F, 8, 9N, 9V, 10A, 11A,12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F, 33F) с помощью тест-системы VaccZyme Anti-PCP IgG.
При консультировании пациентов и составлении графика вакцинации проведен анализ охвата профилактическими прививками против пневмококковой инфекции и причин длительных медицинский отводов или отказов. На фоне стабильного состояния по основному заболеванию, при отсутствии противопоказаний и наличии согласия родителя дети вакцинированы ПКВ13.
Исследование одобрено локальным независимым этическим комитетом ФГАУ «НМИЦ здоровья детей» Минздрава России, НИР «Целесообразность и безопасность вакцинации против пневмококковой инфекции у детей с кардиологической патологией, сопровождающейся сердечной недостаточностью», протокол № 3 от 25.03.2021 г. Законные представители подписывали согласие на участие детей в исследовании после ознакомления с информационным письмом.
РЕЗУЛЬТАТЫ
При анкетировании родителей пациентов выявлено, что до момента госпитализации в отделение минимум 1 дозу вакцины против пневмококка получили всего 97 (38,8%) детей, в то время как оставшиеся 153 (61,2%) привиты не были.
Среди вакцинированных до 5-летнего возраста больше всего было пациентов с гипертрофической и неклассифицируемой кардиомиопатией.
Анализ результатов анкетирования показал, что дети с ВПС, диагностированными при рождении, с явлениями дыхательной и сердечной недостаточности в первые сутки жизни, с дилатационной кардиомиопатией и дебютом клинических проявлений сердечной недостаточности в грудном возрасте в 99% случаев имели продолжительный медицинский отвод от всех прививок на 1-м году жизни и далее.
В качестве причин, по которым вакцинация не была проведена, родители указывали в большинстве случаев на медицинский отвод по основному заболеванию — 95 (62%), в 43 случаях (28%) — на отсутствие какой-либо информации о подобной вакцине. Только у 15 детей (10%) родители приняли самостоятельное решение об отказе от вакцинации.
Во время госпитализации в ФГАУ «НМИЦ здоровья детей» Минздрава России 65 (42,5%) из 153 невакцинированных пациентов в возрасте до 5 лет, не имевшие ни одной прививки от пневмококка, получили первую дозу (V1) ПКВ13; из 97 вакцинированных детей 20 (20,6%) получили вторую дозу, 18 (18,6%) — ревакцинацию от пневмококка. Средний возраст детей, получивших V1 ПКВ13, составил 32 месяца. Следует отметить, что данная вакцинация показана детям с 2-месячного возраста.
Все пациенты, вакцинированные в отделении кардиологии, проходили терапию основного заболевания — они принимали ингибиторы ангиотензин-превращающего фермента, β-блокаторы, сердечные гликозиды, петлевые диуретики, антиаритмические средства. Более 50% детей получали в комбинации 3 и более препарата.
Перед проведением вакцинации все дети, находясь в отделении, прошли стандартное обследование: электрокардиографию (ЭКГ), эхокардиографию, холтеровское мониторирование ЭКГ и т. д.
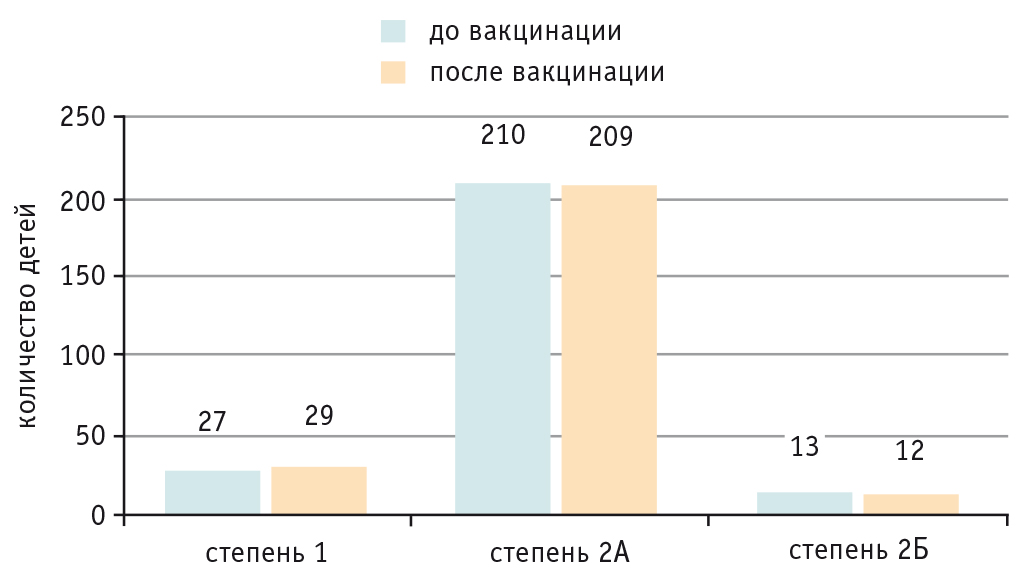
В соответствии с классификацией сердечной недостаточности у детей1, ХСН степени 1 определена у 27 (10,8%), ХСН 2А — у 210 (84%), ХСН 2Б — у 13 (5,2%).
Контрольное обследование пациентов проводилось в разные интервалы времени — спустя 3–4 месяца, 6–9 месяцев и около 12 месяцев с момента проведения вакцинации — в зависимости от сроков повторной госпитализации.
По данным контрольного стандартного обследования, не выявлено ухудшение состояния больных, в том числе увеличение степени и функционального класса ХСН у детей после вакцинации (рис. 1).
Рис. 1. Распределение детей по степени хронической сердечной недостаточности до и после вакцинации против пневмококковой инфекции
При наблюдении за детьми, вакцинированными на базе нашего Центра, в первые 72 часа поствакцинального периода не зафиксировано ни одного серьезного нежелательного явления. У 19 (25%) детей отмечался подъем температуры тела, у 32 (42%) была та или иная местная реакция слабой или умеренной степени выраженности (гиперемия, отек), у 25 (33%) вообще отсутствовали какие-либо проявления в поствакцинальном периоде.
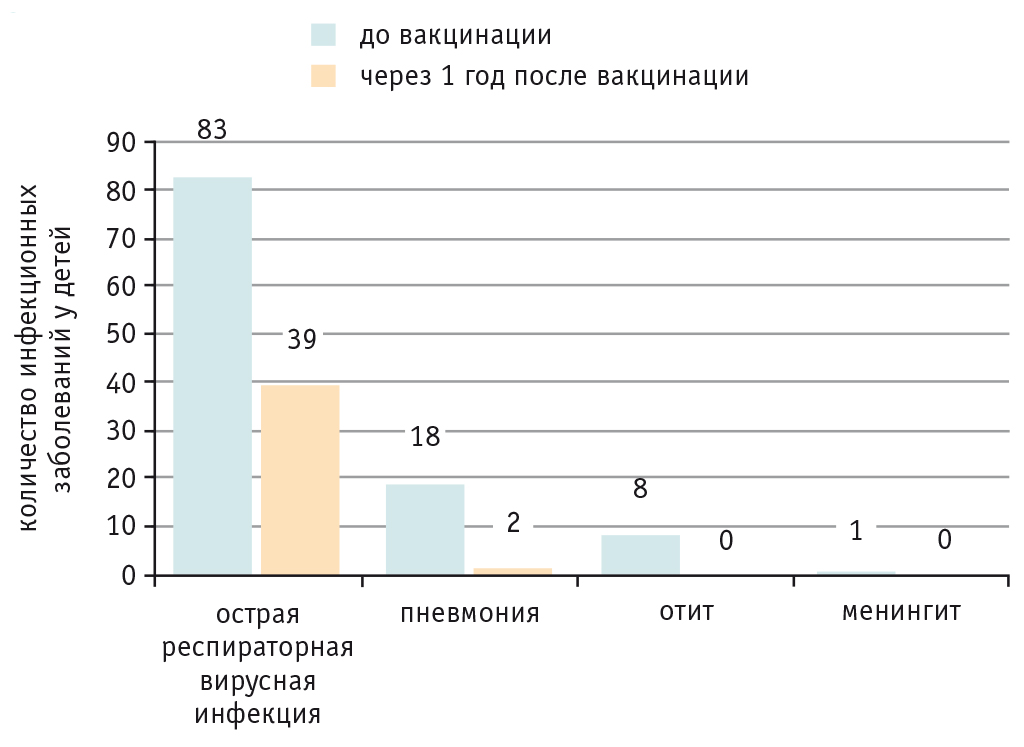
До вакцинации все дети относились к группе часто болеющих. В течение 1-го года после вакцинации частота острых респираторных вирусных заболеваний у них снизилась в 2 раза. Острую пневмонию перенесли 2 ребенка, имеющие легочную гипертензию, из группы вакцинированных пациентов с кардиомиопатией.
Острый средний отит, менингит не зарегистрированы ни у одного ребенка за время наблюдения (рис. 2).
Рис. 2. Заболеваемость детей с хронической сердечной недостаточностью до и после вакцинации 13-валентной полисахаридной конъюгированной пневмококковой вакциной
Наибольший интерес представляли результаты обследования пациентов с хронической сердечно-сосудистой патологией, касающиеся иммунологической эффективности противопневмококковой вакцинации. Нами подтверждена значимая разница в уровнях антител к S. pneumoniae между детьми, получившими полный курс иммунизации согласно возрасту, и невакцинированными детьми: 108,1 ± 58,4 против 12,14 ± 7,8 мг/л (p < 0,05).
В соответствии с инструкцией к препарату ПКВ13 и согласно графику национального календаря профилактических прививок 2021 г., полный курс вакцинации определялся 1–2–3 дозами введенной вакцины в зависимости от возраста старта вакцинации.
У пациентов проведена оценка уровней специфических иммуноглобулинов к серотипам пневмококка с помощью тест-системы VaccZyme Anti-PCP IgG. Заявленный производителем порог чувствительности данной системы составлял 0,45 мг/л. Считаем важным отметить, что порог чувствительности — это рабочая характеристика тест-системы, не являющаяся ни показателем защитного уровня, ни критерием эффективности вакцинации.
С учетом высокой вероятности назофарингеального носительства и распространенности циркуляции различных серотипов S. pneumoniae, в том числе родственных вакцинальным, наличие некоторого небольшого количества специфических антител у детей до вакцинации стало ожидаемым результатом. Оценка иммунологической эффективности вакцинации проводилась путем сопоставления уровней антител у больных, прошедших полный курс вакцинации для своего возраста, у детей с неполным курсом и у непривитых. Уровни специфических IgG к серотипам пневмококка у них составили 12,14 ± 7,8, 45,6 ± 28,9 и 108,1 ± 58,4 мг/л соответственно.
Завершенный курс иммунизации предполагал:
-
V1, V2 и RV для детей, начавших вакцинацию до 12 месяцев и получивших три дозы вакцины;
-
V1 и V2 для детей, начавших вакцинацию с 12 до 24 месяцев и получивших две дозы вакцины;
-
V1 для детей, начавших вакцинацию после 24 месяцев и получивших одну дозу вакцины.
Показатели антител у детей с завершенным курсом вакцинации значимо не различались в группах с разными сроками начала иммунизации: 104,4 ± 52 мг/л — старт на первом году жизни, 96,3 ± 46,6 мг/л — старт на втором году жизни, 123,6 ± 42,9 мг/л — старт вакцинации в 2 года и старше (p > 0,05).
Незавершенный курс иммунизации предполагал:
-
V1 и V2 для детей, начавших вакцинацию до 12 месяцев и получивших две дозы вакцины;
-
V1 для детей, начавших вакцинацию до 12 месяцев и получивших одну дозу вакцины;
-
V1 для детей, начавших вакцинацию после 12 месяцев и получивших одну дозу вакцины.
У детей с незавершенным курсом вакцинации уровни специфических IgG к серотипам пневмококка оказались более низкими. В группах детей, получивших всего одну дозу вакцины на первом или втором году жизни, они составили 42,2 ± 11,7 и 40,2 ± 16,2 мг/л соответственно. Дети, получившие минимум две дозы вакцины без ревакцинации (старт до 12 месяцев), имели относительно более высокий уровень — 68,2 ± 6,3 мг/л. Но, несмотря на четкую тенденцию, значимой разницы между указанными группами в нашем исследовании не было, p > 0,05.
ОБСУЖДЕНИЕ
В результате ретро- и проспективного исследования нами доказана безопасность проведенной вакцинации у детей с заболеваниями сердечно-сосудистой системы, осложненными ХСН.
Так, в исследуемой группе не зафиксировано ни одного серьезного поствакцинального осложнения, не выявлено увеличение степени и функционального класса ХСН у детей после проведения вакцинации.
Нами также показана иммунологическая эффективность вакцинации на основании значимого повышения уровня антител к S. pneumoniae в группе пациентов, получивших полный курс иммунизации согласно возрасту (p < 0,05).
Важно отметить, что среди детей с ХСН, которые начали вакцинацию в нашем Центре и получили рекомендации продолжить ее, дальнейшую иммунизацию по месту жительства по рекомендованному графику индивидуальной иммунизации прошел только каждый второй ребенок.
Треть пациентов — 52 (34%) из 153 ранее не вакцинированных — при продолжении вакцинации получали всегда только одну вакцину вопреки рекомендованным комбинациям с другими вакцинами национального календаря профилактических прививок. Таким образом, эти пациенты еще больше отставали по срокам иммунизации от сверстников, и их «догоняющий» график, рассчитанный в среднем на 6 месяцев, удлинялся минимум в 2 раза (рис. 3).
Рис. 3. Продолжение вакцинации у детей с хронической сердечной недостаточностью по месту жительства, согласно полученным рекомендациям на базе ФГАУ «НМИЦ здоровья детей» Минздрава России
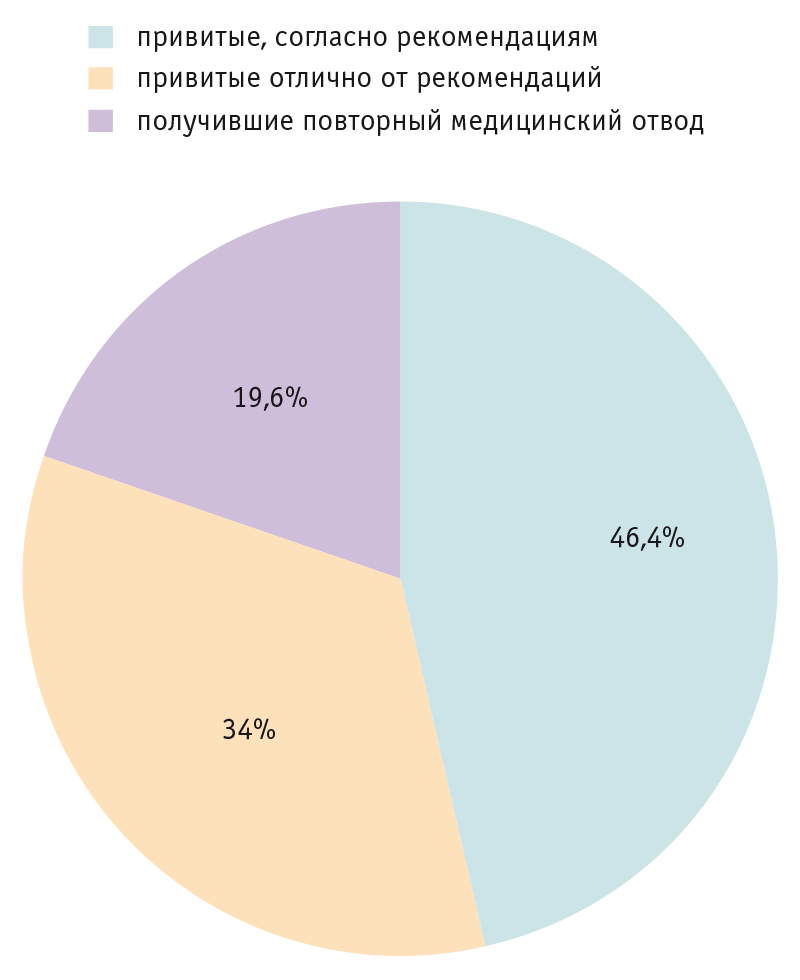
К сожалению, существует сравнительно меньшая, но довольно значимая группа детей с ХСН, которые, несмотря на составленный график вакцинации и данные им рекомендации, вновь и вновь получали необоснованный медицинский отвод от профилактических прививок — 30 (19,6%) из 153 детей. Это подчеркивает необходимость продолжения санитарно-просветительской работы не только с родителями, но и с лечащими врачами детей на местах, поскольку есть значительные сложности в преодолении антивакцинальных убеждений в медицинской среде.
ЗАКЛЮЧЕНИЕ
Дети с ХСН остаются в группе с низким охватом профилактическими прививками против пневмококковой инфекции. Способствуя необоснованным медицинским отводам от вакцинации у таких детей, мы подвергаем их риску тяжелого течения этой инфекции, что крайне опасно в отношении прогрессирования основного заболевания.
Как и дети с другими хроническими заболеваниями, пациенты с ХСН могут быть вакцинированы в рамках национального календаря профилактических прививок в стабильном состоянии по основному заболеванию. Вакцинация против пневмококковой инфекции у детей с ХСН эффективна, безопасна и должна проводиться в сроки, максимально приближенные к графику национального календаря профилактических прививок, с ограниченным набором противопоказаний.
Поступила: 28.02.2023
Принята к публикации: 27.03.2023
________
1 Хроническая сердечная недостаточность у детей. МКБ-10: I50. Союз педиатров России, Ассоциация детских кардиологов России; 2016. 44 с.








