Внебольничные пневмонии, особенно их осложненные формы, не только входят в группу самых распространенных угрожающих жизни заболеваний детского возраста, но и являются причиной применения у детей болезненных, порой травмирующих, лечебных воздействий. В доантибактеральную эру это были болезненные горчичники и банки, создание пенициллина и других парентеральных антибиотиков привело к «инъекционной эпидемии». Так, в 1980-е годы требование дробного введения пенициллина и стрептомицина 4 раза в день в разных шприцах приводило к тому, что за курс лечения пневмонии ребенок получал до 75 внутримышечных инъекций. Доказательство эффективности двукратного введения антибиотиков при пневмониях позволило сократить травматичность их лечения[1].
Дальнейшие успехи в этом направлении связаны с доказательством возможности терапии пневмонии оральными антибиотиками, а также с внедрением в практику удобных периферических венозных катетеров. К сожалению, педиатры до сих пор не доверяют оральным антибиотикам и, несмотря на клинические рекомендации, даже в амбулаторных условиях назначают антибиотики в/м (в основном цефтриаксон) 18% больных типичной и 30% больных атипичной пневмонией[2–4].
Оральные препараты реже, чем это возможно, применяются и в стационаре. Т.В. Куличенко и соавт. в своем исследовании отмечают, что среди врачей и, как следствие, среди родителей пациентов бытует мнение, что в стационаре нужно лечить только уколами, таблетки можно принимать и дома[5].
Целью данного обзора является рассмотрение методов лечения деструктивных пневмоний у детей и возможностей снижения его травматичности.
Для характеристики современных методов терапии осложненных пневмоний мы провели анализ клинических рекомендаций детских хирургов и педиатров, а также ряда показательных публикаций. Пути снижения травматичности лечения намечены на основании многолетних исследований автора, его коллектива и ряда других исследователей.
ДЕСТРУКЦИЯ ЛЕГОЧНОЙ ТКАНИ
Деструкция легочной ткани у детей является основным осложнением пневмоний, в том числе внебольничных, она в значительной степени отличается от аналогичных процессов у взрослых. У детей старше 6 месяцев деструктивные пневмонии в 85–90% случаев имеют пневмококковую этиологию, реже их вызывает Haemophilus influenzae типа b. И лишь у детей первых месяцев жизни в этиологии этих пневмоний значительна роль Staphylococcus aureus, еще реже их вызывают Escherichia coli, Klebsiella pneumoniae, другие представители кишечной флоры[4, 6].
Для деструктивных пневмоний в инфильтративной фазе характерны плотные инфильтраты, часто с выбухающей границей. Иногда в толще инфильтрата угадываются округлые тени гнойника («сливная пневмония»). Без лечения гнойное расплавление легочной ткани ведет к формированию абсцессов. Как отмечено в клинических рекомендациях детских хирургов, абсцессы у детей не содержат капсулы, характерные для классических абсцессов легких, поэтому они склонны к спонтанному опорожнению[7]. И лишь при поздно или неправильно леченной пневмонии, чаще стафилококковой и гемофильной, формируется классический абсцесс с толстыми стенками. Абсцесс возникает и при суперинфекции анаэробами, например заносимыми в легкие из полости рта при бронхоскопии.
Лихорадка, лейкоцитоз, повышенные уровни СРБ и прокальцитонина обычно не снижаются до опорожнения полостей деструкции, несмотря на применение эффективного антибиотика, — об эффективности можно судить по уменьшению инфильтративной зоны, окружающей очаг деструкции, или инфильтрата в другом легком. Сохранение активности процесса за счет гнойного очага (часто 7–10 дней и более) побуждает врачей предпринять какие-то меры для ускорения его разрешения, таких больных часто направляют в отделения детской хирургии, располагающие для этого разными возможностями.
ЛЕЧЕНИЕ ЛЕГОЧНЫХ ДЕСТРУКЦИЙ
У взрослых больных хирурги настойчиво рекомендуют активную тактику лечения абсцессов легкого. Так, Т.П. Пинчук и соавт. пишут: «В настоящее время обязательным считают выполнение бронхоскопии. В ряде случаев она позволяет установить причины абсцедирования: инородные тела, опухолевое поражение»[8]. Помимо осмотра бронхов, авторы говорят о промывании их антисептическими растворами, взятии биопсии, в ряде случаев — о введении перибронхиально антибиотиков или дренировании абсцесса. Не беремся судить о таком тотальном подходе у взрослых, тем более что авторы не имеют группы сравнения и не указывают сроки, в течение которых можно ожидать разрешения абсцесса только на фоне терапии антибиотиками. У детей дело обстоит иначе.
Отличия полостей деструкции у детей от классических абсцессов легких позволяют придерживаться более консервативной тактики. Наш многолетний опыт лечения деструктивных пневмоний показывает, что под влиянием адекватного антибиотика опорожнение (очищение) деструктивных очагов обычно происходит через систему бронхов, нередко с приступом кашля и плачем ребенка, о чем следует предупредить родителей. Хотя изменения в легком — с большой воздушной полостью и/или несколькими мелкими — выглядят на снимках (а тем более на КТ) угрожающе, они в большинстве случаев регрессируют, не требуя дополнительных вмешательств.
При восстановлении проходимости дренирующих буллы мелких бронхов они «сдуваются» и, как правило, исчезают на рентгенограмме через 3–4 недели[6]. Это положение записано и в клинических рекомендациях педиатров[2, 4].
В тех случаях, когда проводят КТ (это исследование рутинно не рекомендовано, хотя его и производят по требованию тревожных родителей), «кружевной» рисунок легочной ткани может выявляться и в более отдаленные сроки, но через 6–7 месяцев структура легочной ткани восстанавливается практически полностью.
В диагностическом отделении ФГАУ «НМИЦ здоровья детей» за 20 лет ни в одном случае лечения деструктивной пневмонии с первых ее дней не пришлось использовать ни бронхоскопию, ни дренирование по Мональди (см. клинические наблюдения 1 и 3).
Тем не менее в рекомендациях детских хирургов указано: «Всем пациентам при абсцессе легкого рекомендуется провести консервативное лечение: наряду с антибактериальной терапией целесообразно провести бронхоскопию для удаления гноя из полости абсцесса и промывание ее антисептическими растворами»[7]. Эта рекомендация делается без сcылки на исследование с контрольной группой, леченной без бронхоскопии.
Нет групп сравнения и в публикациях детских хирургов — результаты использования ими активных методов лечения легочной деструкции не сопоставляются с таковыми при терапии только антибиотиками, которой придерживаются педиатры[9–11]. В работе В.А. Тараканова и соавт. из 60 детей с деструктивной пневмонией 49 пациентам была сделана бронхоскопия, 3 — эндобронхиальное и 8 — трансторакальное дренирование, т. е. ни один больной не обошелся без этих манипуляций[10].
Даже в недавно опубликованном обзоре по лечению деструктивных пневмоний у детей консервативные подходы, используемые педиатрами, не упоминаются[11].
Мы располагаем данными отдаленного наблюдения за детьми, перенесшими деструктивную пневмонию и проходивших лечение без дополнительных вмешательств. Через 2–5 лет лишь у некоторых детей, заболевших в возрасте до 3 лет, в ранее пораженной доле может выявляться незначительное уменьшение функционального легочного кровотока (по данным сцинтиграфии) при менее чем 10%-ном снижении функций внешнего дыхания[12]. Хороший прогноз деструктивных пневмоний при консервативной терапии отмечают и зарубежные педиатры[13].
ПЛЕВРИТЫ
Плевриты — наиболее частое осложнение пневмонии, и за рубежом, и у нас часто их обозначают как парапневмонические. Это нашло отражение в используемой детскими хирургами классификации, в которой процессы, происходящие в плевре, рассматриваются как стадии парапневмонического плеврита: экссудативная, гнойно-фибринозная и стадия формирования фибриноторакса[7].
Исследования, проведенные в свое время в НИИ педиатрии РАМН и Новокузнецком государственном институте усовершенствования врачей, показали, что есть два вида плеврита, осложняющего пневмонию[1, 4, 6]. Плеврит, возникающий одновременно с пневмонией (его логично обозначать как синпневмонический, СПП), обычно гнойный, поддается своевременно начатому лечению антибиотиком вместе с пневмоническим инфильтратом. Без адекватного лечения СПП превращается в эмпиему со спаечным процессом и образованием гнойных полостей, как это указано в хирургической литературе.
У значительного числа больных пневмонией, особенно деструктивной, после начала антибактериальной терапии возникает метапневмонический плеврит (МПП). Его отличия от СПП наглядно продемонстрированы в таблице.
Таблица
Сравнительная характеристика синпневмонического и метапневмонического плевритов[12]

При МПП из экссудата на костальной плевре откладывается фибрин, часто образуя на рентгеновском снимке характерную вертикальную границу. МПП может возникать и на месте СПП со сменой гнойного экссудата на серозно-фибринозный, что, видимо, и явилось основанием для концепции этапности процесса. Выделение двух форм плевритов вошло в клинические рекомендации педиатров[2, 4].
В нашей хирургической литературе между двумя видами плеврита различий обычно не делают, обозначая серозно-фибринозный плеврит как экссудативную стадию парапневмонического плевритa[7]. Тот же подход и у зарубежных авторов, некоторые из них выделяют простую форму парапневмонического плеврита (серо-фибринозный с рН ≥ 7,2 и уровнем глюкозы ≥ 2,2 ммоль/л, т. е. параметрами, типичными для МПП), в отличие от осложненной (гнойной) формы[14].
Расшифровка патогенеза МПП показала, что он представляет собой иммунокомплексную реакцию на распад возбудителя после начала терапии[15]. МПП начинается с 1–2-дневного падения температуры, часто с уменьшением размеров легочного инфильтрата, говорящих об эффекте антибиотика. Затем температура вновь повышается, часто до 39,5–40,0°С, сохраняясь и после опорожнения полостей деструкции и снижения лейкоцитоза, нередко в течение 15–20 дней. Эта температура не связана с гнойным процессом, ее не снижают ни смена антибиотика, ни дренирование полости плевры, ни удаление из нее фибрина при торакоскопии. Фибрин рассасывается самостоятельно в течение месяца, реже — дольше (см. клинические наблюдения 2 и 3).
Иммунопатологический генез МПП подтверждается резким нарастанием концентрации иммунных комплексов в крови и плевральном экссудате с потреблением комплемента; в состав иммунных комплексов входит пневмококковый антиген. МПП сопровождается нарастанием СОЭ, часто достигающей 50–60 мм/час. Введение стероидов нормализует температуру и СОЭ за 1–2 дня, что также свидетельствует в пользу иммунной патологии.
ЛЕЧЕНИЕ ПЛЕВРИТА
Поскольку СПП регрессирует параллельно с обратным развитием пневмонии под влиянием эффективного антибиотика, рутинное проведение плевральной пункции с деонтологической точки зрения не может быть оправдано. Показаниями к пункции и дренированию плевральной полости становятся отсутствие обратной динамики процесса и чрезмерное накопление экссудата, отражающееся на дыхательной и сердечной функциях, что является общепризнанным[2, 4, 7].
Однако нельзя согласиться с рекомендацией детских хирургов проводить всем пациентам с экссудативным плевритом повторные плевральные пункции[7]. Эта рекомендация в свете данных, накопленных за последние десятилетия, не может быть обоснована: абсолютное большинство детей с СПП можно и нужно лечить без проведения плевральных пункций, о чем сказано в рекомендациях педиатров[2, 4]. У поздно и неправильно леченных больных с СПП происходят сгущение гноя, развитие спаек, что, безусловно, требует хирургических вмешательств, перечисленных в хирургической литературе и рекомендациях[7, 16].
В еще большей степени следует изменить тактику в отношении МПП с учетом его иммунопатологического характера и прогноза. В клинических рекомендациях детских хирургов говорится о том, что всех пациентов с острыми гнойными деструктивными пневмониями и с малым или умеренным объемом парапневмонического плеврита в стадии экссудации рекомендовано лечить антибиотиками и повторными плевральными пункциями, а также проводить внутриплевральное введение фибринолитических препаратов[9]. Эти же подходы оправдываются и многими зарубежными авторами, хотя эффективность фибринолиза подвергается сомнению[16, 17]. Для удаления фибрина используется также видеоторакоскопия[17].
Частота подобных вмешательств в разном сочетании, описываемая в статьях детских хирургов, приближается к 100%. Так, в цитированной выше работе манипуляции проводили всем 265 детям с плевритом: пункции — 127, видеоторакоскопию — 131, пневмолиз — 7[10]. Вряд ли у всех этих детей были пиопневмоторакс и эмпиема, при которых такая активность оправдана.
Опыт педиатрических отделений показал, что МПП, как правило, не требует ни пункции, ни дренирования (исключение — чрезмерное накопление экссудата), разрешаясь полностью при консервативной терапии. Для купирования метапневмонической лихорадки рекомендуются системные глюкокортикостероиды (ГКС)[2, 4, 6, 15]. Преднизолон per os в дозе 1 мг/кг в сут останавливает экссудацию и за 1–3 дня снижает метапневмоническую температуру и СОЭ, улучшает общее состояние, что позволяет быстро выписать больных при очень хороших результатах, по данным катамнеза.
Назначение стероидов до опорожнения полостей деструкции у некоторых родителей вызывает подозрение, что именно стероиды привели к такому развитию. Разъяснение сути подобного назначения позволяет применять ГКС сразу после появления МПП, что облегчает и укорачивает течение процесса.
Дискуссия в мировой литературе о стероидной терапии пневмоний и плеврита пока не выявила общего мнения. Эффективность раннего назначения дексаметазона у детей с простым парапневмоническим плевритом (его характеристики повторяют таковые МПП) показана в рандомизированном исследовании в Испании; при гнойном плеврите эффекта от стероидов не было[14]. Авторы исследования, однако, не указали на связь «простых» плевритов с предшествующим лечением.
Ниже мы приводим собственные клинические наблюдения, сделанные в ФГАУ «НМИЦ здоровья детей», подтверждающие эффективность консервативной терапии.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 1
Мальчик 13 месяцев, поступил на 5-й день болезни с температурой 40°С, кашлем; получал дома только ибупрофен. Состояние тяжелое, слева сзади притупление, ослабление дыхания, хрипов нет. Лейкоциты — 30 × 109/л, СОЭ — 45 мм/час, уровень СРБ — 126 мг/л. Рентгенограмма — инфильтрат нижней доли левого легкого. Назначен амоксициллин/клавуланат в дозе 90 мг/кг/сут в/в, ребенок продолжал лихорадить 4,5 дня, когда развился эпизод кашля, беспокойства, плача (о его возможности мать была предупреждена).
На снимке появились воздушные полости, свидетельствовавшие об очищении очагов деструкции, температура нормализовалась, внутривенный препарат был заменен на оральный (общий курс — 9 дней). Дальнейшее течение — гладкое, ребенок выписан домой на 10-й день (15-й день болезни) (рис. 1).
Рис. 1. Рентгенограммы мальчика 13 месяцев при поступлении (А) и на 5-й день лечения (В). Стрелкой показана очистившаяся полость деструкции. Здесь и далее в статье иллюстрации автора
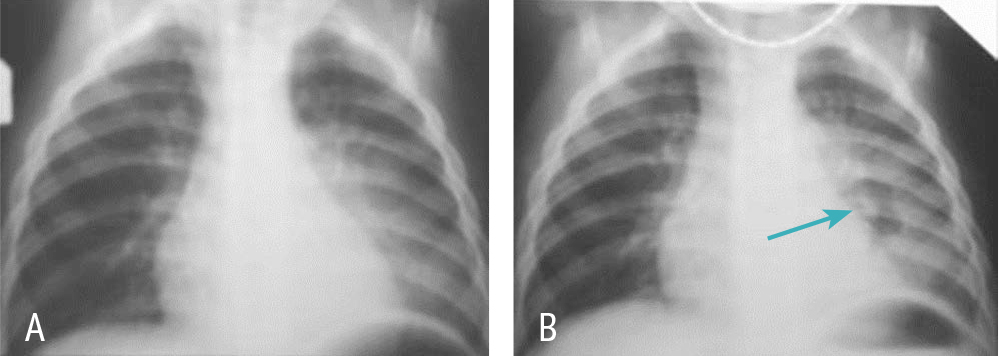
Комментарий к наблюдению. Долевая пневмония с лейкоцитозом 30 × 109/л без лечения в течение 5 дней у годовалого ребенка — скорее всего деструктивная, в связи с этим ожидать падения температуры следует не на 1–2-й день, а позже; мать предупредили о возможности «респираторного эпизода» и даже пневмоторакса. После очищения полостей ребенка перевели на оральную терапию. Прорыв образовавшейся полости в плевру маловероятен (это возможно при множественных полостях, очищающихся несинхронно).
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 2
Мальчик 6 лет, поступил на 6-й день болезни с двусторонней пневмонией (правой верхней и левой нижней доли — рис. 2А), с температурой 39,2°С, числом лейкоцитов 17 × 109/л и СОЭ 27 мм/час. На 3-и сутки лечения амоксициллином/клавуланатом в дозе 89 мг/кг/сут в/в наблюдалась кратковременная нормализация температуры (на 36 часов) с новым повышением до фебрильных цифр, снижением числа лейкоцитов до 8,2 × 109/л и увеличением СОЭ до 48 мм/час.
На рентгенограмме на 5-е сутки лечения (рис. 2В) видны существенное уменьшение размеров инфильтратов, особенно отчетливое слева, образование воздушных полостей и появление экссудата справа. При пункции получен серозно-фибринозный экссудат с цитозом 450 кл/мкл; рН = 7,35, уровень глюкозы — 3,8 ммоль/л (МПП).
Рис. 2. Рентгенограммы мальчика 6 лет при поступлении (А) и на 5-й день лечения (В)
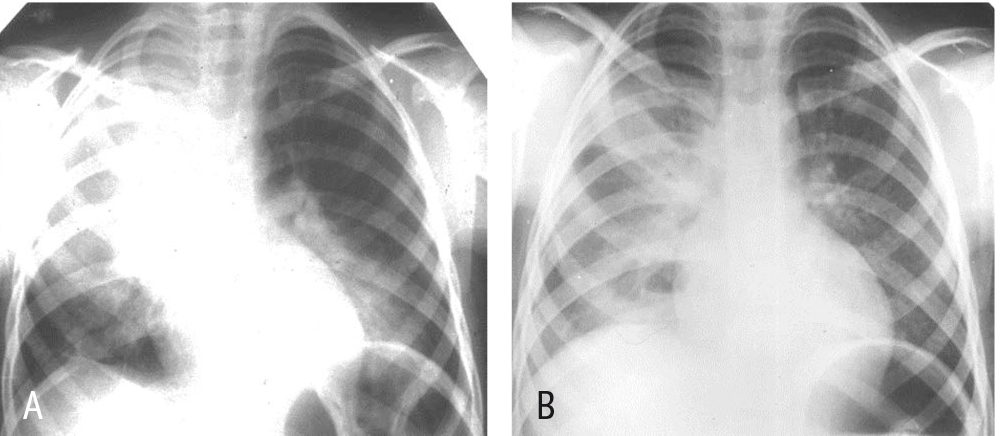
На 10-й день антибактериального лечения фебрильная температура сохранялась, введен преднизолон внутрь 1 мг/кг/сут, что привело к нормализации температуры через сутки, снижению СОЭ до 6 мм/час. Дальнейшее течение — гладкое. Курс антибиотика — 12 дней, преднизолона — 3 дня (см. рис. 2).
Комментарий к наблюдению. Происшедшее на 3-и сутки лечения защищенным амоксициллином показывает, с одной стороны, клинический эффект (падение температуры и лейкоцитоза, выраженное уменьшение инфильтратов в обоих легких), с другой — иммунопатологическую реакцию в ответ на лечение: возникновение серозно-фибринозного плеврита и стойкой метапневмонической лихорадки, повышение СОЭ наряду с очищением полостей в инфильтрате в правом легком. Назначение преднизолона купировало лихорадку, курс лечения антибитиками был сокращен, и ребенка выписали домой. В последние десятилетия мы не проводим плевральную пункцию таким больным ввиду ясности картины.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 3
Ребенок Т., 2 года 8 месяцев. Заболел остро с повышением температуры до 39,5°С. Поступил на 6-й день болезни в тяжелом состоянии с температурой 39,7°С; SaO2 96%. Зафиксированы укорочение перкуторного звука справа, лейкоцитоз — 13,2 × 109/л, СОЭ — 40 мм/час, уровень СРБ — 230 мг/л. Был назначен цефтриаксон в дозе 80 мг/кг/сут, температура упала до нормальной на 1 день, после чего она оставалась на фебрильном уровне. На рентгенограмме — правосторонняя нижнедолевая пневмония.
К 7-му дню лечения нормализовались число лейкоцитов и концентрация СРБ, СОЭ выросла до 80 мм/час. На рентгенограмме появились воздушные полости на месте инфильтрата и необильный выпот в правой плевральной полости; эта динамика при сохранении температуры на высоком уровне говорила о метапневмонической природе процесса.
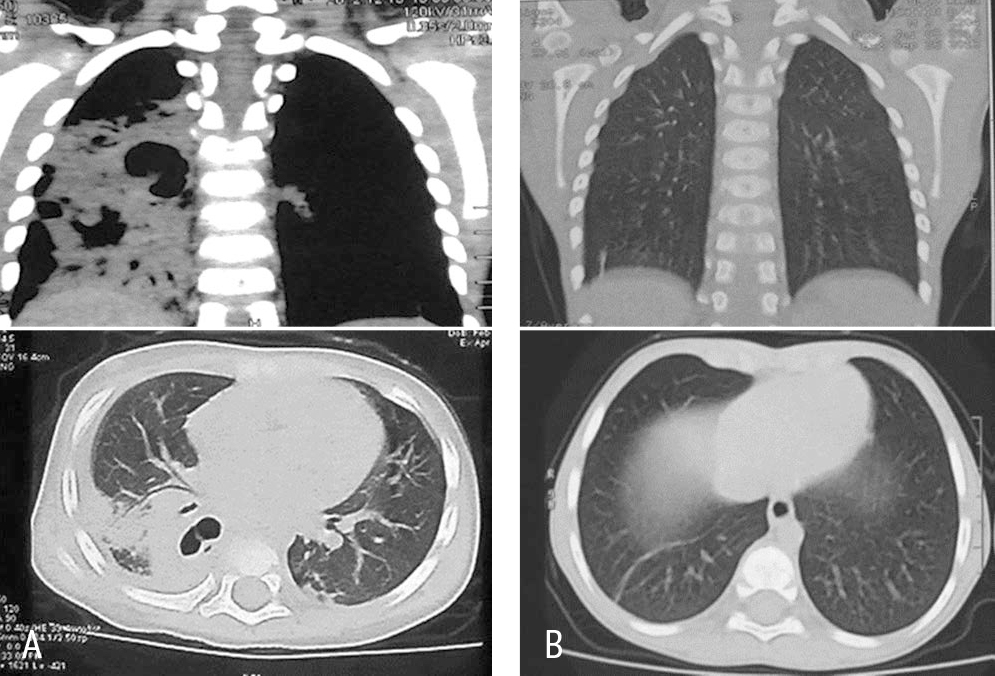
Родители потребовали проведения КТ (рис. 3А), на которой более четко обозначились множественные полости в нижней правой доле и небольшое количество жидкости в полости плевры.
Рис. 3. Мультиспиральные компьютерные томограммы ребенка Т в острый период (А) и через 7 месяцев (В)
Родители отказались от введения преднизолона и потребовали «усилить антибактериальное лечение»: с 8-го по 18-й день ребенок получал последовательно меропенем и линезолид с амикацином, что не повлияло на уровень температуры и картину в легком. Преднизолон (1 мг/кг/сут на 4 дня) был назначен с 19-го дня, падение температуры произошло в тот же день с нормализацией СОЭ на 3-й день.
Катамнез через 7 месяцев: ребенок здоров, физикальных изменений в легких нет. КТ: полное восстановление структуры легкого, небольшая шварта в нижнем легочном поле (рис. 3В).
Комментарий к наблюдению. У данного больного ситуация была ясна уже к 7-му дню лечения — очищение полостей деструкции и МПП + лихорадка с СОЭ 80 мм/час. Однако предложение назначить преднизолон было отвергнуто родителями, проведенная по их настоянию КТ новой информации не дала. Не было никакого эффекта и от смены антибиотиков. Через 7 месяцев и клинически, и на мультиспиральной КТ остаточные явления легочного процесса отсутствовали.
ЗАКЛЮЧЕНИЕ
Совершенствование любого вида лечения предусматривает в итоге уменьшение его инвазивности. Доказательство преимущественно пневмококковой этиологии легочной деструкции, иммунологического генеза метапневмонического плеврита позволило обосновать описанные выше щадящие подходы к лечению деструктивных пневмоний; они опубликованы три десятилетия тому назад в руководстве по болезням органов дыхания у детей и 6 его последующих изданиях[1, 6]. Изучение резистентности пневмококков, проведенное во многих регионах России, показало неэффективность макролидов, а корректировка дозировок β-лактамов повысила их эффективность[3, 6]. Это позволило резко сократить потребность в хирургической помощи детям с осложненными пневмониями.
Гладкое течение и полноту выздоровления осложненной пневмонии при 14-дневном лечении амоксициллином или амоксициллином/клавуланатом (последний в России предпочтителен ввиду отсутствия пока массовой вакцинации против Haemophilus influenzae b) подтверждают и педиатры в Швейцарии[18]. Правда, всем больным они проводили диагностическую плевральную пункцию, чтобы установить этиологию. Их результат: 79% — пневмококк, 11% — гемолитический стрептококк, 6% — стафилококк, 4% — другая флора — оказался вполне ожидаемым, вряд ли следует для этого пунктировать всех больных.
Но стереотипы ломаются долго, хочется призвать детских хирургов испробовать предложенные щадящие методы, сокращая проведение пункций и ограничивая применение инвазивных процедур теми случаями, когда без них обойтись невозможно.
Поступила: 24.01.2022
Принята к публикации: 20.02.2022








