Синдром Мак-Кьюна — Олбрайта — Брайцева (МОБ) — генетически обусловленное заболевание, как правило, характеризующееся триадой симптомов: наличием специфических пятен цвета кофе с молоком, фиброзной дисплазией костей и разнообразными эндокринопатиями, наиболее частой из которых является преждевременное половое развитие [7, 10, 13].
Это панэтническое заболевание, частота встречаемости которого в мире варьирует от 1 случая на 100 тысяч до 1 случая на миллион в общей популяции. Установка диагноза зачастую затруднительна. Как следствие, заболевание может быть неверно расценено или не диагностировано вовсе, что усложняет определение его более точной распространенности. Этому редкому заболеванию подвержены оба пола, однако у девочек оно встречается в 2 раза чаще, чем у мальчиков. Некоторые авторы придерживаются мнения, что синдромом МОБ страдают только девочки. Это может быть объяснено тем, что один из наиболее характерных симптомов заболевания — преждевременное половое развитие — у девочек отмечается в 9 раз чаще, чем у мальчиков. Другие проявления синдрома МОБ у представителей обоих полов встречаются примерно с одинаковой частотой [10, 14, 15].
Синдром МОБ вызывается мутацией в гене, известном как GNAS1. Этот ген кодирует альфа-субъединицу гуанидинтрифосфатсвязывающего белка (G-белка), стимулирующего образование цАМФ, который, помимо прочего, регулирует работу многих эндокринных желез в организме. Мутантный белок постоянно активирует аденилатциклазу, внутриклеточный уровень цАМФ повышается, что приводит к самопроизвольному «включению» секреции гормонов. GNAS1 находится на длинном плече 20-й хромосомы (20q13.2). Описываемая клеточная мутация происходит на ранних стадиях эмбриогенеза, в первые 10 недель беременности. В этом случае мутация локализуется не во всех клетках организма, а только в отдельных клонах мутантной клетки (данная закономерность известна как генетический мозаицизм). Следовательно, чем раньше в процессе эмбрионального развития происходит мутация, тем большее количество клеток будет иметь структурный дефект, что обусловливает разнообразие клинических проявлений заболевания [5, 8, 9, 13].
Активация альфа-субъединицы G-белка и повышение внутриклеточного уровня цАМФ определяют симптомы заболевания. Известно, что синтез меланина и его транспорт в эпителиальные клетки стимулируются меланостимулирующим гормоном и АКТГ. Рецепторы этих гормонов используют цАМФ в качестве посредника. Соответственно, при росте уровня цАМФ возрастает продукция меланина при нормальных значениях АКТГ и меланостимулирующего гормона, что объясняет образование пятен гиперпигментации. По такому же принципу происходит активация синтеза эстрогенов вне зависимости от гонадотропинов. Это приводит к образованию фолликулярных кист яичников и гонадотропиннезависимому преждевременному половому созреванию. Кроме того, цАМФ участвует в дифференцировке остеобластов в костной ткани. Считается, что именно неконтролируемая активация остеобластов вследствие мутации гена GNAS1 способствует развитию фиброзной дисплазии у лиц с синдромом МОБ [5, 7, 8, 13].
Цель статьи: продемонстрировать вариабельность клинических проявлений синдрома МОБ у двух пациенток на протяжении 10-летнего периода наблюдения.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ № 1
Девочка М., 16 лет.
Основной диагноз: синдром Мак-Кьюна — Олбрайта — Брайцева.
Осложнения. Фиброзная полиостозная дисплазия правой бедренной, правой большеберцовой, правой и левой плечевых костей. Состояние после остеопластики с эндопротезированием правого бедра. Гонадотропиннезависимое преждевременное половое развитие. Кистозная трансформация яичников.
Сопутствующий диагноз: бронхиальная астма, аллергическая, легкого течения.
Дебют заболевания в возрасте 1,5 года, когда отмечались увеличение молочных желез и появление менструальноподобных кровотечений. При первом обследовании девочки в 5 лет: рост — 117 см (коэффициент стандартного отклонения (standard deviation score — SDS) роста составил +1,63, что соответствовало возрастной норме); вес — 20,5 кг; пятно округлой формы цвета кофе с молоком на передней брюшной стенке размером до 2 см; изменений скелета не обнаружено; половое развитие по Таннеру — 1‒3 (В3Р1); костный возраст соответствовал 9 годам; при проведении пробы с люлиберином подтверждено гонадотропиннезависимое преждевременное половое развитие (высокий пубертатный уровень эстрадиола и отсутствие пубертатного подъема гонадотропинов при стимуляции люлиберином); при УЗИ эхокартина органов малого таза соответствовала возрасту 9 лет; имелась бронхиальная астма, аллергическая, легкого течения.
С 5,5 до 8,5 года девочка в рамках клинического исследования получала терапию анастрозолом (ингибитор ароматазы, снижающий синтез эстрадиола в периферических тканях). На этом фоне сохранялись менструальноподобные кровотечения с частотой несколько раз в год, отмечено дальнейшее прогрессирование роста и костного возраста. В 5,7 года рост девочки составлял 121,4 см; в 5,9 года — 122 см; в 6,5 года — 123 см (костный возраст достиг 10 лет); в 8 лет — 136 см; в 8,5 года — 140,8 см (костный возраст увеличился до 11,5 года). Терапия была прекращена по инициативе родителей пациентки в связи с отсутствием выраженного эффекта и аллергическими проявлениями.
С 10 лет менструальноподобные кровотечения участились до почти ежемесячных, неоднократно выявлялись очень высокие значения эстрадиола (до 1634 пмоль/л), при УЗИ малого таза впервые выявлена кистозная трансформация яичников. Рост к 10 годам составил 143 см.
В 13 лет менструальные кровотечения приобрели циклический характер. При проведении УЗИ органов малого таза выявлены кистозная деформация правого яичника, параовариальная киста слева. По данным рентгенографии кистей, зоны роста закрыты. Пациенткой достигнут конечный рост 148 см.
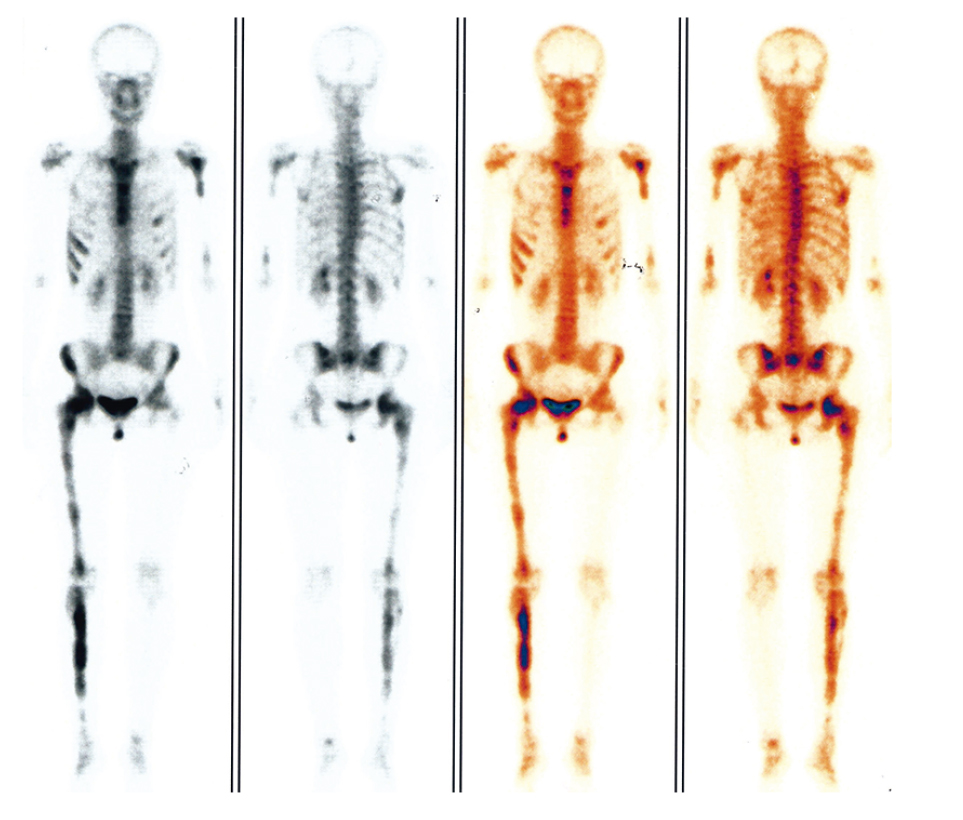
В 14 лет у девочки появились боли в правом бедре. При рентгенографии выявлена фиброзная дисплазия правого бедра (рис. 1). Сцинтиграфия с технецием продемонстрировала очаги поражения в правой большеберцовой кости, левой плечевой (независимые очаги в верхней и нижней третях) и правой плечевой (дистальный метафиз) костях, в углу правой лопатки, в грудине и ребрах (рис. 2). Позже фиброзная полиостозная дисплазия правой большеберцовой, правой и левой плечевых костей была подтверждена рентгенологически.
Рис. 1. Рентгенограмма правого бедра пациентки М., 14 лет. Деформация бедренной кости по типу «пастушьего посоха». Фото авторов
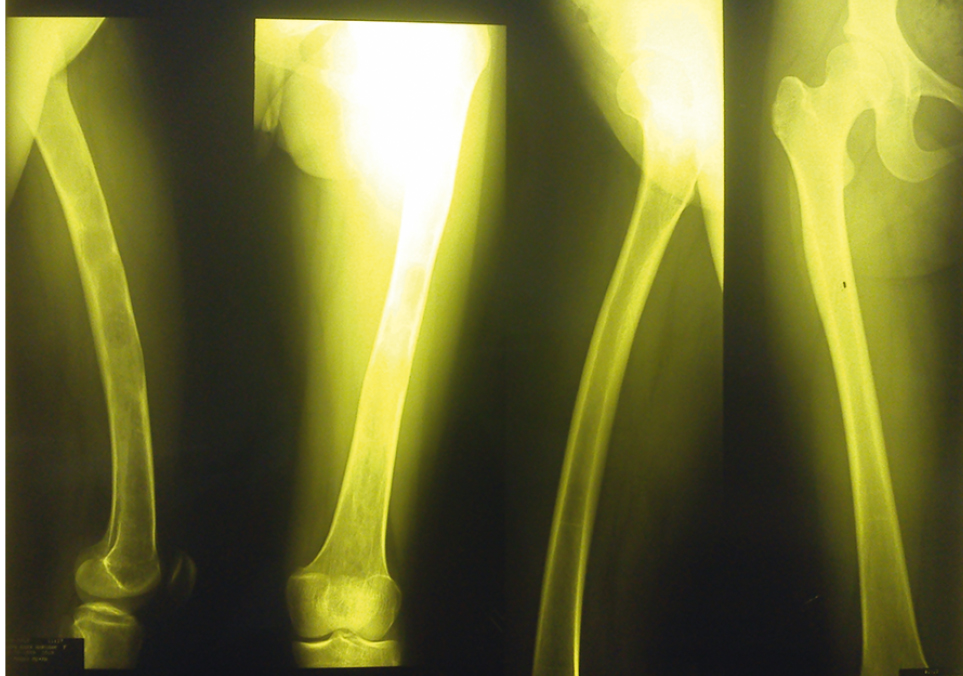
Рис. 2. Результат обзорной сцинтиграфии с технецием пациентки М., 14 лет. Фото авторов
В 14 лет проведена остеопластика правой бедренной кости с эндопротезированием. В 16 лет пациентка стала часто жаловаться на боли в животе после физической нагрузки и на боли в правой голени. При проведении УЗИ выявлены пять кист правого яичника от 1,8 до 2,1 см в диаметре. По результатам гормонального исследования, эстрадиол — 3261 пмоль/л. На рентгенограммах правой голени обращает на себя внимание выраженное истончение кортикального слоя в средней трети большеберцовой кости. Рекомендована плановая остеопластика правой голени.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ № 2
Девочка С., 15 лет.
Основной диагноз: синдром Мак-Кьюна — Олбрайта — Брайцева.
Осложнения. Фиброзная полиостозная дисплазия бедренных (состояние после остеопластики и эндопротезирования) и правой малоберцовой костей. Корешковый синдром D12‒S1. Нейрогенный мочевой пузырь.
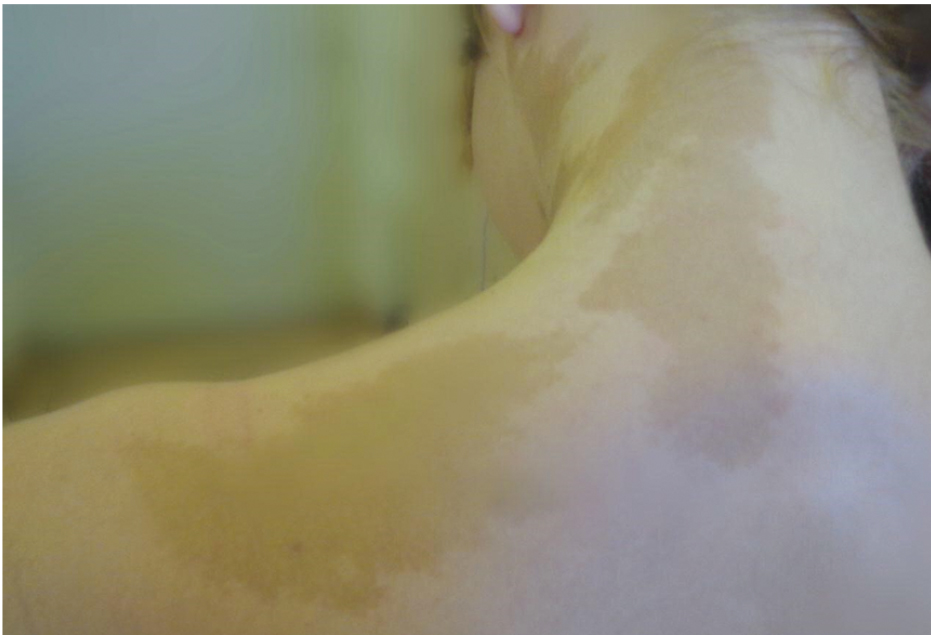
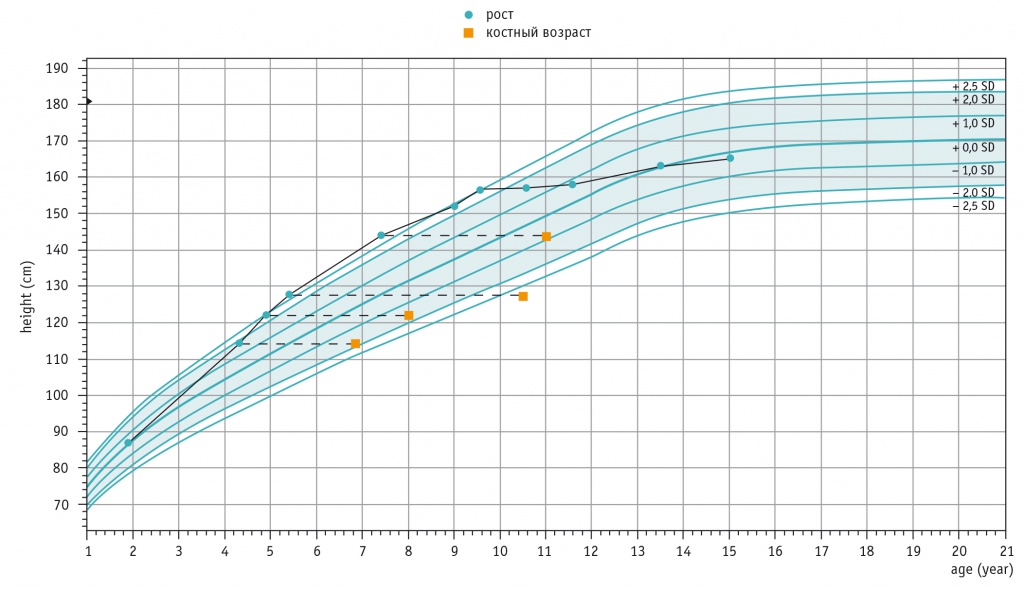
Дебют заболевания в возрасте 1,9 года, когда впервые были отмечены увеличение молочных желез, ускорение роста и появились менструальноподобные кровотечения. При обследовании в 4 года рост составил 114,3 см (SDS роста — +2,68, что соответствовало высокорослости), вес — 21,8 кг. Были выявлены три обширных пятна цвета кофе с молоком — на левой стороне шеи (рис. 3) и в пояснично-крестцовом отделе; отмечались хромота на левую ногу, асимметрия лица с деформацией правой глазницы. Костный возраст соответствовал 6,9 года. При проведении пробы с люлиберином подтверждено гонадотропиннезависимое преждевременное половое развитие; эхокартина органов малого таза соответствовала 9 годам. При рентгенографии выявлена перестройка структуры левой бедренной кости по типу фиброзной дисплазии с периостальными наслоениями, очаговыми просветлениями и элементами остеосклероза; указанные изменения выявлялись также в дистальной трети вертлужной впадины.
Рис. 3. Пациентка С., 15 лет. Пятна цвета кофе с молоком. Фото авторов
С 4 до 8 лет пациентка в рамках клинического исследования получала терапию ингибитором ароматазы анастрозолом без эффекта (менструальноподобные кровотечения сохранялись с частотой 1‒2 раза в год). В связи с выявлением фиброзной дисплазии была также назначена терапия алендроновой кислотой (бисфосфонатом), которую она получала в течение 1,5 года, однако из-за выраженных диспептических явлений пациентка от терапии отказалась. В 5 лет рост девочки составлял 122 см, костный возраст соответствовал 8 годам; в 5,5 года рост девочки достиг 129 см, костный возраст — 10,5 года.
При обследовании в 7,5 года: рост — 145 см, костный возраст — 11 лет. Впервые выявлено выраженное повышение уровня ЩФ — до 2528 Ед/л (норма — 0‒240 Ед/л). При проведении КТ обнаружена распространенная фиброзная остеодистрофия костей таза, бедренных костей, позвонков и остистых отростков, а также костей черепа (преимущественно лицевой части) с деформацией правой глазницы. Девочка была проконсультирована ортопедом, установлен диагноз: фиброзно-кистозная дисплазия костей таза и шеек обеих бедренных костей, укорочение левой конечности на 1,5 см; фиброзно-кистозная дисплазия грудного и поясничного отделов позвоночника; люмбализация S1, протрузия дисков L3‒L4, L4‒L5, L5‒S1, S1‒S2, грудопоясничный сколиоз 2-й степени. Пациентке рекомендовано ношение корсета.
В 9 лет рост девочки составил 152 см, в 9,5 года — 157 см, костный возраст увеличился до 11,5 года, менструальный цикл стал регулярным, беспокоили постоянные выраженные боли в спине. По данным биохимического исследования крови, ЩФ — 1963,3 Ед/л. В условиях стационара проведено лечение золедроновой кислотой (бисфосфонатом), на фоне чего пациентка отметила временное купирование болевого синдрома.
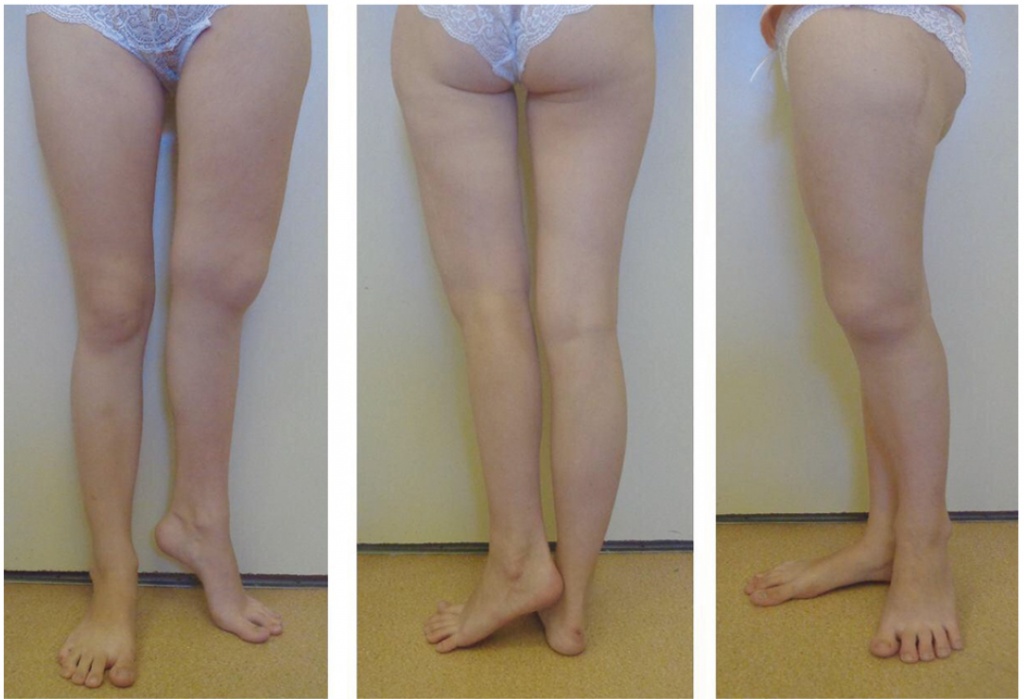
В связи с прогрессированием деформации бедра по типу «пастушьего посоха» с 11 до 14 лет девочка неоднократно перенесла остеосинтез и эндопротезирование костей сначала левой, а позднее и правой ноги. В 13 лет ее рост достиг 163 см, в 15 лет конечный рост составил 165,5 см (соответствует среднепопуляционным значениям для женщин), вес — 47 кг. Зоны роста закрыты. ЩФ — 440 Ед/л. После последней операции на правой ноге девочка отмечает явную положительную динамику: стала передвигаться на костылях (до этого на коляске). Однако сохраняются боли в левой ноге, выраженное ее укорочение и веретенообразная деформация (рис. 4). Присоединились боли в правой голени, где при проведении рентгенографии обнаружены очаги дисплазии в малоберцовой кости. При консультации невролога выявлен корешковый синдром D12‒S1, диагностирован нейрогенный мочевой пузырь, вероятно, вследствие поражения позвоночника основным заболеванием. Данное состояние является противопоказанием для проведения спинальной анестезии при хирургических вмешательствах. На ближайшее время запланировано продолжить оперативное лечение левой ноги с учетом особенностей пациентки.
Рис. 4. Пациентка С., 15 лет. Внешний вид нижней конечности с деформацией по типу «пастушьего посоха». Фото авторов
ОБСУЖДЕНИЕ
У наблюдаемых нами девочек синдром МОБ манифестировал с преждевременного полового развития (не считая пятен цвета кофе с молоком, имевшихся в обоих случаях еще при рождении) примерно в одинаковом возрасте — 1,5 и 1,9 года. Для синдрома МОБ характерно гонадотропиннезависимое преждевременное половое развитие, когда активация продукции гормонов гонадами осуществляется без участия гонадотропинов. При этом происходит повышение уровня эстрогенов в сыворотке крови при низких (допубертатных) значениях гонадотропных гормонов (лютеинизирующего и фолликулостимулирующего), как это было у наших пациенток.
Преждевременное половое развитие при синдроме МОБ чаще выявляется после первого года жизни и характеризуется менструальноподобными кровотечениями и увеличением грудных желез (телархе). Адренархе (лобковое и аксиллярное оволосение) нехарактерно. Основными клиническими признаками преждевременного полового развития у наших пациенток были увеличение грудных желез (В3 по Таннеру) и кровянистые выделения из половых путей. Важно отметить, что эстрогенизация при этом заболевании не приводит к наступлению менархе; свойственны скорее менструальноподобные кровотечения, обусловленные резкими колебаниями уровня эстрогенов, однако цикличность процесса обычно не отмечается [1, 2, 10].
Костный возраст является важным критерием в оценке больных с преждевременным половым развитием, так как отражает степень воздействия половых стероидов на костную ткань. Высокий уровень половых гормонов при длительном их воздействии значительно ускоряет прогрессирование костного возраста [1‒4]. В обоих клинических наблюдениях уже при первом обследовании костный возраст девочек опережал хронологический на 3‒4 года. Первая пациентка имела гораздо более тяжелые проявления преждевременного полового развития на протяжении всего периода наблюдения. Это привело к более раннему закрытию зон роста и, как следствие, к низкорослости (148 см). Конечный рост второй пациентки, с умеренными проявлениями преждевременного полового развития, соответствует среднепопуляционным значениям (165,5 см). Графики роста пациенток представлены на рисунках 5 и 6.
Рис. 5. Кривая роста пациентки М., см
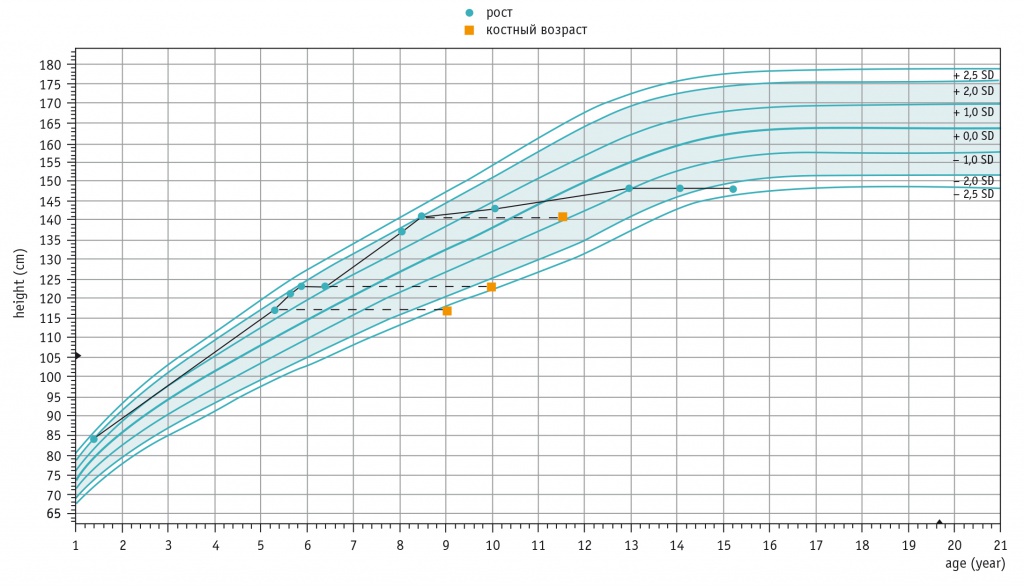
Рис. 6. Кривая роста пациентки С., см
Наиболее тяжелыми проявлениями заболевания являются костные нарушения. Фиброзно-кистозная дисплазия представляет собой фокальное замещение кортикального слоя пролиферирующими фибробластами, чаще поражаются длинные трубчатые кости. Наличие кист приводит к деформации кости, возникновению патологических переломов с искривлением нижележащего края конечности, формированию ложных суставов. Наиболее типичной является деформация бедра, имеющего вид «пастушьего посоха». Формирование фиброзных кист в костях лицевого скелета и основания черепа может приводить к лицевой асимметрии, одностороннему экзофтальму, в редких случаях — к атрофии зрительного нерва, потере слуха и пр. [6, 7, 14].
У первой девочки фиброзная дисплазия костей сформировалась относительно поздно и потребовала хирургического лечения лишь в возрасте 14 лет. У второй пациентки костные нарушения развились значительно раньше, нарушение походки и асимметрия лицевого скелета отмечались уже в 4 года, что привело к тяжелым последствиям и инвалидизации больной. Интересно отметить, что пятен гиперпигментации во втором наблюдении было больше и они были более обширными, что подтверждает закономерность связи между размерами пятен и степенью фиброзно-кистозного поражения костей скелета [10, 13, 15].
Для оценки состояния костного аппарата используются различные методы лучевой диагностики (рентгенография, КТ и МРТ). На начальных этапах заболевания на рентгеновских снимках пораженной кости выявляются зоны, напоминающие по виду матовое стекло. На более поздних стадиях участок приобретает характерный крапчатый вид: очаги уплотнения чередуются с участками просветления. Патологические переломы, а также деформации проксимального конца бедренной кости в виде «пастушьего посоха» являются классическими признаками заболевания, выявляемыми при рентгенодиагностике. При обнаружении одиночного очага необходимо исключить множественное поражение костей, которое на начальных стадиях может протекать бессимптомно. Для этого используется такой метод, как остеосцинтиграфия [6, 7, 12‒14]. У первой пациентки при обследовании в связи с болями в правом бедре было рентгенологически подтверждено наличие фиброзной дисплазии правой бедренной кости. Болей в других костях скелета пациентка не отмечала. Однако при проведении сцинтиграфии обнаружилось множественное поражение костей скелета (см. рис. 2).
У второй пациентки клинические проявления фиброзной дисплазии левой бедренной кости и правой глазницы были очевидны уже в возрасте 4 лет. В связи с прогрессированием клинических симптомов и выявлением очень высокого уровня ЩФ в возрасте 7,5 года пациентке с целью поиска очагов поражения костного скелета была проведена КТ.
Лечение синдрома МОБ направлено на облегчение симптомов заболевания и в каждом случае индивидуально, поскольку зависит от преобладания того или иного симптома у конкретного больного. Для лечения могут потребоваться скоординированные усилия специалистов разных профилей — педиатров, эндокринологов, ортопедов, хирургов, гинекологов, неврологов и др. [12].
При возможности консервативной терапии фиброзной дисплазии используют препараты, известные как бисфосфонаты, такие как памидроновая кислота, алендроновая кислота, золедроновая кислота и др. Бисфосфонаты — это синтетические аналоги естественных пирофосфатов, они составляют костный матрикс и ингибируют костную резорбцию [10, 12, 13].
Хирургические методы лечения используют при необходимости коррекции конечности вследствие ее деформации и укорочения, а также для устранения возможных осложнений (например, выраженного болевого синдрома при сдавлении нерва).
У девочки С. нарушение походки стало отмечаться в возрасте 4 лет. При рентгенографии выявлена перестройка структуры левой бедренной кости и дистальной трети вертлужной впадины по типу фиброзной дисплазии. На данном этапе была назначена консервативная терапия бисфосфонатами, которые девочка получала курсами, длительно. Однако костные изменения прогрессировали. Деформации левого, а позднее и правого бедра по типу «пастушьего посоха» потребовали хирургического вмешательства и проведения остеосинтеза и эндопротезирования.
Для лечения преждевременного полового созревания возможно назначение ингибиторов ароматазы (анастрозол, тестолактон) с целью снижения гиперэстрогении, а также препаратов, блокирующих рецепторы к эстрогенам (тамоксифен) [11, 13]. Однако у наших пациенток значимого эффекта от данной терапии не наблюдалось.
Спешить с хирургическим вмешательством в отношении фолликулярных кист не рекомендуется, так как кисты, не превышающие 3‒4 см в диаметре, в течение 2‒3 месяцев, как правило, претерпевают обратное развитие. При легком течении преждевременного полового развития от медикаментозной терапии можно воздержаться, в таком случае достаточно ограничиться наблюдением в динамике [12].
ЗАКЛЮЧЕНИЕ
Представленные нами клинические случаи синдрома Мак-Кьюна — Олбрайта — Брайцева демонстрируют вариабельность клинических проявлений основных составляющих данного заболевания — гонадотропиннезависимого преждевременного полового развития и фиброзной костной дисплазии. Учитывая тяжесть поражения и сочетанный характер патологии, такие пациенты нуждаются в постоянном наблюдении команды специалистов — педиатров, эндокринологов, ортопедов, хирургов, гинекологов, неврологов и др.








