Аутизм — расстройство, возникающее вследствие нарушения развития ЦНС и других органов и систем плода и характеризующееся выраженным дефицитом социального взаимодействия и общения, а также ограниченными интересами и повторяющимися действиями. Указанные признаки начинают проявляться в возрасте до трех лет [13]. Схожие состояния, при которых отмечаются более мягкие признаки и симптомы, относят к расстройствам аутистического спектра (РАС) [17].
По данным Всемирной организации аутизма, за 2007–2016 гг. количество детей с РАС выросло в 10 раз [3, 18]. Распространенность РАС во всем мире ежегодно увеличивается на 14%. В 2015–2016 гг. на 60–80 новорожденных приходился один ребенок с таким расстройством [11]. В 85‒95% случаев причинами РАС являются эпигенетические факторы, лишь в 5–15% наблюдений они связаны с генными дефектами [19, 20].
В целом аутизм следует рассматривать как группу врожденных мультисистемных заболеваний, не ограничивающихся нарушениями функций нервной системы. Изменения у детей с аутизмом наблюдаются со стороны разных органов и систем [9, 19]. Хронические влияния инфекционных антигенов или токсических химических факторов на организм женщины в первую половину беременности часто ведут к стойким иммунным нарушениям (нередко субклиническим). Последние включают изменение продукции ряда аутоантител (ауто-АТ) класса IgG и провоспалительных цитокинов, вследствие чего нарушаются процессы онтогенетического формирования и созревания структур головного мозга и ряда других органов и систем плода [6].
В нашей работе проанализирована частота нарушения профилей сывороточной иммунореактивности (изменения продукции ряда нейротропных ауто-АТ) у детей с РАС и их матерей.
Цель исследования: определение содержания материнских ауто-АТ и изучение их роли в формировании нервной системы ребенка.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на базе медицинского исследовательского центра «Иммункулус» под руководством д. м. н. С. Г. Цахиловой и д. м. н., профессора, научного руководителя центра «Иммункулус» А. Б. Полетаева. Обследованы 50 пациенток, родивших детей с РАС, в возрасте от 25 до 35 лет (средний возраст составил 30,0 ± 1,5 года) и 50 их детей (38 мальчиков и 12 девочек) в возрасте от 1 года до 3 лет с диагностированным РАС и характерной клинической симптоматикой.
Исследовали образцы сывороток крови, хранившиеся не более 2 суток после получения при температуре от +1 до +4 °С. Иммунохимический анализ проводили с помощью метода ЭЛИ-Нейро-Теста, используя одноименные тест-наборы («Иммункулус», г. Москва). Постановки иммуноферментных реакций выполняли описанным ранее способом [6, 7]. В образцах сывороток крови выявляли и анализировали индивидуальные профили сывороточной иммунореактивности, зависящие от изменений в относительном содержании ауто-АТ класса IgG, направленных к 12 антигенам: нейрофиламентному протеину (NF-200), глиальному фибриллярному кислому протеину (GFAP), белку S100, основному белку миелина, вольтажзависимому Са-каналу, ацетилхолиновым рецепторам, глутаматным рецепторам, ГАМК-рецепторам, дофаминовым рецепторам, серотониновым рецепторам, опиатным µ-рецепторам, β-эндорфину (табл. 1) [7].
Таблица 1
Изменения, отражаемые маркерными нейротропными аутоантителами при проведении ЭЛИ-Нейро-Теста [7]
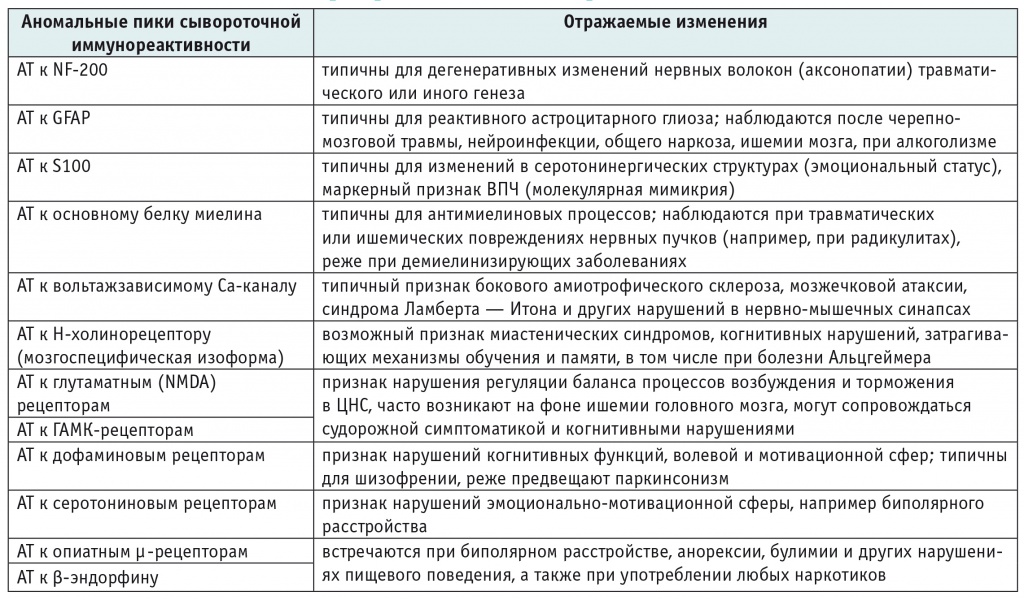
Примечание. АТ в таблицах 1, 2 — антитела; ВПЧ — вирус папилломы человека.
Постановки реакций проб сыворотки крови каждого обследуемого с каждым из антигенов проводили на одном и том же 96-луночном планшете. На этом же планшете производились постановки реакций контрольной сыворотки с каждым из антигенов. Все постановки дублировали. Использовали стандартные процедуры твердофазного ИФА. Уровень оптической плотности реакции контрольной сыворотки с каждым из антигенов принимали за 100%, а интенсивность реакций сывороток крови пациентов с теми же антигенами рассчитывали по отношению к реакции контрольной сыворотки [7]. Затем рассчитывали среднюю индивидуальную иммунореактивность исследуемых образцов с каждым из антигенов в сравнении с реакцией контрольной сыворотки по формуле:
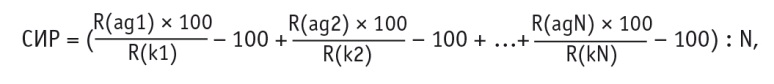
где: СИР — средняя индивидуальная иммунореактивность сыворотки крови пациента по отношению ко всем используемым антигенам, выраженная в процентах от средней иммунореактивности контрольной сыворотки с теми же антигенами;
R(ag1, 2…N) — реактивность сыворотки крови исследуемого пациента с антигенами 1, 2…N (в единицах оптической плотности);
R(k1, k2…N) — реактивность контрольной сыворотки с антигенами 1, 2…N (в единицах оптической плотности).
Для построения профилей иммунореактивности рассчитывали отклонение (в процентах от индивидуальной СИР) сыворотки исследуемого пациента с каждым из используемых антигенов по формулам:
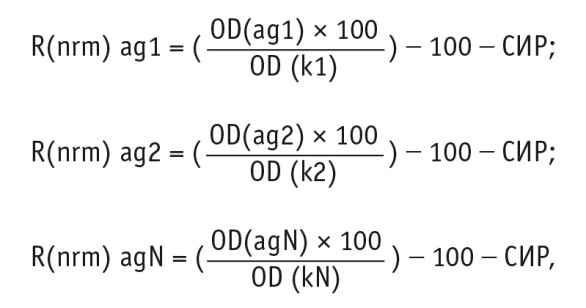
где: R(nrm) ag1, ag2…agN — отклонение сыворотки крови исследуемого пациента с каждым из используемых антигенов 1, 2…N (в процентах от индивидуального среднего нормализованного уровня реакции);
OD(ag1, ag2…agN) — оптическая плотность реакции сыворотки крови индивидуального пациента с каждым из используемых антигенов 1, 2…N;
OD(k1, k2…KN ) — оптическая плотность реакции контрольной сыворотки с каждым из используемых антигенов 1, 2…N.
При выполнении ЭЛИ-Нейро-Теста величина N составляла 12 (по числу антигенов тест-набора). Проводилась оценка амплитуды пиков сывороточной иммунореактивности. Избирательные сдвиги относительной иммунореактивности с теми или иными антигенами выше +10% или ниже ‒20% от индивидуального среднего уровня рассматривали как аномальные пики. Для расчетов использовали специализированную компьютерную программу, поставляемую вместе с наборами.
Статистический анализ полученных результатов проводили с помощью методов непараметрической статистики (критерий U Уилкоксона — Манна — Уитни).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
За счет снижения или, наоборот, аномального повышения болевого порога у большинства детей, страдающих аутизмом, нарушено восприятие боли [15, 16]. При анализе результатов ЭЛИ-Нейро-Теста выявлены характерные для детей-аутистов сдвиги профилей сывороточной реактивности, связанные с изменением содержания ауто-АТ к опиатным µ-рецепторам и/или β-эндорфину (в 88,0% наблюдений) (табл. 2), что может являться еще одним аргументом в пользу представлений об изменениях эндогенной опиатной системы при аутизме. Интересно, что и у большинства (84,0%) матерей был обнаружен сдвиг этих профилей иммунореактивности. Эндогенная опиатная система обеспечивает эмоциональное позитивное подкрепление полового и пищевого поведения, а опиатные µ-рецепторы наиболее обильно экспрессируются в тонком кишечнике и головном мозге [14]. Возможно, что с неадекватной реакцией эндогенной опиатной системы организма на пищевые экзорфины связаны нарушения пищевого поведения (булимия и анорексия). Неудивительно, что активация опиатных рецепторов ведет к увеличению потребления пищи, а оральное введение антагонистов опиатных µ-рецепторов снижает чувство голода и тормозит потребление пищи.
Таблица 2
Аномалии профилей иммунореактивности у матерей и детей с аутизмом, выявленные при проведении ЭЛИ-Нейро-Теста
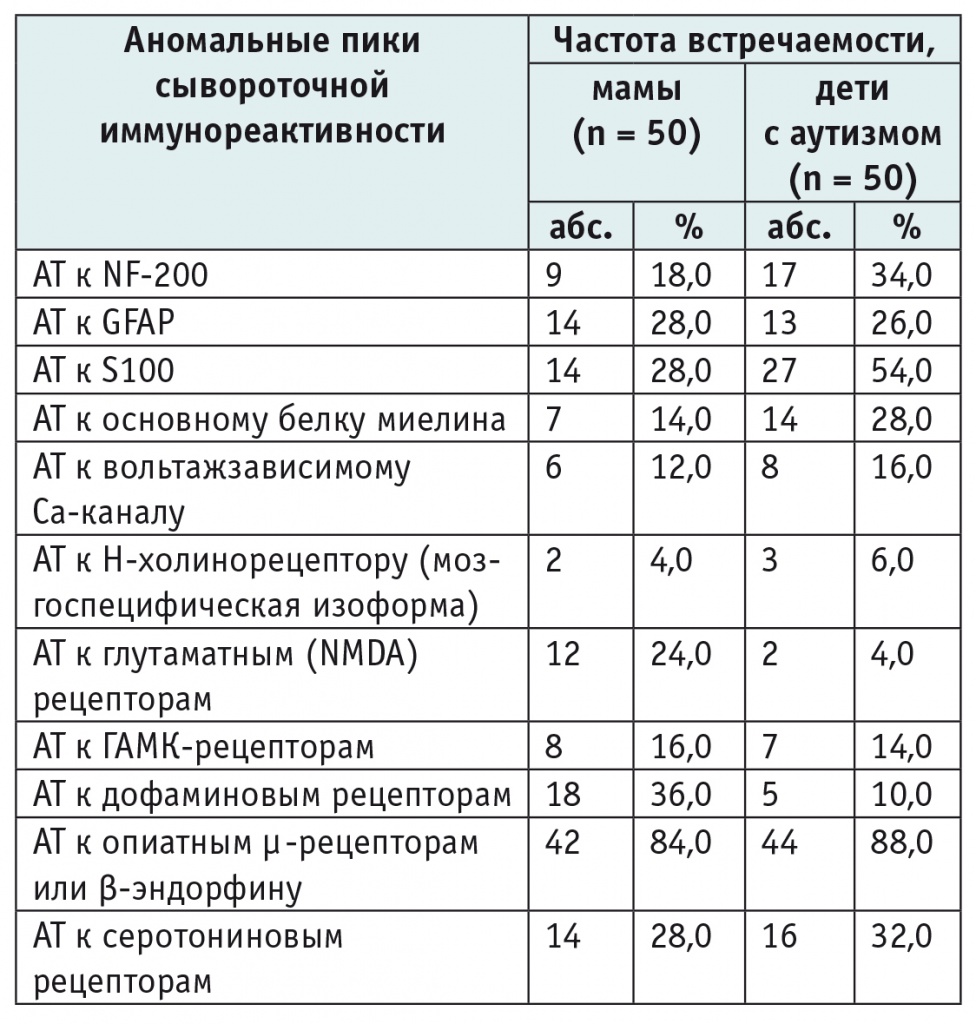
Изменения в профилях иммунореактивности детей с аутизмом были обусловлены также ауто-АТ к серотониновым рецепторам (n = 16), белкам аксонов или белкам миелиновых оболочек аксонов (n = 14), белку S100 (n = 27), к маркеру глиоза — белку GFAP (n = 13). Такие же изменения регистрировались у матерей.
Выявленные в нашей работе изменения в эндогенной опиатной системе не только представляют академический интерес, но и могут рассматриваться как указание на дополнительные патогенетически обоснованные меры, направленные на коррекцию состояния у детей с аутизмом. Кроме того, характерные изменения ауто-АТ к компонентам опиатной системы могут служить прогностическими маркерами повышенного риска рождения детей с аутизмом уже на этапах прегравидарной подготовки женщин.
Помимо изменений профилей иммунореактивности, ассоциированных с ауто-АТ к компонентам опиатной системы, у матерей и их детей-аутистов выявлено сходство аномалий иммунореактивности, ассоциированных с ауто-АТ к NF-200, S100 и серотониновым рецепторам (см. табл. 2).
Естественные нейротропные антитела участвуют в функциональном сопряжении нервной и иммунной систем, а изменение их продукции может сопровождаться нарушением деятельности мозга [8]. У зрелой женщины небольшие изменения в сывороточном содержании нейротропных антител имеют в основном субклиническую выраженность и не сказываются заметно на объективном состоянии и самочувствии [12]. Однако трансплацентарное поступление таких антител к плоду может быть фактором риска возникновения патологии нервной системы у плода и новорожденного ввиду отсутствия сформированных механизмов компенсации и защиты.
ЗАКЛЮЧЕНИЕ
Результаты представленного исследования в очередной раз подтверждают феномен «материнского импринтинга», который играет одну из главенствующих ролей в формировании расстройств аутистического спектра еще во внутриутробном периоде. Избыток сывороточного содержания определяемых аутоантител у женщин сопровождается эмбриотоксическими эффектами и приводит к патологическому течению беременности. Патогенез нарушений гестации отчасти обусловливается участием естественных аутоантител в клиренсе организма беременной женщины и плода от продуктов катаболизма. Выявление аномалий иммунного статуса беременной женщины важно для оценки рисков развития соматических, эндокринных и неврологических изменений у ребенка в первые месяцы и годы жизни.
Обнаруженные в работе иммунологические изменения могут служить прогностическими маркерами существенного повышения риска осложнений беременности, способных привести к рождению детей, страдающих аутизмом. Простой и надежный метод диагностики этих изменений (ЭЛИ-Нейро-Тест) может применяться для массовых обследований женщин, планирующих беременность и относящихся к группе риска (например, уже имеющих ребенка с аутизмом). Выявленные изменения обратимы [7] и подлежат коррекции до беременности.








