Повышение уровня мочевой кислоты (МК) в сыворотке крови пациента вызывает обоснованную настороженность клинициста, являясь маркером ряда патологических процессов в организме человека.
МК — продукт метаболизма пуриносодержащих соединений, образующихся в результате распада клеточных структур организма (бо’льшая часть) и поступающих извне (меньшая часть). Нуклеиновые кислоты и свободные нуклеотиды катаболизируются в организме до гипоксантина и ксантина, последний окисляется до МК посредством фермента ксантиноксидазы.
Выведение МК из организма происходит через почки (две трети общего объема, из них 99% реабсорбируется в проксимальных почечных канальцах) и кишечник, в котором кишечные бактерии метаболизируют оставшуюся треть общего объема.
При концентрации выше 404 мкмоль/л осаждаются ионы МК и формируются ее кристаллы, которые могут откладываться в различных тканях [1–3]. Уровень МК более 360 мкмоль/л (> 6 мг/дл), при котором возможен процесс ее кристаллизации в физиологических условиях, рассматривается как гиперурикемия (ГУ), причем независимо от пола [4].
При отсутствии клинических симптомов подагры ГУ называют асимптоматической, ее разделяют на асимптоматическую ГУ с наличием и отсутствием кристаллов уратов [5]. Последние могут обнаруживаться и в отсутствие приступов подагры [6].
Распространенность ГУ в мире варьирует от 6,4% до 24,3% [7–10]. В Российской Федерации, по данным, полученным в рамках исследования ЭССЕ-РФ, она составляет 16,8% (25,3% среди мужчин и 11,3% среди женщин) [11]. Частота ГУ увеличивается после 30 лет у мужчин и после 50 лет у женщин [12, 13]. Половые различия в концентрации МК обусловлены урикозурическим действием эстрогенов, генетическими и внешними факторами (например, меньшим количеством потребляемого алкоголя) [14–16].
Цель обзора — анализ современных данных о причинах развития гиперурикемии, ее влиянии на формирование заболеваний сердечно-сосудистой системы и почек, обменных расстройств, а также о возможности их лечения и профилактики посредством контроля уровня мочевой кислоты.
ПРИЧИНЫ ГИПЕРУРИКЕМИИ
В основе ГУ лежат снижение экскреции МК, повышение ее продукции и сочетание данных факторов. С возрастом ведущие позиции в развитии ГУ начинают занимать приобретенные факторы: артериальная гипертензия (АГ), метаболический синдром (МС), хроническая болезнь почек (ХБП), прием диуретиков и аспирина, ожирение, злоупотребление алкоголем, менопауза у женщин, — тогда как воздействие наследственных факторов (врожденные ферментопатии) реализуется обычно в первой половине жизни [17, 18].
МК, являясь возможным компонентом МС, увеличивается пропорционально росту ИМТ и окружности талии [19, 20].
Избыточный вес часто ассоциирован с инсулинорезистентностью (ИР) и повышением продукции лептина, снижающего выведение МК. Сопряженная с ИР гиперинсулинемия уменьшает почечную экскрецию МК, приводя к ГУ [21].
Триглицериды, чья повышенная концентрация является компонентом МС, могут стимулировать синтез пуринов de novo, увеличивая продукцию МК [22, 23].
Развитие ГУ при злоупотреблении алкоголем связано со стимуляцией продукции пуринов, а также снижением экскреции МК за счет содержащегося в крепких напитках свинца [24].
Факт повышения уровня МК при длительном лечении диуретиками, прежде всего тиазидными, известен уже около полувека [25]. Их действие на уратный обмен реализуется посредством как увеличения реабсорбции, так и уменьшения канальцевой секреции МК [26].
Провоцирует ГУ прием низких доз ацетилсалициловой кислоты (75–100 мг), нарушающий экскрецию МК, особенно в пожилом возрасте [27, 28].
Уровень МК коррелирует с распространенностью ХБП [29]. Развитие ГУ потенцируется нарушениями работы уратных транспортеров в почках, как генетическими, так и приобретенными [30].
ВЛИЯНИЕ ГИПЕРУРИКЕМИИ НА РАЗВИТИЕ ЗАБОЛЕВАНИЙ
Наиболее изучено значение ГУ при подагре как единственного фактора ее формирования. Хотя наличие ГУ имеет облигатное значение для образования кристаллов, подагра развивается только у 18,8% больных ГУ за 5-летний период [31], что показывает влияние на ее развитие дополнительных, пока недостаточно изученных факторов.
Определенное время ГУ может протекать бессимптомно, но часто ассоциируется с субклиническим воспалением и эрозией костей [6]. Даже на стадии бессимптомной ГУ более чем в 20% случаев кристаллы МК обнаруживаются в различных органах и тканях [5, 32], чаще в суставах нижних конечностей.
Типичное проявление подагры — подагрическая атака. Это острый приступ воспаления сустава, возникающий внезапно, чаще в ночные и ранние утренние часы, сопровождающийся интенсивной болью, гиперемией, отеком и гипертермией. Дебютным суставом примерно в 70% случаев выступает 1-й плюснефаланговый сустав, реже — другие суставы нижних конечностей, еще реже — суставы верхних конечностей (более характерны для женщин, страдающих остеоартритом, и соответствуют топике их поражения [33]).
При отсутствии адекватного лечения заболевание прогрессирует, сохраняющееся образование кристаллов приводит к его хроническому течению, в том числе постоянному воспалению, увеличению числа приступов, развитию тофусов, структурному повреждению суставов и нарушению их функции.
Помимо подагры, ГУ ассоциирована с кардиоваскулярной и цереброваскулярной патологией, метаболическими нарушениями, снижением функции почек — состояниями, актуальность которых обусловлена широкой распространенностью и высоким уровнем затрат на лечение [34–36].
Гиперурикемия и хроническая болезнь почек
В исследованиях in vivo показано нефротоксичное действие ГУ, проявляющееся снижением почечной функции, развитием АГ, протеинурии, сосудистых заболеваний, повреждением почечной паренхимы с формированием гломерулосклероза и тубулоинтерстициального фиброза. ГУ усугубляет сопутствующую сердечно-сосудистую патологию за счет участия в активации систем ренин-ангиотензина и циклооксигеназы 2 при прогрессирующей ХБП [37, 38]. Снижение функции почек ускоряется пропорционально росту концентрации МК сыворотки крови [39–41].
Гиперурикемия и артериальная гипертензия
Известна роль ГУ как предиктора АГ [42]. МК нарушает гломерулярную гемодинамику, блокирует выделение эндотелиальными клетками оксида азота, провоцируя вазоконстрикцию и артериосклероз [43, 44].
По результатам метаанализа 18 проспективных когортных исследований [45] и одного из последних популяционных исследований (39 233 участников) [46] ГУ ассоциируется с повышенным риском развития АГ: скорректированный ОР = 1,41; 95%-й ДИ [1,23–1,58] [46]. К аналогичным выводам пришли также другие авторы [47–49].
Обнаружена корреляция между повышением концентрации МК в сыворотке крови и последующим развитием АГ даже при умеренной ГУ (< 404 мкмоль/л, или < 6,8 мг/дл) у 25-летних представителей обоих полов [48].
A.F. Cicero и соавт. описали взаимосвязь роста уровня МК с неадекватным медикаментозным контролем АД у пациентов, а также с возможной его причиной — повышенной жесткостью стенок артерий [49].
ГУ является предиктором сердечно-сосудистых заболеваний (ССЗ) и сахарного диабета 2 типа при АГ, что показано в метаанализе, включавшем 17 исследований и 82 419 участников [50].
Гиперурикемия и сердечно-сосудистые заболевания
Бессимптомная ГУ — независимый фактор риска развития ССЗ [51]. Поскольку МК стимулирует производство ангиотензина II, окислительный стресс и пролиферацию гладкомышечных клеток сосудов [52], ее концентрация напрямую коррелирует с выраженностью сердечной недостаточности (СН) [53], являясь маркером неблагоприятного исхода [54], в частности развития острого инфаркта миокарда [55].
ГУ увеличивает риск формирования фибрилляции предсердий (ФП): частота пароксизмов ФП у пациентов с ГУ достоверно выше, чем у лиц без ГУ (10,2% и 2,7% соответственно; p = 0,026). Участвуя в процессе ремоделирования предсердий, ГУ является потенциальным механизмом, лежащим в основе повышенного риска ФП у пациентов с подагрой [56, 57].
Гиперурикемия, ожирение и метаболический синдром
Ассоциация ГУ с ожирением в рамках МС обусловлена влиянием МК на развитие хронического субклинического воспаления в жировой ткани и формированием ИР: МК стимулирует выработку провоспалительных факторов в жировой ткани, таких как MCP-1, снижает выработку адипонектина, активизирующего действие инсулина в скелетных мышцах и печеночной ткани и обратно коррелирующего с факторами сердечно-сосудистого риска [58, 59].
Ассоциация ГУ с МС показана еще в 2007 г. в ходе перспективного наблюдения 1370 детей и подростков в возрасте 12–17 лет [60]. Установлена корреляция ГУ у молодых лиц (18–30 лет) с повышением ИМТ, сывороточного уровня инсулина натощак, концентрации триглицеридов и снижением уровня ЛПВП [61]. МК связана с основными компонентами МС как у мужчин, так и у женщин в возрасте старше 60 лет и является его предиктором [62]. В недавнем исследовании с 402 участниками ГУ в сочетании с АГ в рамках МС была ассоциирована с повышением жесткости артериальной стенки [63].
ГУ — показатель неблагоприятного метаболического фенотипа, развития окислительного стресса, нарушения эндотелиальной функции [64].
В 5-летнем ретроспективном исследовании с включением 9721 японца (представители обоих полов; средний возраст — 48,5 ± 10,5 года) показано сочетание метаболически здорового ожирения и ГУ в качестве предиктора развития гипертензии и сахарного диабета 2 типа [65].
Выявлена корреляция повышения уровня МК с атеросклерозом сонных артерий у детей с ожирением [66].
Гиперурикемия и ВИЧ-инфекция
ГУ значительно чаще встречается у пациентов с ВИЧ, чем в общей популяции, являясь маркером прогрессирования инфекции [67], а также присоединения оппортунистических инфекций, аутоиммунных и паранеопластических заболеваний, кахексии [68, 69].
Гиперурикемия и риск смерти
С ГУ ассоциировано увеличение риска общей смерти, более ранней смерти и развития сердечно-сосудистой патологии [70–72]. Повышение уровня МК на каждый 1 мг/дл приводит к возрастанию риска общей смерти на 9% и риска развития ССЗ на 20% [71]. Длительно неконтролируемая ГУ до развития подагры за счет ассоциации с кардиоваскулярными, ренальными и метаболическими расстройствами является одной из ведущих причин высокой смертности при подагре [73].
ЛЕЧЕНИЕ ГИПЕРУРИКЕМИИ И ПОДАГРЫ
Задачи терапии — снижение концентрации МК в сыворотке крови до целевых значений и ее пожизненное поддержание на данном уровне, позволяющее улучшить качество жизни пациентов, уменьшить частоту приступов артрита вплоть до полного прекращения, стабилизировать развитие коморбидной патологии и даже риск смертельного исхода [74–76].
Необходимый компонент лечения — коррекция ассоциированных с ГУ АГ, гипергликемии, гиперлипидемии, избыточного веса с ограничением приема богатой пуринами пищи животного происхождения, алкоголя, сахаросодержащих напитков и включением в рацион овощей, молочных продуктов [77]. Однако данные методы имеют значение лишь при длительном комплексном воздействии и часто применяются совместно с лекарственной терапией.
Сразу после установления диагноза подагры уратснижающую терапию (УСТ) необходимо начинать у пациентов моложе 40 лет, при уровне МК более 480 мкмоль/л (> 8,0 мг/дл) и/или наличии сопутствующих заболеваний: почечной недостаточности, АГ, ишемической болезни сердца (ИБС), СН [75]. В остальных случаях лекарственная терапия подагры инициируется при рецидивах приступов артрита (≥ 2 в год), наличии тофусов, уратной артропатии и уратном нефролитиазе.
Целью являются предотвращение образования кристаллов моноурата натрия и растворение уже сформированных, что обеспечивается стойким снижением сывороточного уровня МК до значений менее 360 мкмоль/л (< 6 мг/дл). При образовании тофусов, подагрической артропатии или частых приступах артрита целевой считается концентрация МК менее 300 мкмоль/л (< 5 мг/дл) [78].
Препарат первой линии терапии — аллопуринол, структурный изомер гипоксантина, ингибитор ксантиноксидазы, снижающий уровень МК за счет уменьшения ее эндогенной продукции (уменьшения окисления гипоксантина до ксантина и ксантина до МК).
Аллопуринол уже более 50 лет занимает лидирующее положение в лечении ГУ при подагре, а также других ассоциированных с ней заболеваний (миелопролиферативный синдром, наследственные ферментопатии — синдром Лёша — Нихена и др.) [79].
Начальная доза препарата составляет 50–100 мг/сут, далее она повышается каждые 2–4 недели до достижения целевого уровня МК [75].
В большинстве случаев доза препарата находится в диапазоне 300–600 мг/сут. Назначение аллопуринола в субтерапевтической дозировке не обеспечивает контроль ГУ, приводя к прогрессированию заболевания и снижая приверженность лечению [80]. В некоторых странах доза препарата лимитируется в зависимости от функции почек. Вместе с тем имеются данные, что увеличение дозировки аллопуринола более 300 мг/сут не влечет за собой нарастание частоты нежелательных лекарственных явлений, в том числе и в случае снижения функции почек [81]. При правильном титровании целевой уровень МК сыворотки крови достигается в среднем в 70% случаев [82–84].
Максимально допустимая суточная доза аллопуринола — 900 мг [85]. Схема проведения УСТ представлена на рисунке.
Рисунок 1. Схема уратснижающей терапии у пациентов с подагрой.
* Коррекция дозы проводится в зависимости от почечной функции
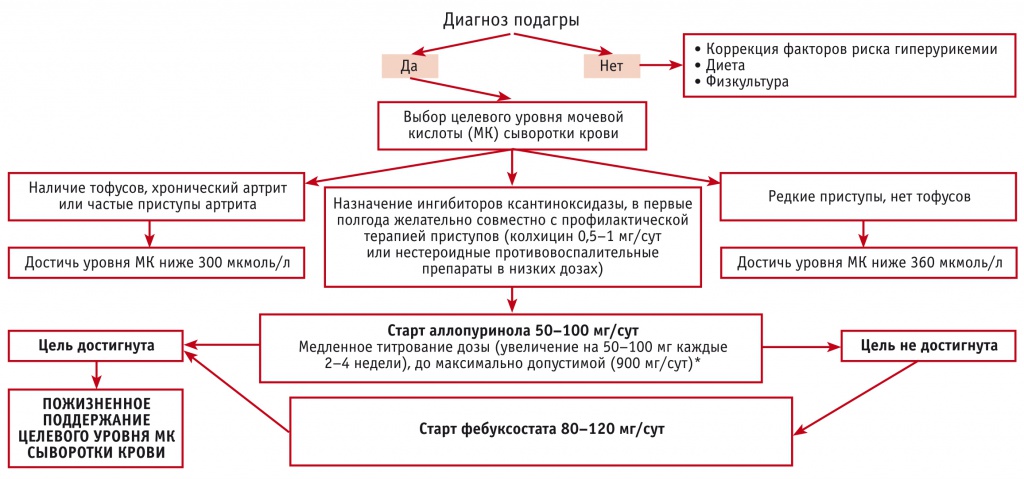
При неэффективности аллопуринола в максимальных дозировках может назначаться фебуксостат, селективный ингибитор ксантиноксидазы, в суточной дозе от 40 до 120 мг. Препарат может быть эффективен даже в случае недостаточности аллопуринола при сниженной функции почек.
Адекватная УСТ снижает потребность в медицинской помощи, риск обострений артрита и даже смерти у больных подагрой [86]. Напротив, УСТ, не обеспечивающая поддержания должного уровня МК, увеличивает риск приступов артрита, его хронизации и роста тофусов [87, 88]. Например, в НИИ ревматологии только у 23% из 160 больных подагрой мужчин за 7-летний период наблюдения определялось достижение целевого уровня МК на фоне УСТ, а хроническое течение заболевания, являвшееся следствием недостаточного контроля ГУ, ассоциировалось с ростом сопутствующей патологии [89].
В настоящее время обсуждается возможность медикаментозной коррекции бессимптомной ГУ. Вполне вероятно, что именно эффективная УСТ на этапе асимптоматической ГУ позволит выполнить стратегически важную задачу — профилактику коморбидных заболеваний и ассоциированных с ними неблагоприятных исходов.
Так, помимо растворения кристаллов моноурата натрия, ингибиторы ксантиноксидазы обеспечивают профилактику развития атеросклероза, дисфункции эндотелия и ССЗ [90–92].
По данным проспективного когортного исследования с участием 40 623 тайваньцев в возрасте ≥ 17 лет, продолжавшегося в течение 6,5 года, у 1189 пациентов с подагрой, не получавших УСТ, имелся повышенный риск сердечно-сосудистой смерти (ОР = 2,43; 95%-й ДИ [1,33–4,45]) и смерти от всех причин (ОР = 1,45; 95%-й ДИ [1,05–2,00]) по сравнению с теми, кто не страдал подагрой и также не получал УСТ. В то же время у 764 пациентов с подагрой, принимавших уратснижающие средства, риск сердечно-сосудистой смерти и смерти от всех причин был ниже, чем у больных подагрой, не получавших лекарственной терапии (ОР = 0,29; 95%-й ДИ [0,11–0,80] против ОР = 0,47; 95%-й ДИ [0,29–0,79]) [93].
УСТ может изменить прогноз и при СН. Более чем 30-дневное применение аллопуринола снижало риск декомпенсации СН и смертельного исхода у пациентов с СН [94].
Медикаментозное снижение концентрации МК до значений менее 6 мг/дл позволяет замедлить прогрессирование ХБП [95]. Системный метаанализ рандомизированных контролируемых исследований с участием 992 пациентов выявил коррелировавшее со снижением концентрации МК в сыворотке крови снижение АД, улучшение скорости клубочковой фильтрации и снижение уровня сывороточного креатинина при приеме аллопуринола в течение 3 месяцев и более [96].
У пациентов, в среднем 7 лет принимавших аллопуринол в дозе 100 мг/дл, достоверно реже развивались почечная недостаточность и ССЗ (инфаркт миокарда, реваскуляризация коронарных артерий или стенокардия, застойная СН, цереброваскулярная болезнь и заболевания периферических сосудов) [97].
K. Joo и соавт. показали, что адекватная УСТ, помимо острого артрита, сокращает частоту АГ и ССЗ [74]. Статистически значимое снижение САД и ДАД при применении аллопуринола показано у подростков с впервые выявленной эссенциальной АГ и уровнем МК ≥ 6 мг/дл [98]. Установлены связь приема аллопуринола со снижением САД и ДАД и зависимость гипотензивного эффекта от его дозы у пожилых пациентов (р < 0,001) [99]. Наконец, метаанализ 2016 г. показал, что аллопуринол, назначаемый для коррекции ГУ, уменьшает САД и ДАД независимо от приема гипотензивных препаратов и ассоциируется со снижением уровня креатинина сыворотки крови [100].
Назначение аллопуринола перед проведением коронарного шунтирования приводило к улучшению сердечной функции, возможно за счет снижения продукции свободных радикалов [101]. Применение аллопуринола улучшало ишемический порог и электрокардиографические признаки ишемии миокарда у пациентов с ИБС [102]. Прием аллопуринола также ассоциирован с уменьшением риска развития инфаркта миокарда [103, 104].
S. Rekhraj и соавт. в небольшом исследовании с участием 66 пациентов с ИБС и гипертрофией левого желудочка показали, что прием высоких доз аллопуринола (600 мг/сут) улучшает эндотелиальную функцию, приводит к регрессии массы левого желудочка и уменьшает его конечный систолический объем [105].
В 2016 г. в когортном исследовании K.S. Larsen и соавт. продемонстрировали, что прием аллопуринола уменьшает риск развития ССЗ у пациентов с ГУ [106]. Непрерывная терапия аллопуринолом продолжительностью более 3 лет ассоциировалась со снижением риска ишемических атак при цереброваскулярной болезни [107].
В исследовании P. Higgins и соавт., включавшем 80 пациентов с недавним ишемическим инсультом или транзиторной ишемической атакой в анамнезе (средний возраст — 67,8 года), прием аллопуринола статистически значимо снижал АД и приводил к замедлению прогрессирования толщины интима-медиа коронарных артерий в течение года по сравнению с плацебо [108].
Длительный (более 10 лет) прием аллопуринола ассоциирован со статистически значимым снижением риска инсульта (ОР = 0,50; 95%-й ДИ [0,32–0,80]) и сердечно-сосудистых катастроф (ОР = 0,61; 95%-й ДИ [0,43–0,87]) у пациентов старше 65 лет [109].
ЗАКЛЮЧЕНИЕ
Есть все основания рассматривать гиперурикемию как новую мишень терапии, направленной на профилактику заболеваний почек, сердца, сосудов. Коррекция гиперурикемии может повысить качество и продолжительность жизни пациентов.








