ВВЕДЕНИЕ
Несмотря на активное внедрение скрининговых программ по профилактике рака шейки матки (РШМ), данное заболевание продолжает занимать одно из лидирующих мест среди злокачественных опухолей репродуктивной системы у женщин. В ряде случаев РШМ является быстропрогрессирующим заболеванием, которое поражает женщин в различные периоды жизни, включая репродуктивный возраст. По данным Международного агентства по изучению рака, ежегодно в мире регистрируются свыше 550 тысяч новых случаев РШМ, более половины из которых имеют смертельный исход [1]. В Российской Федерации РШМ занимает 3-е место среди онкологических заболеваний репродуктивных органов у женщин, уступая раку молочной железы и раку тела матки [2].
Основной этиологический фактор канцерогенеза шейки матки (ШМ) — высокоонкогенные типы ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 59, 68) [1]. В клинической практике диагностика неопластических процессов ШМ проводится по схеме, включающей цитологическое исследование (жидкостная цитология, Пап-тест), ВПЧ-тестирование, кольпоскопию, а также прицельную биопсию с последующим гистологическим исследованием материала (по показаниям). В ряде случаев для оценки индивидуального риска выполняют иммуноцитохимический и иммуногистохимический анализ (маркеры — р16, Ki-67). В число задач цитологического исследования входит выявление предраковых заболеваний ШМ для их своевременного лечения [3].
Корреляция результатов морфологических методов исследования — цитологии и гистологии — является одним из важных критериев оценки качества скрининга РШМ. Анализ данных исследования I. Alanbay и соавт. показал, что 31% цитологических заключений не соответствует последующему гистологическому диагнозу [4]. R. Gupta и соавт. при сопоставлении цитологических и гистологических заключений выявили значительные несоответствия в 6,4% случаев и незначительные — в 20,4% [5]. В целом 20,4% несовпадений получены в исследовании B.A. Crothers и соавт. [6]. В мультицентровом исследовании KGOG 1040 обнаружено 7,9% несовпадений результатов цитологии (внутриэпителиальных злокачественных изменений или злокачественности не выявлено — NILM; атипичные плоские клетки неясного значения; плоскоклеточное интраэпителиальное поражение низкой степени — LSIL) с гистологическими диагнозами при поражениях высокой степени злокачественности — тяжелых цервикальных интраэпителиальных неоплазиях (CIN II–III) и РШМ [7].
Для обеспечения полной верификации диагноза, дифференциальной диагностики степени тяжести неопластического процесса требуется поиск новых неинвазивных биомаркеров с высокой диагностической и прогностической точностью. Липидомный анализ неопластически измененных тканей ШМ с помощью масс-спектрометрии рассматривается как высокоточный метод поиска биомаркеров ВПЧ-ассоциированных заболеваний ШМ [8]. В частности, F. Cheng и соавт. разработали панель липидных биомаркеров, включающую фосфатидилхолин и фосфатидилэтаноламин, которая позволяет отграничить раннюю стадию РШМ от плоскоклеточного интраэпителиального поражения (SIL) различной степени тяжести [9]. В исследовании I. Khan и соавт. были изучены и сопоставлены семь метаболитов — аденозинмонофосфат, аспартат, глутамат, гипоксантин, лактат, пролин и пироглутамат — при SIL и РШМ. При SIL различной степени тяжести уровни метаболитов в плазме крови были статистически значимо (p < 0,0001) выше, чем в контрольной группе (NILM). Кроме того, повышенные уровни семи метаболитов в сочетании с положительным ВПЧ-статусом коррелировали со значительным риском прогрессирования неопластического процесса [10].
В этой связи чрезвычайно актуальны изучение и оценка диагностического потенциала липидома ШМ при поражениях, ассоциированных с ВПЧ, включая РШМ, методом масс-спектрометрии, создание панели липидов-маркеров для дифференциальной диагностики степени тяжести и прогнозирования течения неопластической трансформации.
Целью работы явилось изучение липидомного состава эпителия ШМ при ВПЧ-ассоциированных поражениях, направленное на определение маркеров для неинвазивной ранней диагностики SIL ШМ (коды МКБ-10: N87.0, N87.1, N87.2).
МАТЕРИАЛЫ И МЕТОДЫ
В одномоментное проспективное когортное исследование были включены 124 пациентки в возрасте от 21 года до 45 лет (средний возраст — 34 ± 9 лет), обратившиеся в научно-поликлиническое отделение ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации (НПО ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России).
Критерии включения:
- возраст от 21 года до 45 лет;
- ВПЧ высокого риска;
- интраэпителиальные поражения низкой и высокой степени, РШМ (гистологически подтвержденные);
- регулярный менструальный цикл;
- способность выполнять требования протокола;
- предоставление письменного информированного согласия на участие в исследовании.
Критерии исключения:
- беременность;
- период лактации;
- гормональная терапия;
- острые воспалительные заболевания;
- нарушение функции почек, печени, легких в стадии декомпенсации;
- психоневрологические заболевания.
Комплексное обследование женщин включало сбор клинико-анамнестических данных, определение гинекологического статуса, цитологическое исследование, ВПЧ-типирование, прицельную биопсию ШМ, гистологическое исследование биопсийного материала, липидомный анализ соскобов эпителия ШМ. Цитологическая оценка мазков с ШМ осуществлялась по системе Bethesda (2014).
Гистологическая верификация диагноза основывалась на двухуровневой гистопатологической классификации предраковых процессов ШМ. Согласно ей термин «цервикальная интраэпителиальная неоплазия легкой степени» (CIN I) соответствует LSIL, термин «цервикальная интраэпителиальная неоплазия умеренной и тяжелой степени» (CIN II–III) — плоскоклеточному интраэпителиальному поражению высокой степени (HSIL). Образцы тканей для гистологической верификации диагноза были получены посредством прицельной биопсии строго по показаниям в НПО ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Взятие соскобов с эпителия ШМ и цервикального канала проводилось с использованием цервикальной щеточки. Экстракция липидов из собранного биоматериала осуществлялась следующим образом: щеточка помещалась в эппендорф с 500 мкл смеси воды и метанола в объемном соотношении 1 : 1 и выдерживалась 5 минут в Vortex, а затем 5 минут в ультразвуковой ванне, после чего извлекалась из эппендорфа. Добавив в эппендорф 1 мл хлороформа, выдерживали эппендорф в Vortex 10 минут и далее 5 минут в центрифуге при 15 000 об/мин. В отдельную виалу отбирали нижний органический слой объемом 950 мкл. После высушивания в потоке азота липидный осадок растворяли в 200 мкл смеси изопропанола и ацетонитрила в объемном соотношении 1 : 1.
Анализ липидного состава ткани проводили методом высокоэффективной жидкостной хромато-масс-спектрометрии по разработанному ранее протоколу для определения липидного состава ткани с разделением на хроматографе Dionex UltiMate 3000 (Thermo Scientific, Германия) и детектированием на масс-спектрометре Maxis Impact qTOF (Bruker Daltonics, Германия) в режимах положительных и отрицательных ионов, образующихся в электроспрее [11]1. Для уточнения идентификации веществ дополнительно применялась тандемная масс-спектрометрия с окном сканирования 5 Да. Предобработку данных и идентификацию соединений осуществляли по протоколу, разработанному J.P. Koelmel и соавт. [12]. Номенклатура липидов соответствовала Lipid Maps. Данные нормировались с помощью автошкалирования.
Статистический анализ выполнен с использованием скриптов на языке R (3.3.3) в среде RStudio (1.383 GNU)2.
При измерении в режиме положительных ионов выбор липидов с целью построения логистической регрессии для дискриминации двух групп осуществлялся из набора липидов, отобранных как статистически значимые с использованием теста Манна — Уитни (p < 0,05), с последующим применением информационного критерия Акаике. При измерении в режиме отрицательных ионов — из набора липидов, отобранных с использованием дискриминантного анализа проекций на скрытые структуры и значения проекции переменной ПП > 1, с последующим применением информационного критерия Акаике. В качестве независимых переменных использовались уровни липидов, в качестве переменных отклика — диагнозы, где значение «0» присваивалось более легкому случаю, а «1» — более тяжелому. Количественные данные липидов, задействованных в построении моделей, представлены в виде медианы (Me) и квартилей (Q1; Q3).
Итоговая классификационная модель для каждого режима ионов строилась на основе 10 логистических регрессий для дискриминации каждой пары по принципу «1 против 1», где в каждой бинарной модели вычислялся потенциальный диагноз, а итоговый диагноз определялся исходя из того, какой из диагностических вариантов собрал наибольшее количество «голосов». Каждую промежуточную модель тестировали посредством кросс-валидации по отдельному объекту на образцах, определенных как принадлежащие к одной из двух категорий, которые дискриминировала данная модель. Чувствительность (Ч) и специфичность (С) промежуточных моделей оценивали по формулам:

Для определения принадлежности к тому или иному исходу выбирали порог, при котором сумма специфичности и чувствительности была наибольшей. Тестирование итоговой модели (на основе положительных ионов, отрицательных ионов и в обоих режимах) производили посредством внутренней кросс-валидации по отдельному объекту. Прогностическая ценность для диагностики каждого диагноза оценивалась как отношение числа верно поставленных диагнозов к числу установленных соответствующих диагнозов.
РЕЗУЛЬТАТЫ
В зависимости от результатов гистологического исследования биоптатов ШМ, полученных у 124 пациенток, было сформировано 5 групп:
- 1-я (контрольная) группа — NILM и ВПЧ (n = 8; 6,5%);
- 2-я группа — хронический цервицит и ВПЧ (n = 29; 23,4%);
- 3-я группа — LSIL (n = 32; 25,8%);
- 4-я группа — HSIL (n = 32; 25,8%);
- 5-я группа — РШМ (n = 23; 18,5%).
При анализе клинико-анамнестических данных статистически значимых различий между группами по возрасту, антропометрическим показателям, менструальной функции, акушерскому анамнезу не выявлено.
В ходе сопоставления цитологических заключений с гистологическими диагнозами частота совпадения результатов морфологических методов во 2-й группе (хронический цервицит и ВПЧ) составила 62,1% (18/29), в 3-й (LSIL) — 62,5% (20/32), в 4-й (HSIL) — 71,9% (23/32), в 5-й группе (РШМ) — 78,3% (18/23).
Оценка липидома эпителия ШМ и цервикального канала производилась в выборке из 111 образцов: 8 из них (7,2%) были взяты в 1-й группе (NILM и ВПЧ); 29 (26,1%) — во 2-й (хронический цервицит и ВПЧ); 32 (28,8%) — в 3-й (LSIL); 19 (17,1%) — в 4-й (HSIL); 23 (20,7%) — в 5-й группе (РШМ).
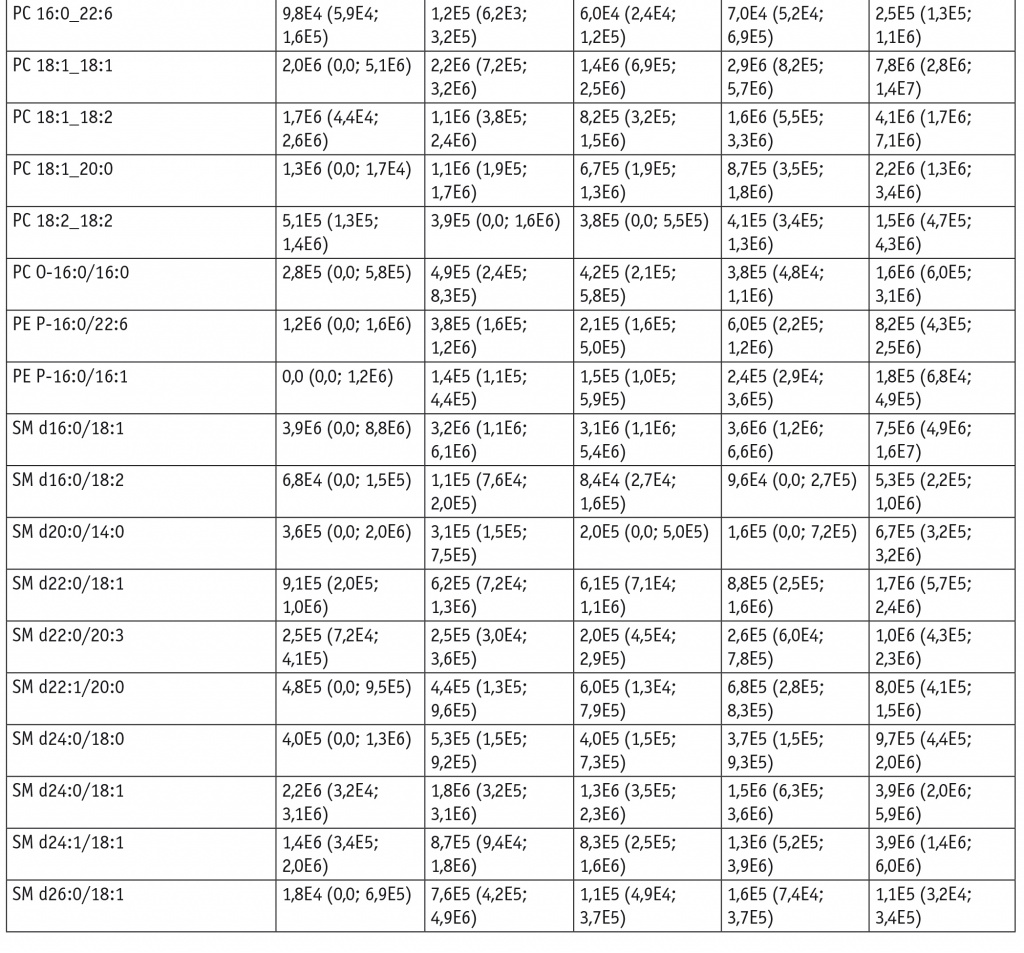
Для оценки липидома неопластически измененных тканей ШМ выбраны потенциальные липиды-маркеры, характеризующие различия между тканями и пригодные для построения моделей. В моделях для режима положительных ионов задействованы преимущественно холестериновые эфиры, церамиды, лизо- и фосфатидилхолины, а также фосфатидилэтаноламины и триацилглицеролы с простой эфирной связью (табл. 1). В моделях для режима отрицательных ионов задействованы преимущественно лизо- и фосфатидилхолины, сфингомиелины и окисленные фосфолипиды (табл. 2).
Таблица 1
Липиды-маркеры, использованные для построения заданной дискриминационной модели в режиме положительных ионов
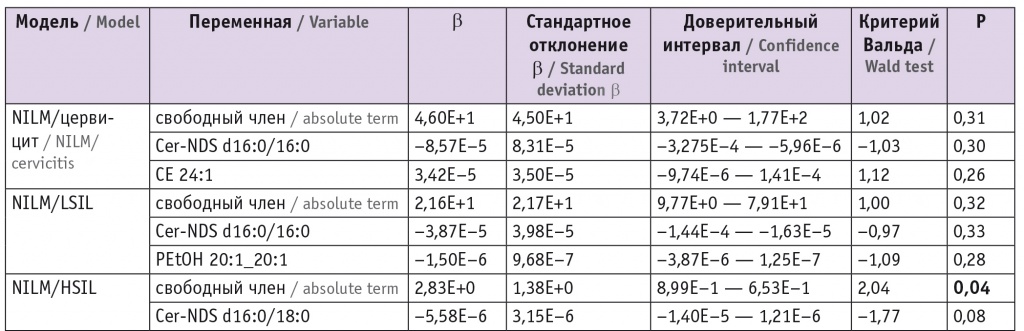
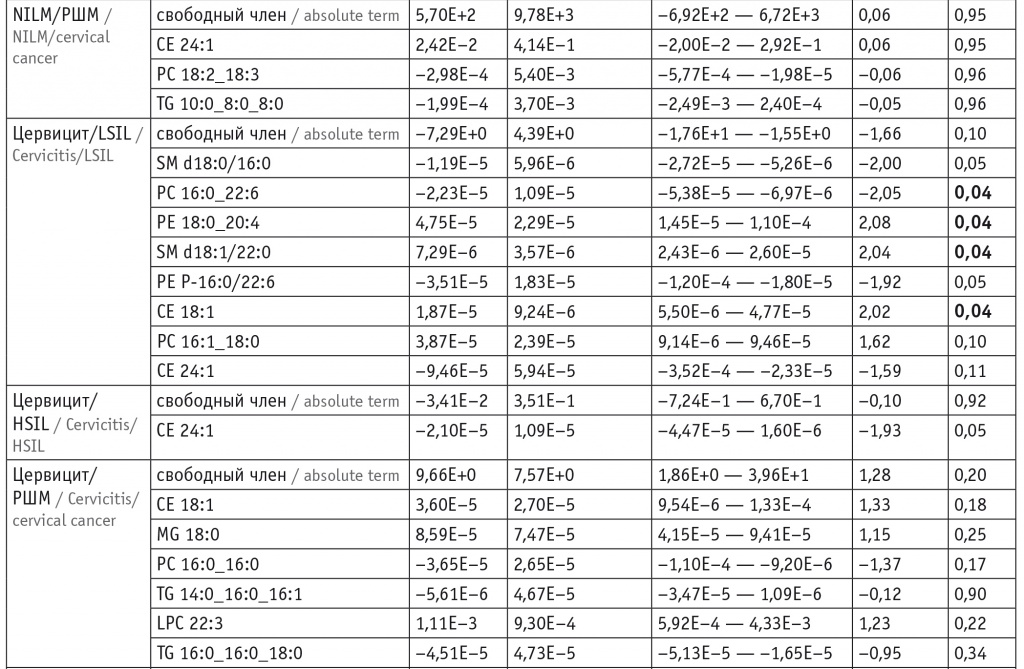
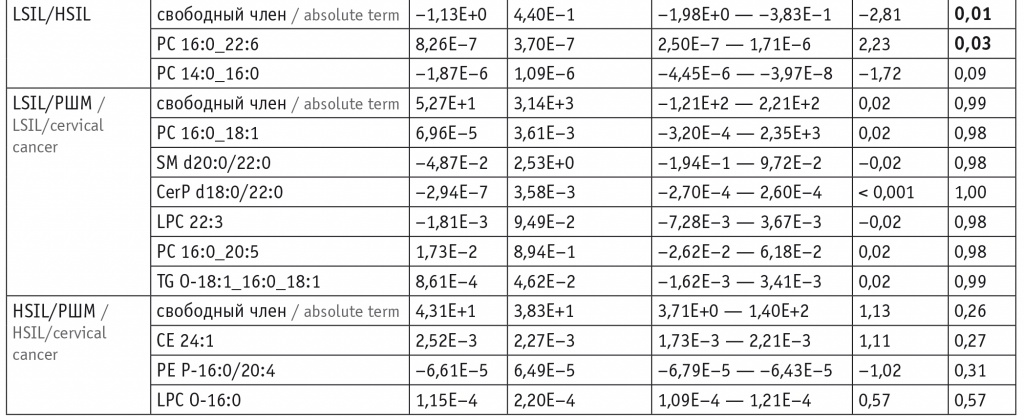
Примечания. 1. В таблицах 1, 2: β — коэффициент логистической регрессии; p — вероятность нулевого значения β-коэффициента. Отношения шансов и их доверительные интервалы равны 1 при заданной точности (2 знака после запятой).
2. В таблицах 1–6: РШМ — рак шейки матки; LSIL и HSIL — плоскоклеточное интраэпителиальное поражение низкой и высокой степени соответственно; NILM — внутриэпителиальных злокачественных изменений или злокачественности не выявлено.
Таблица 2
Липиды-маркеры, использованные для построения заданной дискриминационной модели в режиме отрицательных ионов
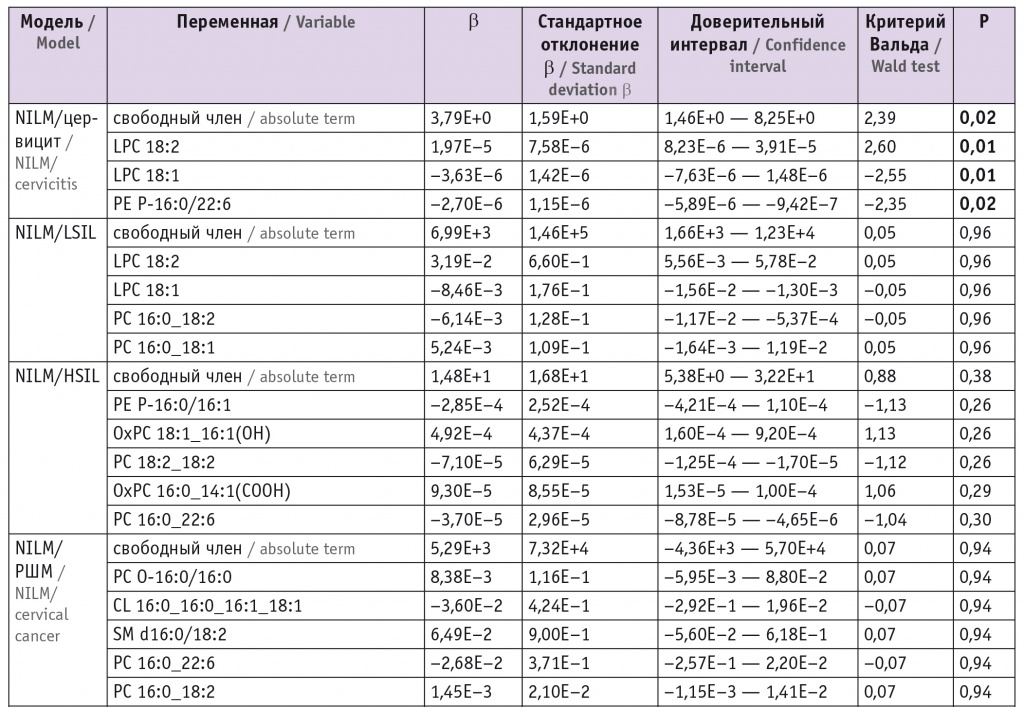
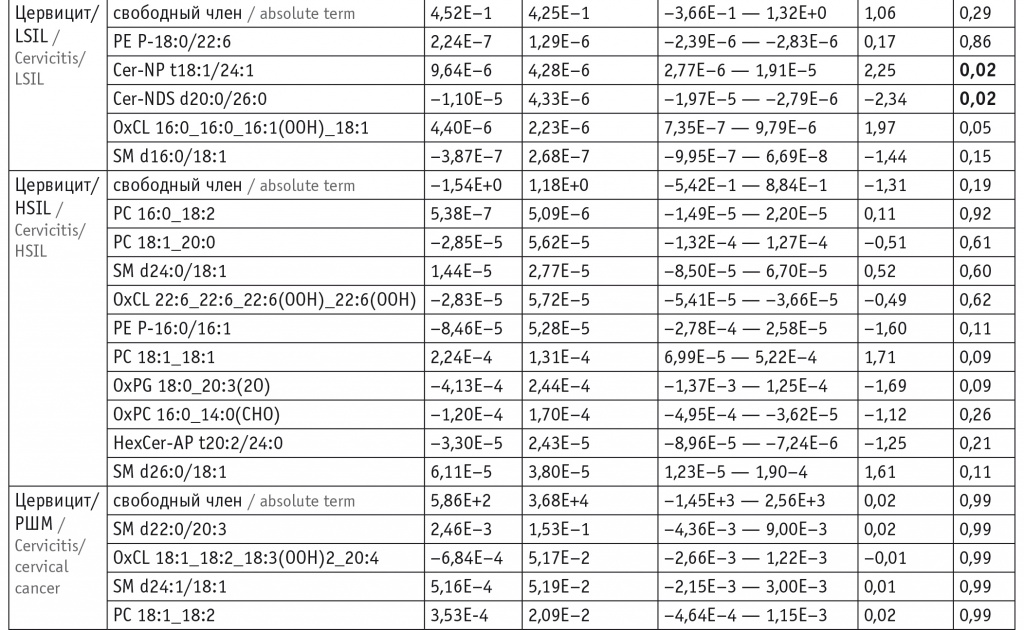
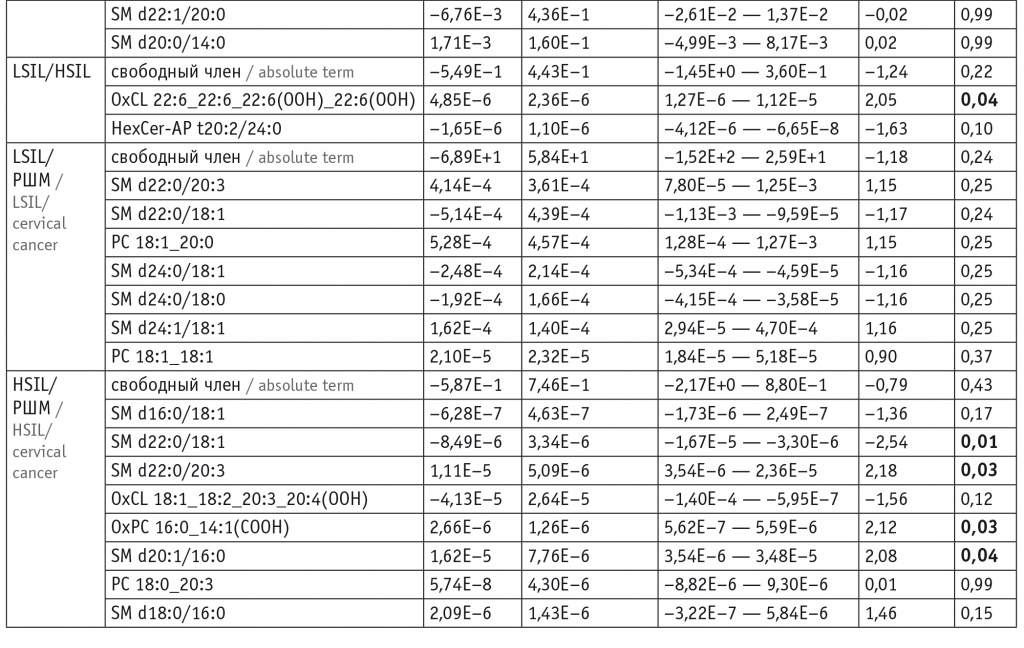
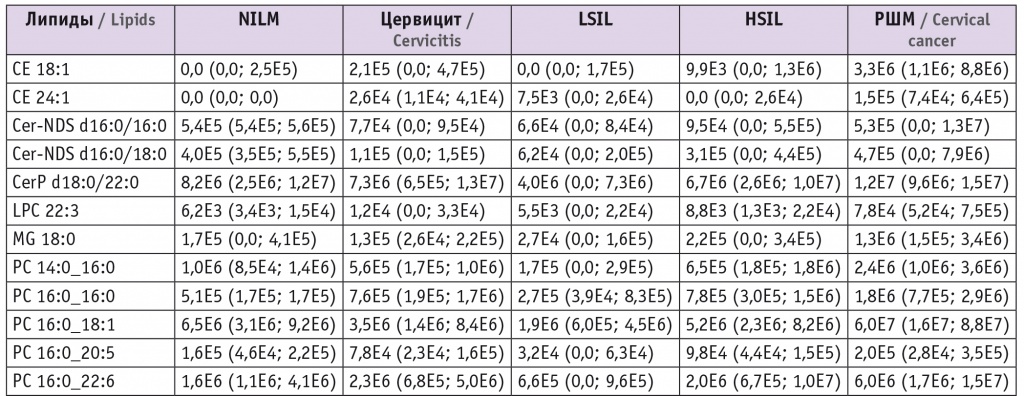
При этом в режиме положительных ионов различие с контролем в липидных профилях групп цервицита, LSIL и HSIL выражалось в понижении уровня церамидов (p < 0,001 для Cer-NDS d16:0/16:0 и Cer-NDS d16:0/18:0 как при цервиците, так и при LSIL и p = 0,04 для Cer-NDS d16:0/18:0 при HSIL). В группе РШМ в сравнении с группой контроля наблюдались повышение показателей фосфатидилхолинов (p = 0,004 для PC 16:0_18:1, p = 0,02 для PC 14:0_16:0, p = 0,03 для PC 16:0_20:4 и PC 16:1_18:0) и холестериновых эфиров (p < 0,001 для CE 18:1 и CE 24:1), понижение уровня триацилглицеролов (p = 0,03 для TG 10:0_8:0_8:0) (табл. 3).
Таблица 3
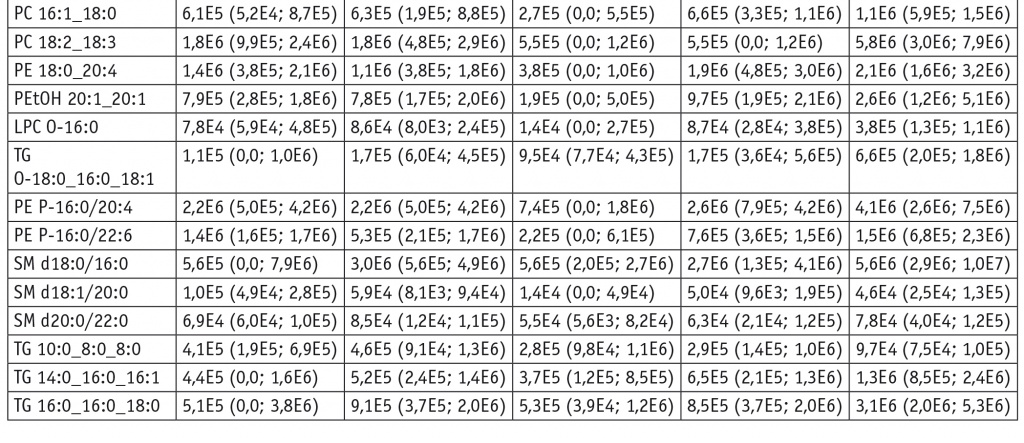
Уровни липидов в соскобах, использованных для построения моделей в режиме положительных ионов, в относительных единицах при каждом диагнозе, Me (Q1; Q3)
В режиме отрицательных ионов отмечалось повышение уровней фосфатидилхолинов и сфингомиелинов при РШМ относительно таковых в группе NILM (p = 0,005 и p = 0,02 для PC O-16:0/16:0 и PC 16:0_18:2 соответственно и p = 0,002 для SM d16:0/18:2). В группах хронического цервицита и LSIL по сравнению с контрольными данными наблюдался более высокий уровень лизофосфатидилхолинов (p = 0,03 и p = 0,02 соответственно для LPC 18:2) (табл. 4).
Таблица 4
Уровни липидов в соскобах, использованных для построения моделей в режиме отрицательных ионов, в относительных единицах при каждом диагнозе, Me (Q1; Q3)
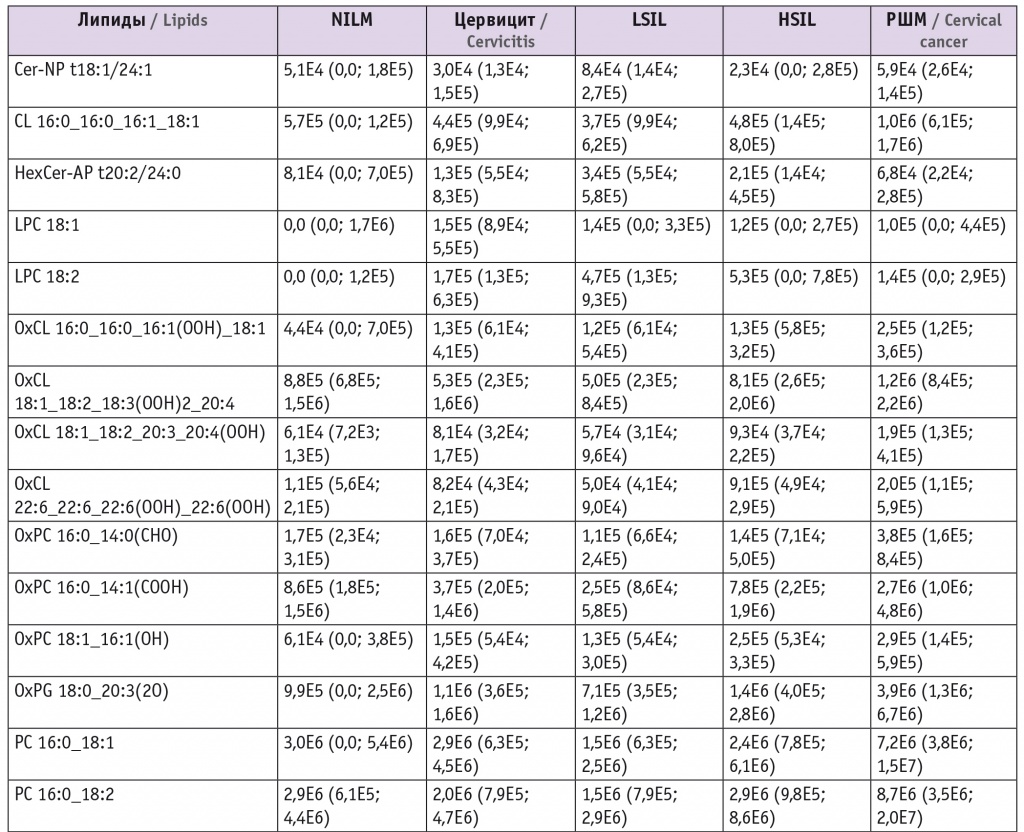
При изучении холестериновых эфиров в режиме положительных ионов выявлены падение их уровней относительно воспаления при LSIL и HSIL (p = 0,008 и p = 0,02 для CE 18:1 и CE 24:1 соответственно при LSIL и p = 0,02 для CE 24:1 при HSIL) и повышение — при РШМ (p < 0,001 для CE 18:1). Обнаружено также, что в сравнении с показателями при воспалении при LSIL понижаются уровни фосфатидилхолинов и сфингомиелинов (p = 0,001 для PC 16:0_22:6 и p = 0,04 для PC 16:1_18:2, p = 0,004 для SM d18:0/16:0 и p = 0,01 для SM d18:1/22:0), а при РШМ растут уровни фосфатидилхолинов (p < 0,001 и p = 0,02 для PC 14:0_16:0 и PC 16:0_16:0 соответственно) и триглицеролов (p < 0,001 и p = 0,02 для TG 16:0_16:0_18:0 и TG 14:0_16:0_16:1 соответственно) (см. табл. 3).
В режиме отрицательных ионов четко определяется рост уровней фосфатидилхолинов (p < 0,001) и сфингомиелинов (p < 0,001 для SM d22:0/20:3 и SM d24:1/18:1, p = 0,02 для SM d20:0/14:0) при РШМ относительно таковых при воспалении (см. табл. 4).
Рост уровней фосфатидилхолинов и сфингомиелинов относительно LSIL характерен как для HSIL (p = 0,002 для PC 16:0_22:6 и PC 14:0_16:0, p = 0,02 для SM d18:1/20:0), так и для РШМ (p < 0,001 для PC 16:0_18:1, LPC 22:3 и PC 16:0_20:5, p = 0,02 для SM d20:0/22:0). К липидным маркерам, характеризующим различия между HSIL и РШМ, относятся липидные эфиры (p = 0,03 и p = 0,04 для LPC O-16:0 и PE P-16:0/20:4 соответственно) и сфингомиелины (p = 0,009 для SM d16:0/18:1 и SM d22:0/20:3, p = 0,02 для SM d18:0/16:0), чьи уровни растут при раке (см. табл. 3, 4).
На основе построенных дискриминационных моделей, чьи характеристики приведены в таблице 5, были построены классификационные модели в режимах положительных (модель 1) и отрицательных (модель 2) ионов и модель 3, для которой использовались дискриминационные модели в обоих режимах (табл. 6). Точность первой и второй моделей составила 70% и 71% соответственно, точность третьей модели — 79%. Метод продемонстрировал высокую прогностическую ценность для дифференциальной диагностики хронического цервицита и РШМ относительно NILM.
Таблица 5
Характеристики дискриминационных моделей на основе логистической регрессии, полученные в ходе кросс-валидации
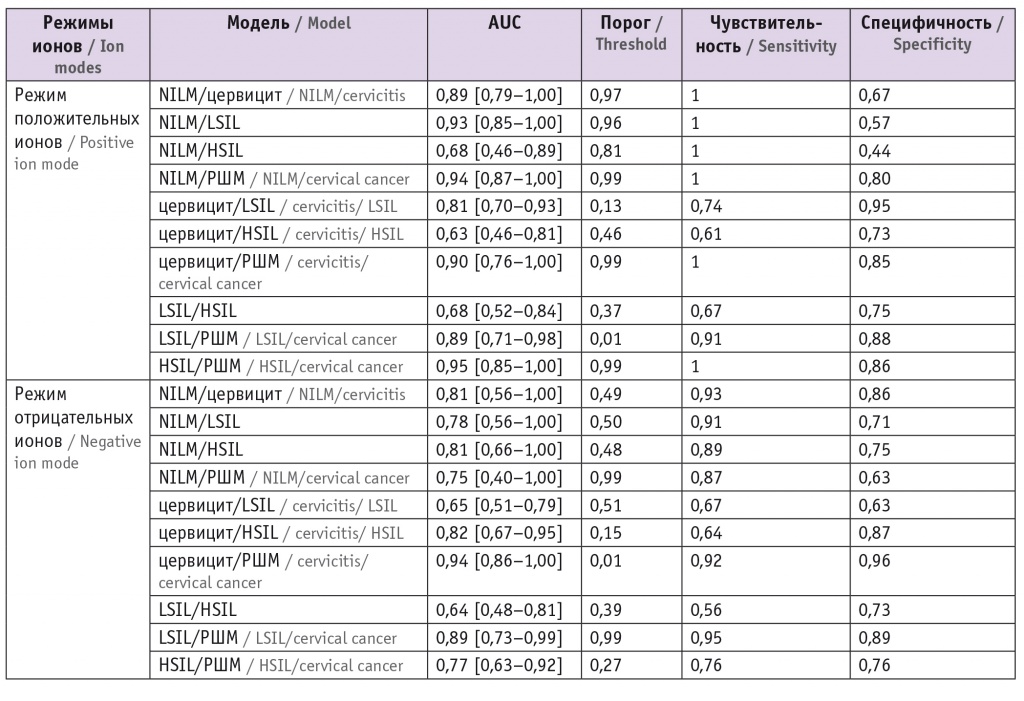
Таблица 6
Характеристики итоговых классификационных моделей, полученные в ходе кросс-валидации
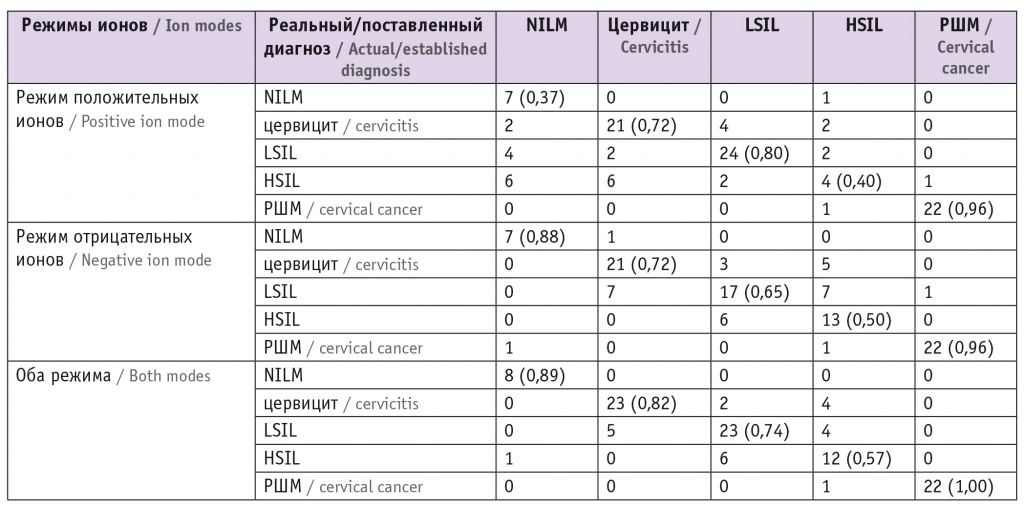
Примечание. В скобках указано значение прогностической ценности.
ОБСУЖДЕНИЕ
Холестериновые эфиры и холестерол накапливаются в макрофагах [13], которые отвечают за поглощение умерших клеток. Ранее на примере рака почки было показано, что в раковых клетках нарушается холестериновый метаболизм [14]. Нейтральная сфингомиелиназа, обеспечивающая разложение сфингомиелинов на церамиды и фосфат холина, является опухолевым супрессором и участвует в активации сигналов, связанных с воспалительными процессами [15, 16]. Фосфатидилхолины связаны с процессом канцерогенеза [17, 18]. A.M. Porcari и соавт. продемонстрировали разницу в уровнях церамидов и метаболитов сфингозина в нормальных тканях ШМ и тканях с поражением HSIL+, а также потенциальную пригодность этих соединений для различения нормы и HSIL+ по анализу липидома тканей [19]. М.Е. Некрасовой и соавт. фосфатидилхолины и сфингомиелины предложены для дифференциальной диагностики неопластических поражений при масс-спектрометрическом анализе биопсийного материала ШМ [20].
Итоговая модель из представленного нами исследования имеет более высокую специфичность относительно РШМ, чем модели, построенные на основе иммуноцитохимического анализа с применением белков p16/Ki-67, микроРНК и ДНК ВПЧ [21]. Следует отметить также, что вышеупомянутые методы основаны на использовании соединений, связанных с ВПЧ и неопластическими преобразованиями, и это затрудняет дифференцирование поражений с малой и отсутствующей вирусной нагрузкой (LSIL/цервицит/NILM). Высокий диагностический потенциал по различению NILM и SIL имеют также модели на основе липидов-маркеров сыворотки крови [9].
ЗАКЛЮЧЕНИЕ
Представленный анализ липидного профиля методом масс-спектрометрии позволяет провести дифференциальную диагностику плоскоклеточного интраэпителиального поражения высокой степени (HSIL) и рака шейки матки (РШМ) относительно поражений низкой степени (LSIL, цервицит) и нормы (NILM). Диагностическая панель липидома эпителия шейки матки у пациенток с HSIL и РШМ характеризуется преобладанием липидов групп фосфатидилхолинов и сфингомиелинов, а также холестериновых эфиров. Примененный в работе неинвазивный метод продемонстрировал высокую прогностическую ценность для дифференциальной диагностики воспаления и РШМ относительно NILM, а также среднюю прогностическую ценность в отношении LSIL. Полученные нами результаты свидетельствуют о высокой информативности метода масс-спектрометрии для ранней диагностики предраковых заболеваний и РШМ.
Поступила: 11.05.2021
Принята к публикации: 17.07.2021
________
1 R Core Team (2018). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL: https://www.gbif.org/ru/tool/81287/r-a-language-and-environment-for-statistical-computing (дата обращения — 04.03.2021).
2 Там же; R Core Team (2019). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL: https://www.scirp.org/(S(lz5mqp453edsnp55rrgjct55))/reference/ReferencesPapers.aspx?ReferenceID=2631... (дата обращения — 04.03.2021).







