Организм человека колонизирует широкий спектр микроорганизмов. Так, в ходе проведения проекта «Микробиом человека» Национального института здоровья США у 300 добровольцев с помощью секвенирования были выделены в общей сложности более 11 000 видов микроорганизмов. При этом совокупность их генов в среднем в 36 раз превышала совокупность генов организма хозяина[34].
Микробиоценоз женских половых путей представляет собой динамическую биосистему, основной задачей которой является осуществление барьерной функции в отношении патогенных и условно-патогенных бактерий[10]. Нарушения микробиоценоза влагалища и цервикального канала играют большую роль в патогенезе инфекционно-воспалительных осложнений гестационного процесса[5], что обусловливает актуальность изучения особенностей микробиологического пейзажа и его взаимосвязи с состоянием местной иммунореактивности.
До недавнего времени считалось, что основные функции микробиоты в организме-хозяине — это синтез ряда витаминов и жирных кислот, ферментов, способствующих лучшему усваиванию нутриентов, а также защита от патогенных микроорганизмов вследствие конкурентной адгезии к эпителиальным клеткам[12]. Однако в исследованиях последних лет обнаружено, что взаимодействие между хозяином и микробиотой намного сложнее, чем представлялось ранее. In vivo и in vitro было показано, что нормальная микрофлора способна влиять на клеточные сигнальные пути, тем самым регулируя интенсивность местного иммунного ответа[21].
Основными сигнальными рецепторами системы врожденного (неспецифического) иммунитета являются Toll-подобные рецепторы (TLR). Они способны распознавать структуры мембран бактерий, грибов и простейших (TLR1, 2, 4, 5 и 6), вирусные РНК и ДНК, а также неметилированную ДНК бактерий (TLR3, 7, 8 и 9) и эндогенные лиганды[2]. Известно, что они инициируют и определяют интенсивность не только неспецифического, но и специфического (приобретенного) иммунного ответа[23].
Наиболее хорошо изучено взаимодействие микробиоты и TLR в ЖКТ. Выявлено, что в кишечнике группу TLR, находящихся на клеточной мембране, стимулируют компоненты клеточной стенки нормальной микрофлоры. Эта базальная стимуляция поддерживает напряженность иммунного ответа, препятствуя инвазии патогенных микроорганизмов[35]. Снижение экспрессии TLR или отсутствие их лигандов блокирует способность эпителия противостоять инвазии патогенных микроорганизмов и снижает эффективность заживления повреждений[24].
Аналогичные функции выполняют и представители нормальной микрофлоры женских половых путей (лакто- и бифидобактерии), — причем во время беременности принципиально важны взаимоотношения цервикального биотопа и системы врожденного иммунитета, которые интегрально направлены на защиту матери и плода.
Цель исследования: изучить особенности экспрессии TLR1–10 в эпителии цервикального канала в сроки 38–41 недели беременности и их роль в патогенезе инфекционно-воспалительных осложнений послеродового периода.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе проспективного наблюдательного исследования, которое проводили на базе Белгородской областной клинической больницы Св. Иоасафа в 2010–2012 гг., с целью изучения факторов риска развития послеродового эндометрита авторы обследовали 85 беременных женщин в сроки 38–41 недели гестации с высокой степенью инфекционного риска.
Критериями включения были:
- клинико-анамнестические данные — гестационный пиелонефрит или обострение хронического пиелонефрита в течение беременности, угроза прерывания беременности на протяжении всего срока гестации, наличие в анамнезе неспецифических воспалительных заболеваний женских половых органов, послеродовых и послеабортных эндометритов;
- бактериологические и бактериоскопические признаки — наличие вагинита, подтвержденного данными бактериоскопического исследования, выявление условно-патогенной флоры в цервикальном канале в количестве более 103–4 КОЕ/мл по данным бактериологического исследования;
- данные эхографического исследования — признаки внутриутробного инфицирования (плацентомегалия, наличие взвеси в околоплодных водах, вентрикуломегалия и пиелоэктазия у плода)[6, 11].
Критерии исключения: срок беременности менее 37 недель, в том числе преждевременное излитие околоплодных вод при недоношенной беременности; наличие тяжелой акушерской и экстрагенитальной патологии (преэклампсия, сахарный диабет, в том числе гестационный, дыхательная и сердечная недостаточность и др.); поливалентная аллергическая реакция на лекарственные препараты; отказ от участия в исследовании.
После родоразрешения все 85 пациенток были разделены на две группы — с развившимся послеродовым эндометритом (I группа, n = 21) и с нормально протекавшим послеродовым периодом (II группа, n = 64).
Критериями послеродового эндометрита (включения в I группу) являлись: повышение температуры тела — у пациенток со стертой формой эндометрита до 37,5–38,5 °С, с тяжелой — до 39 °С; симптомы общей интоксикации, лейкоцитоз (более 11 × 109/л) с нейтрофильным сдвигом; СОЭ > 30 мм/ч, субинволюция матки, признаки хориодецидуита и амниохориодецидуита при гистологическом исследовании. Эхографическое исследование матки использовали как вспомогательный метод, рассматривая в качестве эхографических признаков эндометрита субинволюцию матки и расширение ее полости более 10 мм.
Бактериоскопическое и бактериологическое исследования выполняли в бактериологической лаборатории Белгородской областной клинической больницы Св. Иоасафа (главный врач — д. м. н., профессор Ж. Ю. Чефранова, зав. лабораторией — Г. А. Тафинцева). Бактериоскопическое исследование содержимого влагалища и цервикального канала проводили после окрашивания мазков по Граму. Возбудителей ИППП выявляли методом ПЦР.
Для верификации видов аэробных и анаэробных микроорганизмов использовали бактериологический метод в соответствии с методическими рекомендациями Б. А. Ефимова и соавт. (2002)[3]. Аэробные микроорганизмы культивировали в суховоздушном термостате ТВ-80-1 (Касимовский завод, Россия). Исследование анаэробных микроорганизмов проводили в бескислородных условиях в термостате-анаэростате MCO-15AC (Sanyo, Япония).
Посев аэробных микроорганизмов первоначально делали на 5%-й кровяной агар с последующим отсевом на селективные среды. Для выделения энтерококков использовали селективный Bile esculin azidе agar (Sigma-Aldrich, США), позволяющий отграничить их от других стрептококков на основании их способности расти в присутствии желчи. Для выделения стафилококков применяли желточно-солевой Staphylococcus agar (Conda, Испания). Дифференциальную диагностику между эпидермальным и золотистым стафилококком проводили на основании способности последнего к плазмокоагуляции.
Для обнаружения кишечной палочки делали посев на среду Эндо (ЗАО «НИЦФ», Россия). Энтеробактерии, клебсиеллу, протей, синегнойную палочку культивировали на среде MacConkey (Conda, Испания) с последующей микроскопической идентификацией и верификацией на основании определения оксидазной, каталазной, лецитиназной активности.
Лактобактерии культивировали на среде MRS (ЗАО «НИЦФ», Россия), на которой они росли в виде белых гладких или шероховатых колоний и не обладали при этом оксидазной и каталазной активностью. Бифидобактерии высевали на твердой среде Блаурокка (Conda, Испания) в течение 72 часов, они имели типичный вид «куриной косточки» при бактериоскопическом исследовании колоний. Для обнаружения грамположительных спорообразующих клостридий посевы производили на среду Columbia agar base (Sigma-Aldrich, США) с добавлением 5% крови и 24-часовой анаэробной инкубацией. Бактероиды высевали на селективной среде Bacteroides Bile esculin agar (Sigma-Aldrich, США). Для выделения других облигатно- и факультативно анаэробных бактерий использовали Schaedler agar (Sigma-Aldrich, США) и жидкую тиогликолевую среду Fluid Thioglycollate medium (Becton Dickinson, США). Грибы рода Candida высевали на среде Сабуро (ЗАО «НИЦФ», Россия) в течение 72 часов.
Производили подсчет колоний, концентрацию микроорганизмов выражали в колониеобразующих единицах на 1 мл (КОЕ/мл).
Экспрессию мРНК TLR1–10 определяли методом количественной ПЦР в НИЛ «Молекулярная генетика человека» Белгородского государственного национального исследовательского университета (зав. лабораторией — д. м. н., профессор М. И. Чурносов).
Материалом для определения экспрессии мРНК TLR1–10 служили клетки эпителия цервикального канала, которые получали с помощью цитощетки. Их помещали в консервирующий раствор RNAlater (Ambion, США). Исследование экспрессии мРНК TLR1–10 проводили c помощью количественной обратно-транскриптазной ПЦР согласно рекомендациям Minimum information for publication of quantitative Real-Time PCR experiments[19]. РНК выделяли методом фенол-хлороформной экстракции, описанным производителем, с использованием реагента «Тризол» (Invitrogen, США). Качество РНК проверяли методом электрофореза в течение 15 минут при напряжении 10 V/см по интенсивности свечения полос рибосомальной РНК в 1,1%-м агарозном геле с бромистым этидием. Затем образцы обрабатывали ДНКазой (DNAse I RNAse free, Fermentas, США) для удаления геномной ДНК согласно инструкции производителя. Для проведения обратной транскрипции использовали набор «Обратная транскриптаза Mint» («Евроген», Россия).
Для инициации реакции применяли олигодезоксинуклеотиды, синтезированные фирмой «Евроген». Реакцию обратной транскрипции производили по инструкции производителя на амплификаторе «Терцик» («ДНК-технология», Россия). В реакцию вносили 500 нг РНК, предварительно прогретой до 55 °С (концентрацию РНК проверяли на спектрофотометре NanoDrop, Thermo Scientific, США). Качество полученной комплементарной ДНК (кДНК) оценивали с помощью гель-электрофореза в 1,1%-м агарозном геле с бромистым этидием.
Для количественной ПЦР использовали разведение полученной кДНК со стерильной водой в объеме 1 : 25. Подбор праймеров генов осуществляли с помощью базы данных Basic Local Alignment Search Tool[29]. Полученные пары праймеров были протестированы на возможность образования «шпилек» и димеров с помощью программы Beacon Designer Free Edition.
Для ПЦР в режиме реального времени использовали смесь qPCRmix-HS SYBR («Евроген», Россия). C помощью программы GeNorm-Plus в качестве генов-нормировщиков были выбраны наиболее стабильно экспрессируемые — β-актин и пептидил-пролил-изомераза A. Амплификацию проводили в амплификаторе CFX96 (Bio-Rad, США). Полученные результаты выражали в относительных единицах, вычисляя их по формуле:
R = 2 – (Cq target – (Cq ref1 + Cq ref2)/2),
где:
R — нормализованная экспрессия мРНК исследованных генов,
Cq (quantification cycle) target — пороговый цикл исследованного гена,
Cq ref1 и Cq ref2 — пороговые циклы генов-нормировщиков[33].
Статистическую обработку результатов выполнили с использованием программы Statistica 6.0, лицензия № AXXR505C705306FAN12 (StatSoft, США). Проверку нормальности распределения признаков проводили с помощью критериев Колмогорова — Смирнова и Шапиро — Уилка. Так как результаты не подчинялись нормальному распределению, анализ статистической значимости различий между двумя независимыми группами производили с помощью критерия Манна — Уитни, а корреляционный анализ — c использованием критерия Спирмена. Корреляционную связь расценивали как слабую при r < 0,03, умеренную — при r = 0,3–0,49, среднюю — при r = 0,5–0,69, сильную — при r ≥ 0,07[4]. Результаты считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Авторами был выполнен анализ состояния микробиоценоза половых путей у беременных с высокой степенью инфекционного риска. Между группами пациенток с развившимся впоследствии эндометритом и женщин, у которых пуэрперий протекал без осложнений, не было выявлено значимых различий по данным бактериоскопического исследования. С одинаковой частотой в обеих группах обнаруживали и возбудителей ИППП. Так как основными возбудителями послеродовых эндометритов являются условно-патогенные микроорганизмы, пациенткам обеих групп также было проведено бактериологическое исследование. У обследованных I группы чаще находили микроорганизмы рода Staphylococcus (81,0 ± 8,6% против 45,3 ± 6,2% во II группе; p < 0,05) за счет S. epidermidis (61,9 ± 10,6% против 37,5 ± 6,1%; p < 0,05), а также Klebsiella (33,3 ± 10,3% против 1,6 ± 1,6% во II группе; p < 0,05) (табл. 1). У пациенток обеих групп не было выявлено статистически значимых различий в частоте встречаемости анаэробных бактерий.
Таблица 1
Данные бактериологического исследования у беременных с высокой степенью инфекционного риска (P ± p), %
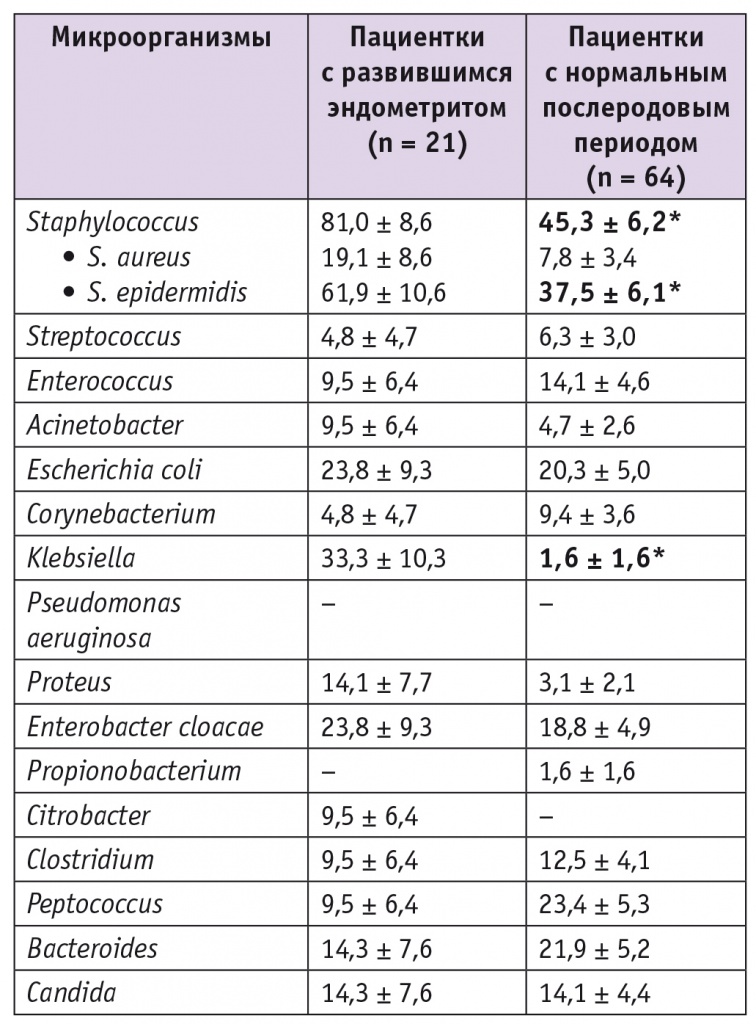
* P < 0,05.
Было установлено, что ассоциации микроорганизмов (три и более возбудителя) у пациенток с развившимся в дальнейшем эндометритом выделяли в 1,4 раза чаще, чем у женщин, не имевших осложнений в послеродовом периоде.
Это соотносится с данными литературы, согласно которым основными возбудителями послеродового эндометрита являются условно-патогенные микроорганизмы (ассоциации аэробов и анаэробов) — представители нормальной микрофлоры половых путей женщин[20]. Высокая вероятность развития послеродового эндометрита связана с феноменом «кооперативной чувствительности», или «чувства кворума» (quorum sensing)[1]. Он заключается в том, что до начала инфекционного процесса группа микроорганизмов обменивается сигнальными соединениями, активирующими запуск факторов патогенности.
Следующей задачей исследования стали определение экспрессии мРНК TLR1–10 в эпителии цервикального канала при доношенном сроке беременности и их оценка в качестве прогностических маркеров послеродового эндометрита.
Было выявлено, что в цервикальном канале на поздних сроках беременности у тех пациенток, которым в послеродовом периоде был выставлен диагноз послеродового эндометрита, экспрессия мРНК TLR4 была в 3,4 раза, а TLR5 — в 28,1 раза ниже, чем во II группе (табл. 2).
Таблица 2
Экспрессия Toll-подобных рецепторов в эпителии цервикального канала у беременных с высокой степенью инфекционного риска (Ме [25-й; 75-й процентили]), относительные единицы
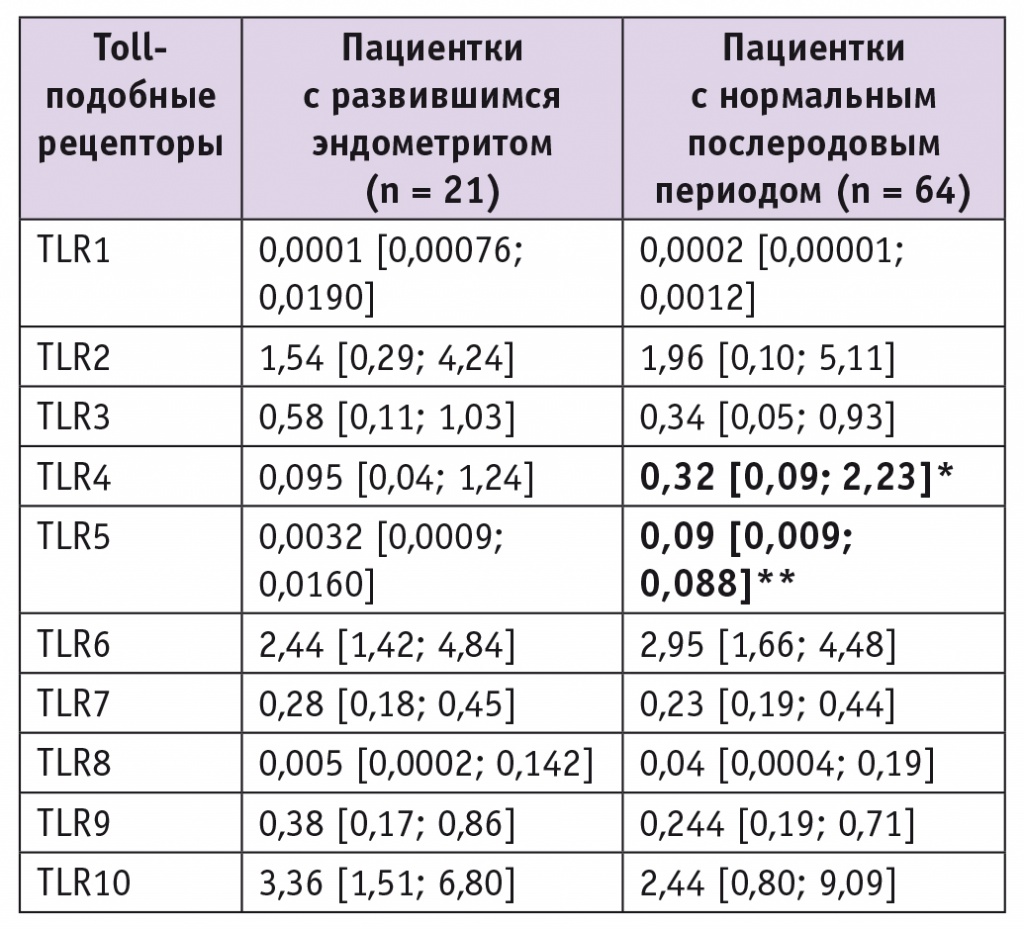
* P < 0,05.
** P < 0,01.
По-видимому, снижение экспрессии TLR4 и TLR5 является одним из основных механизмов развития послеродового эндометрита. Данных о роли TLR в развитии послеродовых гнойно-септических заболеваний у женщин в отечественной и зарубежной литературе практически нет. В наших более ранних работах мы выявили, что у пациенток с послеродовым эндометритом наблюдается снижение экспрессии TLR4 и TLR5, а также белков их сигнального пути MyD88 и NF-kB в эпителии цервикального канала на 3-и сутки после родов[7, 8].
Кроме того, в клиническом исследовании B. Schaaf и соавт. (2009) установлено, что у больных с сепсисом различной локализации снижение экспрессии другого сигнального рецептора, TLR2, на моноцитах периферической крови ассоциировано с высоким процентом летальных исходов[37].
Ряд авторов показывает роль снижения экспрессии TLR4 и TLR5 в развитии воспалительных процессов другой локализации. В эксперименте установлено, что на 5-е сутки после трансуретрального введения Escherichia coli у инфицированных мышей, нокаутированных по TLR5, бактериальная обсемененность почек и мочевого пузыря была существенно выше, чем у контрольной дикой линии мышей. Это сопровождалось более выраженными гистологическими признаками воспаления и снижением выживаемости[13]. Снижение экспрессии TLR4 и TLR5, по-видимому, приводит к уменьшению выработки провоспалительных цитокинов и антимикробных пептидов на поверхности слизистых, что может способствовать инвазии возбудителя даже при небольшом количестве патогена.
С целью выявления взаимосвязи между экспрессией TLR в цервикальном канале и бактериальной обсемененностью у пациенток с доношенной беременностью был проведен корреляционный анализ (табл. 3).
Таблица 3
Корреляция между микроорганизмами и экспрессией Toll-подобных рецепторов (TLR) 1–10 в цервикальном канале при доношенной беременности (n = 85), критерий Спирмена
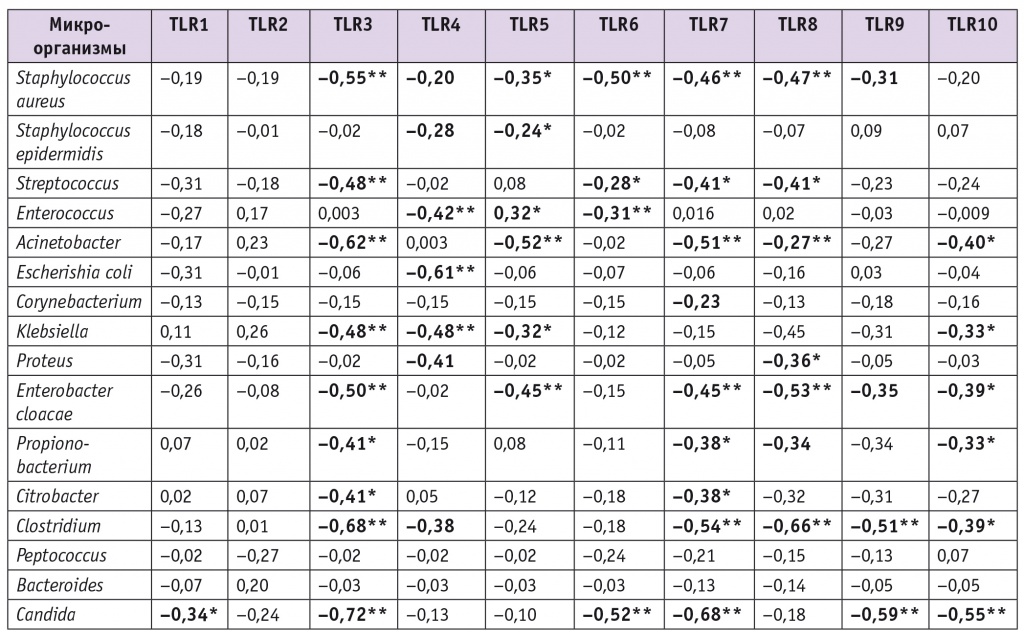
Примечание. Знаком (*) отмечены статистически значимые корреляции: (*) — p < 0,05; (**) — p < 0,01.
Было установлено, что экспрессия TLR3–10 имеет значимую отрицательную корреляционную связь с концентрацией грамположительных и грамотрицательных бактерий, преимущественно умеренную и среднюю. Это свидетельствует о том, что снижение экспрессии вышеуказанных сигнальных рецепторов может способствовать увеличению количества условно-патогенных микроорганизмов в цервикальном канале.
В современной литературе содержится очень мало сведений о возможной взаимосвязи между бактериальной обсемененностью и экспрессией TLR.
Так, обнаружено, что активация TLR4 играет протективную роль при гонорейной инфекции, модулируя ранний иммунный ответ и ограничивая бактериальную репликацию[22, 32]. Известно, что внутриклеточные TLR, активируемые нуклеиновыми кислотами, в том числе TLR3, TLR7 и TLR8, способны реагировать не только на вирусные, но и на бактериальные лиганды[15]. Описано, что активация клеток Лангерганса, которые при дальнейшей их дифференцировке в дендритные клетки запускают как клеточный, так и гуморальный иммунный ответ, происходит через TLR2 и TLR3[30]. По-видимому, снижение экспрессии TLR3 на клетках Лангерганса снижает напряженность гуморального иммунного ответа, что способствует увеличению бактериальной обсемененности.
Так как TLR7 и TLR8 способны активировать NF-κB по MyD88-зависимому, а TLR3 — по MyD88-независимому пути с последующей выработкой провоспалительных цитокинов[24], снижение их экспрессии может приводить к персистенции возбудителя вследствие уменьшения местной иммунореактивности.
Помимо этого, нами установлена статистически значимая умеренная отрицательная корреляционная связь между количеством дрожжеподобных грибов рода Candida и TLR1, TLR3, TLR6, TLR7, TLR9 и TLR10.
В настоящее время показано, что для адекватного иммунного ответа на грибы рода Candida необходима выработка ИФН I типа, которая является TLR7-опосредованной[18]. Кроме того, V. Müller и соавт. (2007) выявили, что иммунный ответ на C. albicans через NF-κB инициируется не столько путем активации TLR2 и TLR4, сколько через TLR3[27]. TLR9 способен распознавать неметилированную ДНК Candida и также участвует в противогрибковом иммунном ответе[26]. Взаимосвязь TLR10 с иммунным ответом против Candida остается малоизученной. На основании вышеизложенного можно предположить, что снижение экспрессии TLR1, TLR3, TLR6, TLR7, TLR9 и TLR10 приводит к неэффективному иммунному ответу на дрожжеподобные грибы рода Candida, что способствует увеличению их концентрации.
В настоящее время ведется дискуссия о факторах, способствующих снижению экспрессии TLR. Неясно, является снижение экспрессии TLR причиной или следствием увеличения количества условно-патогенных микроорганизмов. Существуют две основные гипотезы, касающиеся снижения экспрессии TLR. Согласно первой, одно из основных условий стимуляции экспрессии TLR — нормальная микрофлора.
В культуре клеток макрофагов продемонстрировано, что живые бактерии Lactobacillus casei способны стимулировать экспрессию TLR2, а убитые — TLR2–4 и TLR9[40].
P. M. G. Vizoso и соавт. (2009) обнаружили, что лактобактерии способны стимулировать экспрессию TLR2, TLR4 и TLR5 во влагалище и шейке матки[39]. Было также установлено, что при пероральном приеме эубиотиков на поздних сроках беременности происходит увеличение экспрессии TLR, стимулируемых бактериальными лигандами, в плаценте и кишечнике плода, что способствует снижению бактериальной обсемененности[36]. Недавно Y. Kikuchi и соавт. (2015) описали способность L. plantarum стимулировать экспрессию TLR2, что в конечном счете приводило к увеличению продукции секреторного IgА[25].
Поэтому можно предположить, что одним из основных факторов снижения экспрессии TLR4 и TLR5 у родильниц с высокой степенью инфекционного риска является исходно низкое содержание во влагалище лакто- и бифидобактерий. Как известно, на доношенном сроке беременности в норме увеличивается количество эстрогенов, что не только способствует повышению сократимости миометрия[9], но и стимулирует синтез гликогена в эпителии, а это приводит к увеличению концентрации лактобацилл. Недостаточный уровень эстрогенов или другие причины снижения количества лактобацилл во влагалище могут вызывать уменьшение экспрессии TLR, результатом чего являются недостаточная напряженность местного иммунного ответа и, как следствие, увеличение концентрации условно-патогенных микроорганизмов.
Второй вероятной причиной снижения экспрессии сигнальных рецепторов может быть длительное воздействие на TLR бактериальных эндотоксинов. Так, в ряде исследований описано отсутствие иммунного ответа у моноцитов и нейтрофилов при длительной экспозиции эндотоксинов. Показано, что этот механизм реализуется через систему сигнальных рецепторов. Данный феномен носит название эндотоксиновой толерантности[16, 28]. Кроме того, установлено, что снижение экспрессии TLR способствует хронизации любых инфекционных процессов[31]. Напротив, у пациентов с циррозом печени исходно сниженный уровень TLR4 восстанавливается при терапии антибиотиками[38], что косвенно подтверждает эту гипотезу.
Необходимо дальнейшее изучение возможностей использования как TLR, так и других сигнальных рецепторов системы врожденного иммунитета в качестве прогностических маркеров развития воспалительного процесса и в качестве точек приложения для фармацевтических препаратов. В настоящее время для местного применения зарегистрирован препарат имиквимод, действующим веществом в котором является амин имидазохинолона, стимулирующий TLR7[17]. Препарат обладает преимущественно противовирусным и противоопухолевым действием и используется в комплексном лечении генитального герпеса и папилломавирусной инфекции. Перспективным представляется использование ряда иммуномодуляторов, в том числе отечественного производства, содержащих липопептиды (стимулируют TLR1, TLR2 и TLR6) или липополисахариды (TLR4). Одним из перспективных компонентов для создания препаратов, стимулирующих антиинфекционный иммунитет слизистых, является флагеллин, активирующий TLR5[14]. Однако наиболее эффективным и безопасным во время беременности можно считать применение лекарственных средств, содержащих лактобактерии и/или вещества, стимулирующие их рост (Гинофлор, Ацилакт, Вагинорм и др.). Препараты на основе агонистов TLR, а также про- и эубиотики могут быть использованы для профилактики инфекционно-воспалительных осложнений вне и во время беременности.
ЗАКЛЮЧЕНИЕ
Нарушения местного врожденного иммунитета, в частности снижение экспрессии Toll-подобных рецепторов (TLR) 4 (лиганд — липополисахарид грамотрицательных бактерий) и TLR5 (лиганд — флагеллин), могут являться причинами развития послеродового эндометрита. Снижение экспрессии TLR1–10 в цервикальном канале взаимосвязано с увеличением бактериальной обсемененности женских половых путей. Вероятные причины снижения экспрессии TLR включают как уменьшение количества лактобактерий, так и феномен эндотоксиновой толерантности.








